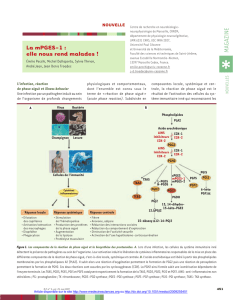
La signification pronostique de l`expression de la cyclooxygénase 2
publicité

MELANIE K. SACKETT LA SIGNIFICATION PRONOSTIQUE DE L'EXPRESSION DE LA CYCLOOXYGÉNASE 2 DANS LE CANCER DU LARYNX GLOTTIQUE DE STADE PRÉCOCE TRAITÉ PAR RADIOTHÉRAPIE Mémoire présenté à la Faculté des études supérieures de l'Université Laval dans le cadre du programme de maîtrise en épidémiologie clinique pour l'obtention du grade de maître ès science (M. Sc.) DÉPARTEMENT D'ÉPIDEMIOLOGIE FACULTÉ DE MÉDECINE UNIVERSITÉ LAV AL QUÉBEC 2009 © Melanie K. Sackett, 2009 Résumé La cyclooxygénase-2 (COX-2) a été associée à un mauvais pronostic dans plusieurs cancers. L'objectif de cette étude est d'évaluer si la COX-2 est un facteur pronostique dans le cancer glottique. Cette étude a été effectuée sur des tissus de patients ayant participé à un essai clinique qui évaluait l'efficacité de l'alpha-tocophérol pour réduire la survenue de . seconds cancers primaires (SCP) chez des patients avec un cancer de la tête et du cou. Des analyses immunohistochimiques ont été effectuées sur les biopsies pré-traitement de 301 patients avec un cancer glottique de stade précoce traité par radiothérapie. Les rapports d'incidence (RI) et leurs intervalles de confiance à 95% (le) associés à une surexpression de COX-2 sont de 0,94 (le: 0,55-1,62) pour la récidive et de 1,57 (le: 1,01-2,45) pour la mortalité globale. Pour les SCP, les RI sont de 2,63 (IC : 1,32-5,23) pour les premières 3,5 années de suivi et de 0,55 (IC : 0,22-1,32) pour les 3,5 années subséquentes. En conclusion, la surexpresssion de laCOX-2 dans le cancer du larynx glottique est associée à une augmentation de .la mortalité globale et confère une augmentation du risque de SCP durant les 3,5 premières années de suivi. Des études subséquentes sont nécessaires pour expliquer les effets observés au niveau des SCP. L'expression de la COX-2 pourrait s'avérer utile pour prédire le pronostic d'un patient sur une base individuelle. 11 Abstract Cyclooxygenase-2 (COX-2) overexpression has been associated with a poor prognosis in many cancers. The objective ofthis study was to evaluate whether COX-2 is a prognostic factor in glottic cancer. This study was performed on biopsy material from patients who participated in a randomized trial evaluating the efficacy of alpha-tocopherol in reducing second primary cancers (SPC) in head and neck cancer patients. lmmunohistochemical analyses were conducted on pre-treatment biopsies of 301 patients with early stage glottic cancer treated by radiotherapy. The hazard ratios (HR) and their 95% confidence intervals (CI) associated with COX-2 overexpression were 0.94 (CI: 0.55-1.62) for recurrence and 1.57 (CI: 1.01-2.45) for overall mortality. For SPC, the HR were 2.63 (CI: 1.32-5.23) for the first 3.5 years of follow-up and 0.55 (CI: 0.22-1.32) for the following 3.5 years. In conclusion, COX-2 overexpression in glottic cancer was associated with increased overall mortality and conferred an increased risk of SPC during the frrst 3.5 years of follow-up. Future studies are needed to explain observed effects on SPC. COX-2 expression may prove helpful in defining an individual patient' s prognosis. Avant-Propos Ce mémoire comporte un article inséré ayant pour titre «Prognostic Significance of Cyclooxygenase-2 Overexpression in Glottic Cancer» qui a fait l'objet d'une publication scientifique dans la revue Clinical Cancer Research en janvier 2008 (Clin Cancer Res 2008;14(1), p.67-73). Liste des auteurs de l'article: Melanie K. Sackett 1, Isabelle Bairati2 , François Meyer2 , Édith Jobin2 , Sébastien Lussier 1, André Fortin3 , Michel Gélinas\ Abdenour Nabid 5 , François Brochet6 et Bernard Têtu l Affiliations des auteurs de l'article : Département d' anatomo-pathologie 1, Centre de recherche en cancérologie2 et Département de radio-oncologie3 de L'Hôtel-Dieu de Québec - Centre Hospitalier Universitaire de Québec et Université Laval. Départements de radio-oncologie de l'Hôpital Notre-Dame - Centre Hospitalier Universitaire de Montréal4, Hôpital Fleurimont - Centre Hospitalier Universitaire de Sherbrooke 5 et Complexe Hospitalier de la Sagamie6 . Contribution des auteurs de l'article : L'auteur principal est la Dre Melanie K. Sackett qui a élaboré le protocole pour le projet de recherche en collaboration avec les Drs Bernard Têtu et Isabelle Bairati, effectué des analyses immunohistochimiques avec la collaboration d'un technicien de laboratoire, M. Gilles Hamel, fait la lecture des lames d'immunohistochimie, évalué le grade histologique des tumeurs, présenté le projet en congrès à plusieurs reprises et fait la rédaction de l'article. Les analyses statistiques ont été effectuées par la Dre Isabelle Bairati avec la collaboration de Mme Édith Jobin et du Dr François Meyer. La Dre Isabelle Bairati a agi en tant que codirectrice de recherche de l'étude immunohistochimique portant sur la signification pronostique de l'expression de la cyclooxygénase-2 dans le cancer du larynx glottique, le IV sujet de ce mémoire. Elle a également participé à la rédaction de l'article en tant que correctrice et a dirigé l'essai clinique auquel cette étude est rattachée : Bairati 1, Meyer F, Gelinas M, et al.: A randomized trial of antioxidant vitamiris to prevent second primary cancers in head and neck cancer patients. J Natl Cancer Inst 97:481-488, 2005. Les Drs André Fortin, Michel Gélinas, Abdenour Nabid et François Brochet sont des radiooncologues qui ont participé au recrutement et au suivi des patients de cet essai clinique. Le Dr Bernard Têtu est le directeur de recherche de l'étude immunohistochimique portant sur la signification pronostique de l'expression de la cyclooxygénase-2 dans le cancer du larynx glottique. Il a supervisé le projet de sa conception jusqu'à la rédaction de l' article et du mémoire. De plus, il a effectué la lecture d'une partie des lames immunohistochimiques afin d'évaluer la concordance inter-observateur. Le contenu de ce mémoire a été présenté en partie dans des congrès : Sackett MK, Bairati 1, Meyer F, et al. : Prognostic Significance of Cyclooxygenase-2 Overexpression in Glottic Cancer. Am J Clin Pathol 126:625, 2006. Présentation orale au congrès annuel de l'American Society for Clinical Pathology, à Las Vegas, NV, 18-22 octobre 2006. Sackett MK, Bairati 1, Jobin E,. et al. : Cyclooxygenase-2 and Ki-67 Overexpression in Larynx Cancer are Associated with an Increased Risk of Death. Mod Pathol 19: Il 0-111, 2006, (suppl 3; abstr 509). Présentation par affiche au XXVI Congress of the International Academy ofPathology, Montreal, QC, 16-21 septembre 2006. Sackett Melanie K., Bairati Isabelle, Meyer François, et al. : Signification pronostique de la cyclooxygénase-2 dans le cancer du larynx. Présentation orale à la Journée scientifique du département de chirurgie de l'Université Laval, Québec, QC, 12 juin 2006. Sackett Melanie K., Bairati Isabelle, Meyer François, et al. : La surexpression de la cyclooxygénase-2 et de Ki-67 est associée à une augmentation de la mortalité dans le cancer du larynx. Présentation orale à la 8e Journée annuelle de la recherche de la Faculté de médecine de l'Université Laval, Québec, QC, 31 mai 2006. v M. K. Sackett, 1. Bairati, F. Meyer, et al. : La surexpression de la cyclooxygénase-2 et de Ki -67 est associée à une augmentation de la mortalité dans le cancer du larynx. Présentation oral à Les Journées Pierre-Masson, Congrès 2006 de l'Association des pathologistes du Québec, Vaudreuil, QC, 29 avril 2006. M.K. Sackett, 1. Bairati, E. Jobin, et al. : Signification pronostique de l' expression de la COX-2 dans le cancer du larynx. Annales de pathologie, février 2006, vol. 26, no 1, p.71. Présentation orale à la 43e Journée scientifique annuelle Carlton-Auger, Beauport, QC, 29 octobre 2005. M.K. Sackett, l. Bairati,· E. J obin, et al. : Prognostic significance of cyclooxygenase-2 expression in early stage squamous cell carcinoma of the glottic larynx treated by radiotherapy. Présentation par affiche au congrès annuel de l' American Society for Clinical Pathology, Seattle, WA, 9 octobre 2005. M.K. Sackett, 1. Bairati, E. Jobin et al. : Signification pronostique de l'expression de la cyclooxygénase-2 dans le cancer du larynx glottique de stade précoce traité par radiothérapie. Présentation orale à la Journée scientifique du Centre de recherche de l'Hôtel-Dieu de Québec, Québec, QC, 25 août 2005. M.K. Sackett, 1. Bairati et B. Têtu: Expression de la cyclooxygéna~e-2 et radiorésistance dans le cancer du larynx glottique : avant-projet. Annales de pathologie, 2005, vol. 25, no 2, p. 180-181. Présentation orale à la 42e Journée scientifique annuelle Carlton-Auger, Beauport, QC, 30 octobre 2004. Ce mémoire est dédié à mes parents, Ginette et Gerry Sackett, mon conjoint Alexandre Lavigne, mon directeur de recherche le Dr Bernard Têtu, ma co-directrice de recherche le Dr Isabelle Bairati, le Dr Claude Lavigne, le Dr Nicolas Robert, mes amis et collègues de travail, ainsi que tous ceux qui ont collaboré à ce projet. Mes remerciements les plus sincères pour m'avoir inspirée, soutenue et encouragée au cours de cette démarche. J'aimerais souligner plus particulièrement la contribution du Dr Têtu, pathologiste et chercheur à L 'Hôtel-Dieu de Qu~bec-Centre hospitalier universitaire de Québec, qui fut un mentor exceptionnel. Il m'a aiguillée vers une carrière stimulante dans le domaine de la pathologie et de la recherche en cancérologie. Table des matières . Résumé .................................................................................................................................... ~.i Abstract .................................................................................................................................. ii Avant-Propos ........................................................................................................................ iii Table des matières ............................................................................................................... vii Liste des tableaux ................................................................................................................... ix Liste des figures ...................................................................................................................... x Liste des abréviations ............................................................................................................. xi Introduction ............................................................................................................................. 1 LeË:~:!~~~:::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::~ Sites anatomiques ........................................................................................................... 1 Étiologie et facteurs de risque du cancer du larynx glottique ......................................... 3 Facteurs de risque majeurs .......................................................................................... 3 Facteurs de risque mineurs ................ ~ ......................................................................... 3 Présentation et diagnostic .... ~ .......................................................................................... 3 Aspect macroscopique et endoscopique ..................................................................... 4 Aspect microscopique et grade histologique .............................................................. 4 Stade TNM ...................................................................................................................... 7 Traitement ....................................................................................................................... 9 Facteurs pronostiques du cancer du larynx ..................................................................... 9 Pronostic ....................................................................................................................... 12 Récidive .................................................................................................................... 12 Survie ......................................................................................................................... 13 Survenue d'un second cancer primaire ..................................................................... 13 Facteurs de risque de SCP et concept de la « cancérisation de champ ».............. 14 La cyclooxygénase-2 ........................................................................................................ 15 La cyclooxygénase-2 et le métabolisme des prostaglanqines ....................................... 15 Le rôle de la COX-2 et des prostaglandines dans la carcinogénèse ............................. 15 La surexpression de la COX-2 dans le cancer .............................................................. 17 Surexpression de la COX-2 dans le cancer épidermoïde de la sphère ORL, incluant le larynx glottique ..................................................................................................... 17 Signification pronostique de l'expression immunohistochimique de la COX-2 .. 18 Inhibiteurs de la COX-2 et cancer ................................................................................ 20 Inhibiteurs de la COX-2 dans les études in vitro et animales ................................... 20 Inhibiteurs de la COX-2 dans les études chez l'humain ........................................... 21 Inhibiteurs de la COX-2 dans le cancer épidennoïde de la sphère ORL, incluant le larynx ........................................................................................................................ 21 COX-2 et réponse à la radiothérapie ................................................................................. 22 Hypothèse et objectifs ........................................................................................................... 24 La pertinence d'effectuer une nouvelle étude sur la signification pronostique de la COX2 ......................................................................................................................................... 24 Hypothèses ........................................................................................................................ 25 Objectifs de l'étude ....................................................................................... ~ ................... 25 Objectifs principaux ...................................................................................................... 25 VUl obj ectif secondaires ...................................................................................................... 26 Matériel et méthodes ............................................................................................................. 27 Devis de l'étude ................................................................................................................ 27 Population cible ................................................................................................................ 27 Sélection des patients .............................................. ~ ......................................................... 27 Critères d'inclusion .................................................. ~ .................................................... 27 Critères d'exclusion ...................................................................................................... 28 Recrutement des patients .................................................................................................. 29 Collecte des données cliniques ......................................................................................... 29 Confirmation du diagnostic et évaluation du grade histologique ..................................... 30 Sélection des anticorps ...................................................................................................... 30 Technique immunohistochimique ..................................................................................... 30 Évaluation du marquage immunohistochimique .............................................................. 31 Suivi des patients .............................................................................................................. 31 Évaluation des issues cliniques ......................................................................................... 32 Méthodes statistiques ......................................................................................................... 34 Confidentialité et considérations éthiques ........................................................................ 35 Article: La signification pronostique de la surexpression de la cyclooxygénase-2 dans le cancer du larynx glottique ..................................................................................................... 36 Résumé .............................................................................................................................. 36 Prognostic Significance of Cyclooxygenase-2 Overexpression in Glottic Cancer ............... 37 .Abstract ............................................................................................................................. 37 Introduction ........................................... :............................................................................ 38 Materials and Methods ...................................................................................................... 40 Patient Selection and Study Design .............................................................................. 40 Diagnostic Confirmation and Histological Grade Assessment. .................................... 40 Immunohistochemical Analyses ................................................................................... 41 Data Collection and Patient Follow-up ......................................................................... 41 Clinical Outcomes ......................................................................................................... 42 Statistical Analyses ................................................................ ·........................................ 42 Results ............................................................................................................................... 44 Patient and Tumour Characteristics .............................................................................. 44 Association between COX-2 and Prognostic Factors ................................................... 44 COX-2 Overexpression and Outcomes .......................................................·.................. 44 Discussion ......................................................................................................................... 46 Conclusion ........................................................................................................................ 49 Tables and figures from the article ............................................................................... 50 Résultats ................................................................................................................................ 54 Caractéristiques des patients et tumeurs ..................... ~ ..................................................... 54 Surexpression de la COX-2 et issues cliniques ................................................................ 55 Discussion ............................................................................................................................. 62 Comparaison des résultats de avec les études antérieures ................................................. 63 Forces de l'étude ............................................................................................................... 65 Faiblesse de l'étude ........................................................................................................... 65 Perspectives d'avenir ........................................................................................................ 66 Conclusion ................................. ~ ........................................................................................... 67 Bibliographie ........................................................................................................................ 68 ---- Liste des tableaux Tableau 1. Stade « T » pour le cancer du larynx glottique ..................................................... 7 Tableau 2. Stade « N » pour le cancer du larynx glottique ..................................................... 8 Tableau 3. Stade « M » pour le cancer du larynx glottique .................................................... 8 Tableau 4. Stade TNM pour le cancer du larynx glottique ..................................................... 9 Tableau 5. Taux de récidive à 5 ans pour le cancer du larynx glottique selon le stade ........ 12 Tableau 6. Taux de survie pour le cancer du larynx glottique en fonctio~ du stade ............ 13 Tableau 7. Survenue d'un SCP ............................................................................................. 14 Tableaux de l'article ............................................................................................................. 50 Table 1. Association between COX-2 expression and standard prognostic factors in patients with glottic cancer ................................................................................... 50 Table 2. Crude HRs ofrecurrence, SPC, and mortality associated with COX-2 expression ............................................................................................................. 50 Table 3. Adjusted HRs of overall mortality associated with COX-2 expression and other prognostic factors ........................................................................................ 51 Table 4. Adjusted HRs ofSPC Second Primary Cancer associated with COX-2 expression and other prognostic factors according to two periods ....................... 51 Tableau 8. Comparaison des résultats de la littérature pour la signification pronostique de la surexpression de la COX-2 ........................................................................................... 63 1 Liste des figures Figure 1. Sites anatomiques du larynx ............................................................. 2 Figure 2. Aspect macroscopique des carcinomes épidermoïdes du larynx glottique de stade précoce .......................................... ~ ......................................... 4 Figure 3. Muqueuse laryngée normale ............................................................. 5 Figure 4. Critères de malignité à l'examen histologique ........................................ 5 Figure 5. Évaluation du grade histologique ...................................................... 6 Figure 6. Le rôle de la COX-2 dans la biosynthèse des PG ainsi que la promotion, la croissance et l'envahissement de la tumeur, et le développement de métastases .... 16 Figures de l'article Figure 1. Immunostaining for COX-2 ..................................................... 52 Figure 2. Survival according to COX-2 expression ........................ . ............. 53 Figure 7. Fréquence des issues cliniques .......................................................... 55 Figure 8. Causes de décès spécifiques ...................................... ~ ..................... 56 Figure 9. Rapports d'incidence bruts pour la récidive associée à une surexpression de la COX-2 .......................................................................................... 57 Figure 10. Rapports d'incidence bruts pour les décès (selon leur cause) associés à une surexpression de la COX-2 ................................................................... 58 Figure Il. Rapports d'incidences ajustés pour la mortalité associée à une surexpression de la COX-2 et aux autres facteurs pronostiques ......................................... 59 Figure 12. Rapports d'incidence bruts pour la survenue de SCP associé à une surexpression de la COX-2 .................................................................. 60 Figure 13. Rapports d'incidence ajustés pour la survenue de SCP associé à une surexpression de la COX-2 et aux autres facteurs pronostiques ........................ 60 Liste des abréviations AINS anti-inflammatoires non-stéroïdiens APVP années potentielles de vie perdues CI confidence interval COX cyclooxygénase COX-2 cyclooxygénase-2 DS déviation standard HR hazard ratio HRs hazard ratios IC intervalle de confiance ICOX-2 inhibiteur de la cyclooxygénase-2 ISCOX-2 inhibiteur sélectif de la cyclooxygénase-2 KPS statut de performance de Kamofsky N number of patients ORL otorhinolaryngologique P valeur p P p-value PTGSl prostaglandin-endoperoxide synthase 1 PTGS2 prostaglandin-endoperoxide synthase 2 RC rapport de cotes RI rapport d'incidence SCP second cancer primaire SD standard deviation SPC second primary cancer TNM tumour-node-metastasis VEGF vascular endothelial growth factor (facteur de croissance endotheliale vasculaire) Introduction Le cancer du larynx Épidémiologie La Société canadienne du cancer estime à 166 400 le nombre de nouveaux cas de cancer et à 73 800 le nombre de décès par cancer au Canada pour l'année 2008. On prévoit qu'un homme sur 2,2 (44,5%) et qu'une femme sur-2,5 (39,3%) seront atteints d'un cancer au cours de leur vie (http://www.cancer.ca). Le cancer se classe au premier rang (32% du total) en tant que cause d'années potentielles de vie perdues (APVP) parmi les causes de décès prématuré chez l 'horrime et chez la femme, les maladies cardiaques se retrouvant au second rang (http://www.fgc.gc.ca/pdf/statscan/statscan2007 .pd!). Au Canada en 2008, le nombre estimé de nouveaux cas de cancer du larynx est de 1 200 (1000 hommes et 220 femmes) et le nombre de décès en découlant est de 530 (440 hommes et 90 femmes). Cela représente 1,2% de l'ensemble des nouveaux cas de cancers et 1,1 % des décès par cancer chez l'homme, ainsi que 0,3% des nouveaux cas de cancer et des décès par cancer chez la femme (http://www.cancer.ca). Le cancer du larynx était responsable de 7 100 APVP au Canada en 2003, soit 0,7% des APVP attribuables au cancer (http://www.fgc.qc.ca/pdf/statscan/statscan2007.pd!). Le taux d'incidence annuel du cancer du larynx en Amérique du Nord est d'environ 5,8/100 000 de population chez l'homme et 1/100 000 chez la femme (1). La grande majorité, soit 95%, des cancers du larynx sont de type histologique épidermoïde, le reste étant des carcinomes neuroendocriniens, des carcinomes adénoïdes kystiques, des carcinomes mucoépidermoïdes, des sarcomes, des lymphomes et très rarement d'autres types (1). Le cancer épidermoïde du larynx affecte avec prédilection les individus de sexe masculin (85%) entre 60 et 80 ans (1;2). Sites anatomiques Le larynx peut être subdivisé anatomiquement en trois sites: le larynx glottique, susglottique et sous-glottique. Le larynx glottique est l'endroit où se situent les cordes vocales, 1 2 incluant les commissures antérieures et postérieures. TI est le siège de 67% des cancers du larynx. La limite supérieure du larynx glottique se situe au niveau d'un plan horizontal qui passe par les rebords latéraux du ventricule et la limite inférieure passe par un plan horizontal 1 cm en-dessous des vraies cordes vocales. Trente et un pourcent des cancers se retrouvent au niveau du larynx sus-glottique, qui comprend l'épiglotte, les replis aryépiglottiques, les fausses cordes vocales, les ventricules et les saccules. Seulement 2% des c-ancers se retrouvent au niveau du larynx sous-glottique qui s'étend de la limite inférieure du larynx glottique jusqu'à la portion inférieure du cartilage cricoïde (1 ;3;4). base data langue épiglotte, _ _ _ _ _~ Étage eU$-glottlqUè31 0/0 ventr.icule . ~ .~ ...-.-t»ti'+-,~ > f ; _............. -'" . ,. ,~ '" . -'-Stajj"ègioitlquê 67°Îo'~ ~ ~ · G . · ~~~~~~~·~···_~··~···~--~ _ ·_ -~- ~~ ' f~' ". . <~ corde vocale ~~ ~: É'tage souslii9.lott1que20/0 .~ ~~rti" '* '1fde --.~ T""'. .I"age cnco \ '-'--~..- --~-- ~ ~~~~M ....... ___ ~ _______ ~w~ . ~ · trachée PROFIL FACE Figure 1. Sites anatomiques du larynx. Le site anatomique du cancer du larynx est un facteur important car les différents sites ont une origine embryologique différente, avec Un drainage lymphatique et une compartimentation différents, ayant un impact sur l'extension du cancer. Le larynx susglottique a un riche drainage lymphatique bilatéral et les tumeurs qui s'y développent ont un pronostic plus sombre avec un plus haut taux de métastases ganglionnaires. De plus, les cancers glottiques, de par leur localisation stratégique au niveau des cordes vocales, donnent des symptômes plus tôt malgré leur petite taille, permettant donc un diagnostic à 3 un stade plus précoce. Ils tendent aussi à demeurer localisés pour de plus longues périodes (1). Étiologie et facteurs de risque du cancer du larynx glottique Facteurs de risque majeurs Le tabac et l'alcool sont les principaux facteurs de risque du cancer épidermoïde du larynx glottique. Le tabagisme a été trouvé associé à un risque relatif de développer un cancer du larynx de l'ordre de 10 fois celui des non-fumeurs. Le début de consommation du tabac à un jeune âge, une longue durée de consommation, une grande quantité consommée par jour et l'inhalation profonde de la fumée sont tous des facteurs qui accroissent le risque lié au tabagisme. L'abus d'alcool est associé à un risque relatif de développer un cancer du larynx de l'ordre de 2,5. L'effet combiné de la consommation d'alcool et de tabac est multiplicatif, plutôt qu'additif (1 ;2) Facteurs de risque mineurs Les facteurs nutritionnels, l'exposition occupationnelle (incluant les hydrocarbones aromatiques polycycliques, la poussière de ciment et de métal), l'irradiation, le virus du papillome humain (VPH16), le reflux gastro-œsophagien, les facteurs génétiques, dont le syndrome de Bloom et des polymorphismes pour des enzymes impliquées dans le métabolisme de l'alcool, ont également été associés au cancer du larynx, mais ce sont des facteurs de risque mineurs(l ;2). Présentation et diagnostic Le mode de présentation habituel du cancer du larynx glottique est une dysphonie précoce. Le diagnostic se fait habituellement par laryngoscopie qui permet de visualiser la lésion, d'évaluer son extension et la mobilité des cordes vocales, ainsi que d'évaluer la présence de seconds cancers primaires (voir ci-bas). Les études d'imagerie peuvent êtres utiles pour déterminer l'extension de la lésion et l'absence ou la présence d'une atteinte ganglionnaire ou de métastases à distance. La biopsie de la lésion permet d'en confIrmer la malignité, d'en évaluer le type histologique et le grade histo~ogique (1 ;2). 4 Aspect macroscopique et endoscopique Le cancer épidermoïde du larynx glottique peut se présenter comme une lésion ferme polyploïde, verruqueuse, exophytique ou comme une plaque bien délimitée avec rebords ourlés. La muqueuse peut être épaissie, blanche ou érythémateuse, parfois ulcérée. Les lésions glottiques sont majoritairement de petite taille lors du diagnostic initial (1 ;2). Figure 2. Aspect macroscopique des carcinomes épidermoïdes du larynx glottique de stade précoce. Aspect microscopique et grade histologique Afin de confirmer la malignité d'une lésion du larynx, certains critères doivent être respectés. Par rapport aux lésions bénignes, les lésions malignes ont souvent un pléomorphisme nucléaire accru, un rapport nucléo-cytoplasmique augmenté, un index mitotique plus élevé, incluant des figures de mitoses atypiques. Les lésions infiltrantes doivent démontrer une transgression de la membrane basale et un envahissement de la sous-muqueuse, généralement accompagné d'une réaction desmoplasique. 5 Figure 3. Muqueuse laryngée normale. On note un épithélium pavimenteux pluristratifié sans évidence de dysplasie ou malignité. Figure 4. Critères de I1).alignité à l'examen histologique. Les lésions montrent des cellules épithéliales atypiques avec un rapport nucléocytoplasique augmenté, des noyaux de taille augmentée et un pléomorphisme nucléaire. L'image en A montre des figures de mitose et l'image en B montre des nucléoles proéminents. 6 Le grade histologique des tumeurs est déterminé selon le degré de kératinisation, incluant la présence de perles de kératine et de kératinisation de cellules individuelles, la présence .de ponts intercellulaires, le pléomorphisme et les mitoses. Les lésions sont catégorisées en grade 1 (bien différenciée), grade 2 (modérément différenciée) et grade 3 (pauvrement différenciée). Les lésions de grade 1 ressemblent à de l'épithélium pavimenteux normal et kératinisent abondamment. Les lésions de grade 2 ont plus de pléomorphisrrte nucléaire, plus de mitoses et moins de kératinisation. Les lésions de grade 3 sont formées de cellules immatures, avec des figures de mitoses abondantes et très peu de kératinisation(l ;2). Figure 5. Évaluation du grade histologique. A. Perle de kératine. B. Ponts intercellulaires (desmosomes) proéminents. La lésion en C est bien différenciée alors que la lésion en D est pauvrement différenciée. 7 StadeTNM Le stade TNM est un système qui pennet d'évaluer l'extension d'une tumeur. Cette classification aide à stratifier les tumeurs en fonction de leur pronostic et guide le choix thérapeutique. La lettre « T » signifie «tumeur» et désigne l'extension de la tumeur au niveau de son site d'origine. La lettre «N » est employée pour le terme anglais « node », qui se traduit par « ganglion lymphatique », et qui représente l'atteinte par la tumeur des ganglions lymphatiques dans la région de drainage de la tumeur. La lettr~ «M» est employée pour le terme «métastases» et représente l'atteinte par la tumeur de sites à distance du site original de la tumeur, autres que les ganglions lymphatiques régionaux. Tableau 1 Stade« T »pour e cancer du larynx glottique Tla Tumeur limitée à une corde vocale avec mobilité normale Tl b Tumeur atteignant les deux cordes vocales avec mobilité normale T2 Tumeur s'étendant au niveau sus-glottique et/ou sous-glottique, et/ou avec atteinte de la mo bilhé des cordes vocales T3 Tumeur limitée au larynx avec fixation des cordes vocales et/ou envahissement de l'espace para glottique, et/ou érosion du cartilage thyroïdien mineur T4a Tumeur envahissant à travers le cartilage thyroïde et/ou envahissant les tissus au delà du larynx (ex: trachée, tissus mous du cou, incluant les muscles extrinsèques profonds de la langue, les muscles strapédiens, la glande thyroïde ou 1' œsophage) T4b Tumeur envahissant l'espace pré-vertébral, emprisonnant l'artère carotide ou envahissant les structures médiastinales Traduit de : American Joint Committee on Cancer (AJCC) Cancer Staging Manual, Seventh Edition (2007), published by Springer-Verlag New York, Inc. 8 Tableau 2 Stade« N » pour e cancer du larynx glottique NX Les ganglions régionaux ne peuvent êtres évalués NO Absence de métastases ganglionnaires lymphatiques NI Métastases dans un seul ganglion lymphatique ipsil atéral à la tumeur, d'une dimension maximale de 3 cm ou moins N2a Métastases dans un seul ganglion lymphatique ipsilatéral à la tumeur, d'une dimension maximale de plus de 3 cm mais moins de 6 cm N2b Métastases dans plusieurs ganglions lymphatiques ipsilatéraux à la tumeur, d' une dimension maximale de 6 cm ou moins N2c Métastases ganglionnaires bilatérales ou dans les ganglions lymphatiques controlatéraux, d'une dimension maximale de 6 cm ou moins N3 Métastase dans un ganglion lymphatique d'une dimension maximale de plus de 6 cm Traduit de : American Joint Committee on Cancer (AJCC) Cancer Staging Manual, Seventh Edition (2007), published by Springer-V erlag New York, Inc. Tableau 3. Stade « M » pour le cancer du larynx glottique MX L'état des métastases à distance ne peut être évalué MO Absence de métastases à distance Ml Présence de métastases à distance Traduit de : American Joint Committee on Cancer (AJCC) Cancer Staging Manual, Seventh Edition (2007), published by Springer-Verlag New York, Inc. 9 Tableau. 4 Stade TNM pour e cancer du larynx glottique MO Stade 1 Tl NO Stade II T2 NO MO Stade III Tl, T2 NI MO T3 NO, NI MO Stade IV T4 ToutN MO TautT N2,N3 MO ToutT ToutN Ml Traduit de : American Joint Committee on Cancer (AJCC) Cancer Staging Manual, Seventh Edition (2007), published by Springer-Verlag New York, Inc. L~ présente étude était restreinte au cancer du larynx glottique de stade précoce, soit de stade 1 et II, donc tous les patients avaient des tumeurs de stade Tl a, Tl b ou·T2 et aucun ne présentait d'atteinte des ganglions lymphatiques régionaux ou de métastases à distance. Traitement Le traitement du cancer du larynx glottique de stade précoce se fait habituellement par radiothérapie, chirurgie ou excision au laser. Ces modalités de traitement ont des efficacités comparables et permettent souvent au patient de préserver sa voix. La chimiothérapie est utilisée lors des stades plus avancé ou lors des récidives (1 ;2). Facteurs pronostiques du cancer du larynx Les principaux facteurs pronostiques du cancer du larynx traité par radiothérapie comprennent les facteur liés aux caractéristiques des patients~ les facteurs liés à la tumeur et les facteurs liés à l'environnement ou aux modalités de traitement (1;3;5-9). Les facteurs liés aux caractéristiques des patients incluent: ·10 • l'âge, les patients plus jeunes ayant un meilleur pronostic • le sexe, les femmes ayant un meilleur pronostic • la consommation d'alcool et de tabac, une consommation élevée étant associée à un pronostic plus sombre • la présence de comorbidités et le statut de performance de Karnofsky (KPS), les patients ayant un meilleur état de santé ont une.issue plus favorable Les facteurs liés à la tumeur incluent: • le stade TNM, incluant l'extension locale de la tumeur, la présence de métastases ganglionnaires lymphatiques et à distance; il s'agit du facteur le plus significatif pour prédire la survie, les tumeurs précoces (1 et II) ayant un meilleur pronostic que les tumeurs de stade avancé (III et IV) • le site anatomique de la tumeur, le larynx glottique ayant un meilleur pronostic • le grade histologique de la tumeur, les tumeurs pauvrement différenciées ayant un pronostic plus sombre • la taille et le volume de la tumeur, les tumeurs de petite taille ayant un meilleur pronostic et l'atteinte de la commissure antérieure est associée à un pire pronostic • l'aspect macroscopique de la tumeur, les lésions exophytiques ayant un meilleur pronostic • les marqueurs cellulaires et moléculaires potentiels: Ki-67 (index de prolifération), P53, Bcl-2 et autres marqueurs apoptotiques, VEGF, microdensité vasculaire, EGFR, TGF-alpha, ploïdie de l'ADN; mais leur impact sur le pronostic est controversé Les facteurs liés à l'environnement et au traitement incluent: • les paramètres de la radiothérapie Il o la durée totale du traitement et le fractionnement de la dose o la dose totale o l'énergie du faisceau o la taille du champ o l'année ou la période au cours de laquelle la radiothérapie a été donnée (les études s'échelonnant sur de très longues périodes peuvent induire un biais potentiel car le traitement standard des patients peut varier selon l'époque ou survient le diagnostic). • l'hémoglobine pré-radiothérapie • la diminution de l'hémoglobine de > 10g/L durant le traitement est associée a un pronostic plus sombre • l'amélioration de la dysphonie sous traitement 12 Pronostic Récidive Le taux de récidive locale, régionale ou à distance augmente en fonction du stade. Les récidives à distance sont rares; les sites les plus fréquents sont le poumon, les os et le foie (1). Les conséquences d'une récidive locale sont lourdes car leur traitement, la laryngectomie, lorsque effectuée dans un terrain préalablement irradié, a un taux d'échec et de complication plus élevé (10). Tableau 5. Taux de récidive à 5 ans pour le cancer du larynx glottique selon le stade Récidive Récidive Recidive loco- Récidive locale régionale . regionale distance Stade 1 5,5-10% 1,9% 10-22% 2% Stade II 18-30% 16,7% 27-41% 2% Stade 1 et II 11-19% - - 0-2% Données extraites de : (3;9;11;12). à 13 Survie Tableau 6. Taux de survie pour le cancer du larynx glottique en fonction du stade Survie globale Survie globale Survie Survie spécifique à à 5 ans 10 ans spécifique à 5 10 ans ans Stade l 72-85% 66-74.9% 98% 91% Stade II 59-77% 55-56% 92,5% 69% Stade l et II 79-83% 63,5-75% - 86% Données extraites de : (5;7;9; 13-15) Chez les patients avec un cancer du larynx glottique de stade précoce, la survie spécifique (i.e. la survie reliée au premier cancer du larynx) est élevée, mais la survie globale est plus basse. Les décès indépendants du premier cancer primaire sont généralement attribuables à · la survenue d'un second cancer primaire ou aux comorbidités des patients (1). Survenue d'un second cancer primaire Un second cancer primaire est défini comme une nouvelle tumeur maligne qui survient de façon synchrone ou métachrone chez un patient ayant un premier cancer. La nouvelle tumeur doit être séparée du premier cancer ou de type histologique différent pour être considérée comme une nouvelle tumeur plutôt qu'une extension ou récidive du premier cancer (16-18). La survenue d'un second cancer primaire est fréquente dans le cancer du larynx glottique de stade l et II, avec un taux d'environ 18% à 5 ans et 27% à 10 ans (9;12). Le taux annuel de survenu de SCP rapporté varie entre 1.5 et 7% (1 ;3). La durée moyenne avant la survenue d'un SCP est d'environ 41-60 mois (5;9). Les sites les plus fréquents sont le poumon (30%) et la sphère ORL (15%) (9). 14 Tableau 7. Survenue d'un SCP SCP à 5 ans SCP à 10 ans Stade 1 et II 18% 27% Données extraites de : (9; 12). Une étude par Franchin et al. rapporte que la survenue de SCP était la cause la plus fréquente de décès, surtout chez les patients qui ne cessent pas de fumer après leur diagnostic initial de cancer du larynx glottique de stade précoce traité par radiothérapie. La survie à 10 ans était seulement 32% chez les patients ayant développé un SCP vs 77% chez les patients sans SCP (7). ' Facteurs de risque de sep et concept de la « cancérisation de champ» Les facteurs de risque de développer un sep sont les mêmes que ceux du cancer du larynx initial. Le tabagisme est associé à une augmentation du risque de développer un sep de plus de 200% et ce risque est dépendent de l'exposition (1). Le concept de « cancérisation de champ», traduit du terme anglais «field cancerization », permet d'expliquer le développement de sep. Il suppose que les substances cancérigènes, telles que celles retrouvées dans le tabac et l'alcool, peuvent altérer l'épithélium de tout le tractus respiratoire et digestif supérieur. Cet épithélium altéré devient donc un terrain fertile pour le développement de multiples cancers primaires (19;20). Les modalités thérapeutiques employées peuvent avoir un impact sur la survenue de sep, la radiothérapie ayant été associée à un taux plus faible de SCP et une plus grande période de latence avant la survenue d'un SCP que le traitement chirurgical (1). 15 La cyclooxygénase-2 La cyclooxygénase-2 et le métabolisme des prostaglandines La cyclooxygénase (COX) est l'enZyme limitante dans la conversion de l'acide arachidonique en prostaglandines (PG). La COX a deux isoformes, COX-1 et COX-2, qui sont encodées par des gènes différents, PTGSl et PTGS2. Leur expression et leur régulation se font donc de façon indépendante. La COX-1 est exprimée constitutivement par certains types cellulaires et produit des PG qui remplissent des fonctions physiologiques normales, dont la production de mucus protecteur par la muqueuse gastro-intestinale et l'agrégation plaquettaire (21). La COX-2 n'est habituellement pas détectée dans la plupart des tissus dans des conditions normales. Son expression peut être induite par certains stimuli dont les cytokines proinflammatoires, les substances carcinogènes dont le tabac, les oncogènes, les facteurs de croissance, l'hypoxie et la radiothérapie (22;23). Il y a une corrélation entre l'expression de la COX-2 et la quantité de PG produites (24). Le rôle de la COX-2 et des prostaglandines dans la carcinogénèse La COX-2 et les PG jouent un rôle dans la promotion tumorale, la croissance tumorale, l'envahissement stromal et la dissémination métastatique. La COX-2 et les PG ont été impliquées dans la promotion de la croissance et de la prolifération cellulaires (25). La surexpression de la COX-2 peut contribuer au développement d'un cancer en diminuant l'apoptose, soit par augmentation de la protéine antiapoptotique BCL-2 ou par une diminution de la protéine proapoptotique BAX (21 ;25). Cela mène à une survie prolongée des cellules, favorisant l'accumulation des mutations génétiques et augmentant ainsi le risque de carcinogenèse. La COX-2 peut aussi catalyser la conversion de pro-carcinogènes en carcinogènes, dont le benzo[a]pyrene retrouvé dans le tabac, et augmenter l'inflammation chronique de l'épithélium via la production de PG, ce qui favorise la carcinogenèse (21). L'angiogenèse est un mécanisme primordial par lequel la COX-2 favorise là croissance tumorale, et ce via la modulation de la production de facteurs angiogéniques, dont le VEGF (26-29). Il a été démontré in vitro et in vivo que la synthèse de COX-2 induit la production de VEGF dans le cancer de la sphère ORL (29;30). La COX-2, via la production de PG, diminue l'efficacité du système immunitaire à combattre 16 la tumeur (21). La COX-2 et les PG accroissent la motilité et l'adhésion des cellules tumorales à la matrice extracellulaire en augmentant l'expression et activant les métalloprotéinases 1 et 2 (qui digèrent la matrice collagénique de la membrane basale), en diminuant l'expression d'E-cadhérine (une molécule d'adhésion intercellulaire qui lie les cellules tumorales entre-elles) et en augmentant l'expression du CD44 (un récepteur de surface pour l 'hyaluronate, une composante de la matrice extracellulaire), ce qui contribue à l'envahissement stromal et la dissémination métastatique (21 ;25). r Phospholipides de la membrane cellulaire Phospholipases '; COX-l + COX-2 Acide arachidonique 1" ~ Prostaglandines ~ ! ! Apoptose t VEGF Angiogenèse /' Réponse immunitaire t Prolifération cellulaire Figure 6. Le rôle de .la COX-2 dans la biosynthèse des PG ainsi que la promotion, la croissance et l'envahissement de la tumeur, et le développement de métastases. 17 La surexpression de la COX-2 dans le cancer Des niveaux élevés de PG et une surexpression du gène COX-2 ou de la protéine COX-2 ont été retrouvés dans plusieurs cancers chez 1'humain, dont le cancer du côlon (22;31-34), du poumon (33;35;36), du sein (33;37), du col de l'utérus (38;39), du foie (40;41), de la prostate (42), de l'œsophage (43), du pancréas (44) et de l'estomac (45;46). La surexpression de la COX-2 a été associée à un comportement tumoral plus agressif ou à un pronostic plus sombre ainsi qu'à une dissémination métastatique (32;35;36;45;47;48). Une corrélation entre la surexpression de la COX-2 et un pronostic plus sombre a été démontrée chez des patients traités par radiothérapie avec ou sans chimiothérapie dans le cancer du sein (21), du col de l'utérus (38;39;49), du poumon (47) ainsi que dans les cancers de la sphère ORL. Surexpression de la COX-2 dans le cancer épidermoïde de la sphère ORL, incluant le larynx glottique Plusieurs études ont démontré une surexpression de COX-2 dans le cancer de la sphère ORL. Chan et al. ont démontré qu'il y avait 150 fois plus d'ARN messager pour la COX-2 dans les cancers épidermoïdes de la sphère ORL que dans la muqueuse orale normale (50). Peng et al. ont détecté l'ARN messager de la COX-2 dans 87% de leurs 23 tumeurs de l'hypopharynx alors qu'elle n'était pas ou très faiblement détectée dans la muqueuse orale de sujets sains (51). Mestre et al. ont noté qu'il y avait 100 fois plus d'ARN messager pour la COX-2 dans les cancers épid~rmoïdes de la sphère ORL que dans la muqueuse orale normale et ont décelé la présence de la protéine COX-2 dans 100% de leurs 6 cas de cancers alors qu'elle était non décelable dans la muqueuse orale normale (52). Renkonen et al. ont également rapporté des niveaux plus élevés de la protéine COX-2 dans le cancer de la langue (53). Jaeckel et al. ont observé une augmentation de l'ARN messager pour COX-2 et de la protéine COX-2 dans le cancer épidermoïde de la sphère ORL, à la fois dans la tumeur primaire et dans les métastases ganglionnaires lymphatiques (54). Environ 45 à 88% des cancers ORL surexpriment la COX-2 (55-58). 18 Signification pronostique de l'expression immunohistochimique de la COX-2 Plusieurs études ont penms d'associer une surexpression de la protéine COX-2 à un pronostic plus sombre dans le cancer de la sphère ORL. Gallo et al. ont effectué une étude de cohorte chez 52 patients avec un cancer épidermoïde de la sphère ORL de stade 1 à IV traités par chirurgie (dont 22 cancers du larynx). Ils ont trouvé que la surexpression de la COX-2 et une vascularisation tumorale élevée étaient associées à une diminution de la survie totale et de la survie sans maladie (26). Chang et al. ont noté une surexpression de la COX-2 dans 45% des cancers de l'oropharynx. Cette surexpression était associée à une diminution de la survie à 3 ans (RC 0,41, lC à 95% 0,20-0,84, P=0,02) (55). Cette étude de cohorte comportait 82 patients avec des sites tumoraux variés, des stades et des traitements hétérogènes. L'évaluation du marquage était qualitative. Terakado et al. ont démontré, chez 41 patients avec un cancer de la cavité orale de stade 1 à IV, que la réponse à la radiothérapie pré-opératoire était diminuée chez les patients surexprimant la COX-2 (59). Terakado et al. ont également mis en évidence une association entre le niveau d'expression de la COX-2 et la résistance tumorale à la radiothérapie dans huit lignées cellulaires de cancer épidermoïde oral. Pour la lignée cellulaire HSC-2, qui exprime la COX-2 constitutivement, un traitement avec un inhibiteur sélectif de la COX-2 a augmenté la réponse à la radiothérapie. Nix et al. ont effectué une étude cas-témoin comportant 61 paires de patients (radiorésistant-radiosensible) avec cancer du larynx (dont 55 étaient glottiques) de stade 1 et II. Une surexpression de COX-2 était significativement associée à la résistance à la radiothérapie; elle était retrouvée dans 67% des tumeurs ne répondant pas à la radiothérapie comparativement à 41 % des tumeurs radiosensibles (60). ·Cho et al. ont évalué l'expression de la COX-2 dans une cohorte 123 patients avec un cancer du larynx de stade 1 et II traités par radiothérapie. Ils ont démontré à l'analyse multivariée que la surexpression de COX-2 est associée à un risque relatif de récidive locale de 2,57 (IC à 95% de 1,21-5,47; p=O,Ol) (56) . . Par contre, certaines études ont obtenu des résultats contradictoires. Ranelletti et al. ont effectué une étude de cohorte chez 61 patients avec un cancer du larynx de stade 1 à IV traités par chirurgie (laryngectomie partielle ou totale) plus ou moins dissection ganglionnaire lymphatique cervicale et radiothérapie adjuvante. Ils ont noté que la COX-2 19 était surexprimée dans les tumeurs bien différenciées alors qu'elle ne l'était pas dans les tumeurs indifférenciées (61). Les auteurs ont aussi trouvé que de bas "niveaux d'expression de COX-2 combinés à de hauts niveaux d'EGFR étaient associés à une diminution de la survie totale et de la survie sans récidive à 5 ans. Pour expliquer ces résultats, ils ont émis l'hypothèse que l'expression de la COX-2 est perdue dans les cancers moins bien différenciés ou plus agressifs. Bayazit et al. ont effectué une étude dans une cohorte de 39 patients avec un cancer du larynx traité par chirurgie. Ils n'ont pas démontré d'association entre la surexpression de la COX-2 et la récidive locale, la survie ou la présence de métastases pulmonaires (62). Atula et al. n'ont pas trouvé d'association entre la COX-2 et la survie globale ou sans récidive dans leur étude de 65 patients avec un cancer de la cavité orale et du pharynx de stade II à IV, traités par radiothérapie et/ou chirurgie (58). La maj orité des études précédentes comporte plusieurs limitations pouvant entacher leur validité interne : l'hétérogénéité des patients quant au site anatomique des tumeurs laryngées, au stade TNM et aux modalités de traitement (chirurgies variées, radiothérapie et/ou chimiothérapie), la faible taille d'échantillon et le court suivi. De plus, il n'y a pas de méthode standardisée pour évaluer , l'expression immunohistochimique de la COX-2. Différents anticorps ont été employés et la littérature scientifique n'indique pas de valeur seuil pour définir la surexpression de la COX-2. Ces motifs expliquent potentiellement les divergences entre les résultats obtenus par ces différents chercheurs. 20 Inhibiteurs de la COX-2 et cancer Les inhibiteurs de la COX-2 (ICOX-2) sont une famille de médicaments qui comprennent les anti-inflammatoires non stéroïdiens non sélectifs (AINS), qui ciblent à la fois la COX-l et la COX-2, ainsi que les inhibiteurs sélectifs de la COX-2 (ISCOX-2), .qui ciblent préférentiellement la COX-2. Étant donnée le rôle de la COX-2 dans la carcinogenèse, les ICOX-2 constituent une stratégie thérapeutique prometteuse (63-65). L'efficacité des ICOX-2 s'explique par les mécanismes suivants: une diminution des prostaglandines et de l'angiogénèse, une augmentation de l' apoptose, une inhibition de l'activité des télomérases et l'arrêt du cycle cellulaire dans des phases où les cellules tumorales sont davantage sensibles à la radiothérapie (66-74). Inhibiteurs dè la COX-2 dans les études in vitro et animales Chez l'animal et in vitro, les inhibiteurs de la COX-2 ont démontré des effets anti-tumoraux dans plusieurs types de cancers. Chez le modèle animal pour la polypose familiale, des souris traitées avec le célécoxib (un ISCOX-2) ont développé une charge tumorale 85% moindre que les souris non-traitées (75). Le célécoxib a aussi permis d'inhiber in vitro la croissance cellulaire dans le cancer de la vessie dans une étude menée par Gee (76). De plus, les ICOX-2 peuvent augmenter l'efficacité de la radiothérapie. Liu a démontré que le célécoxib pouvait diminuer la croissance tumorale dans le cancer du poumon et du sein in vitro ainsi que chez la souris (77). Cet effet était plus qu'additif lorsque combiné à la radiothérapie. Teicher mis en évidence que l'ajout d'ibuprofen (un AINS) à la radiothérapie pouvait ralentir la croissance tumorale de moitié dans le cancer de la prostate greffé chez la souris (78). Milas et Kishi ont démontré, chez la souris et ce pour deux sortes de sarcomes, que le SC-236 (un ISCOX-2) peut augmenter l'efficacité de la radiothérapie sans augmentation des effets secondaires sur les tissus normaux (79;80). Une étude avec des souris greffées avec une tumeur exprimant la COX-2 (NCI-H460, cancer du poumon) et une tumeur n'exprimant pas la COX-2 (HCT-116, cancer du côlon) a permis de démontrer que le potentiel radio-sensibilisant du NS-398 (un ISCOX-2) est dépendant de l'expression tumorale de COX-2. Ils ont trouvé une augmentation de l'effet de la radiothérapie par un facteur de 2,5 pour la tumeur exprimant la COX-2 (81). 21 Inhibiteurs de la COX-2 dans les études chez l'humain . Chez l'humain, des études épidémiologiques et des essais cliniques ont démontré que les inhibiteurs de la COX-2 réduisaient le risque de développer le cancer du côlon, du sein et du poumon (82). Dans la polypose familiale adénomateuse, 'le célécoxib diminue la fonnation de polypes coliques et leur transfonnation maligne (83). Dans le cancer du col traité par radiothérapie, l'utilisation d' oxyphenbutazone, un inhibiteur de la synthèse des PG, a résulté en une augmentation de la survie (84). Depuis environ 8 ans, des essais cliniques de phase l et II ont été créés pour déterminer l'efficacité de l'utilisation d'ICOX-2 comme traitement adjuvant à la radiothérapie, avec ou sans chimiothérapie, pour le cancer non à petites cellules du poumon, le cancer de l' œsophage, le cancer du pancréas, le cancer du col de l'utérus, le càncer de la prostate, le cancer du côlon, le cancer du sein et le glioblastome multiforme (65;85). Une étude pilote a démontré que le célécoxib pouvait ralentir ou arrêter l'augmentation de l'antigène prostatique spécifique sérique dans le cancer de la prostate récidivant (86). Lin et al. ont montré que le célécoxib pouvait diminuer les effets secondaires associés au traitement et augmenter le délai de temps jusqu'à la progression de la maladie dans le cancer colorectal traité par chimiothérapie (87). Inhibiteurs de la COX-2 dans le cancer épidermoïde de la sphère ORL, incluant le larynx L'effet anti-tumoral de l'inhibition de la COX-2 a été démontré in vitro (88;89). Certains auteurs ont démontré que les ICOX-2 pouvaient diminuer l'incidence et la croissance de cancer chez l'animal ainsi qu'améliorer la survie (74;90-93). Un traitement adjuvant avec un ICOX-2 a permis d'augmenter la réponse tumorale à la radiothérapie dans des lignées cellulaires (59;67) et chez l'animal (94;95). L'efficacité des ICOX-2 dans le cancer de la sphère ORL a également été évaluée chez l'humain. Panje et al. rapportent une série de sept cas de cancer ORL pour lesquels un traitement adjuvant d'indométhacine a contribué à la régression ou la stabilisation tumorale (96). Hirsch a publié une série de 10 cas de cancers épidermoïdes de stade avancé traités avec de l'indométhacine et pour lesquels 2 patients ont eu une régression tumorale marquée (97). 22 COX-2 et réponse à la radiothérapie La radiothérapie peut agir sur l'ADN (directement ou indirectement via la production de radicaux oxygénés) et produire des dommages qui modulent la capacité des cellules à se diviser et à proliférer. Elle induit l'expression de gènes impliqués dans les voies de signalement internes, dont p53, qui vont promouvoir soit la survie cellulaire si les dommages sont réversibles ou l' apoptose si les dommages sont irréversibles (65). Il serait très intéressant de trouver des marqueurs moléculaires permettant de prédire la réponse tumorale à la radiothérapie et des agents thérapeutiques pennettant d'augmenter la sensibilité des cellules à la radiothérapie sans toutefois augmenter les effets toxiques sur les tissus normaux avoisinants (65). Plusieurs cibles moléculaires sont à l'étude dont la COX-2 qui semble très prometteuse (21). Il a été démontré in vitro que les radiations augmentent l'expression de COX-2 et de PG dans les cellules normales et tumorales (98;99). La COX-2 et les PG pourraient contribuer à la diminuer la réponse à la radiothérapie en protégeant les cellules contre les dommages des radiations ionisantes (65). Les PG peuvent inhiber l' apoptose et réparer les dommages à l'ADN produits par la radiothérapie. Les PG peuvent aussi contrecarrer l'effet de la radiothérapie en stimulant l' angiogenèse (79). De plus, elles ont un effet immunosuppresseur qui favorise la croissance tumorale (65). Une corrélation entre la surexpression de la COX-2 et un pronostic plus sombre a été démontrée chez des patients traités par radiothérapie avec ou sans chimiothérapie dans le cancer du sein (21), du col de l'utérus (38;39;49), du poumon (47) ainsi que dans les cancers de la sphère ORL. Chez l'humain, des patientes avec cancer du sein traité par radiothérapie et paclitaxel qui ont eu une réponse complète au traitement avaient un taux d'expression de COX-2 30 fois inférieur à celui retrouvé chez les patientes n'ayant pas répondu au traitement (Formenti et al.) (65). De plus, une étude chez des patientes avec cancer envahissant du col de l'utérus avec surexpression de COX-2 démontre une survie à 5 ans de 35% comparativement à 75% pour les cancers avec aucune ou faible expression de COX-2 (39;49). Une autre étude a démontré que la surexpression de la COX-2 était associée à une diminution de la survie à 5 ans et à une augmentation des récidives locales et régionales dans le cancer du col (38).Une corrélation entre l'expression de la COX-2 et une réduction de la survie globale et sans 23 maladie à également été démontrée dans le cancer non à petites cellules du poumon (47). L'expression de la COX-2 pourrait donc être un facteur prédictif de la réponse à la radiothérapie et de la survie. Les inhibiteurs de la COX-2 ont le potentiel d'améliorer la réponse à la radiothérapie et la survie chez ces patients. Dans le cancer du col traité par radiothérapie, l'utilisation d'oxyphenbutazone, un inhibiteur de la synthèse des PG, a résulté en une augmentation de la survie (84). Des études sont présentement en cours pour déterminer l'effet de la combinaison d'inhibiteurs de la COX-2 avec la radiothérapie pour le cancer non à petites cellules du poumon, le cancer de l'œsophage, le cancer du pancréas, le cancer du col de l'utérus et le glioblastome multiforme (65). De plus, l'inhibition de la COX-2 peut aussi diminuer les effets secondaires associés à la radiothérapie. Un essai clinique effectué par Pillsbury chez 19 patients avec un cancer ORL inopérable, traités par radiothérapie (dont 2 cancers du larynx), a démontré que l'indométhacine pouvait diminuer l'incidence de la mucosite radique (100). Hypothèse et objectifs La pertinence d'effectuer une nouvelle étude sur la signification pronostique de la COX-2 Le rôle de la COX-2 dans la carcinogenèse et sa surexpression dans plusieurs cancers ont été bien établis. Il a été démontré que les ICOX-2 pouvaient prévenir le développement de cancers, diminuer leur croissance et augmenter leur sensibilité à la radiothérapie. Une surexpression de la COX-2 dans les cancers de la sphère ORL a été clairement démontrée. Par contre, les études antérieures rapportent des résultats contradictoires au suj et de la signification pronostique de la COX-2 dans les cancers de la sphère ORL. Les populations à l'étude sont habituellement très hétérogènes par rapport aux modalités de traitement, au stade TNM et au site de la tumeur. Sachant que ces facteurs ont un impact sur le pronostic, il est impérieux d'en tenir compte. De plus, la majorité des études antérieures n'évaluent pas l'effet de certains facteurs pronostiques bien établis tels que la consommation d'alcool et-de tabac et la présence de comorbidités. Ces études ne tenaient pas compte d'une issue clinique majeure pour les cancers ORL de stade précoce, soit la survenue de SCP. Le peu de participants et la faible puissance statistique de la majorité de ces études peut expliquer qu'il a peut-être été difficile de mettre en évidence une association entre la surexpression de la COX-2 et les différentes issues cliniques. De plus, il n'y a pas de méthode standardisée pour évaluer l'expression IRC de la COX-2. La majorité des études antérieures ont évalué le marquage de façon qualitative (plutôt que quantitative) avec des catégories déterminées arbitrairement et en évaluant des paramètres différents (intensité du marquage vs pourcentage de -cellules marquées). Afin d'intégrer éventuellement l'expression IRC de la COX-2 comme facteur pronostique dans la pratique médicale courante, il faudrait trouver un mode d'évaluation du marquage qui soit objectif, reproductible et qui ait une corrélation avec les issues cliniques. Il est donc nécessaire d'effectuer de nouvelles études avant de pouvoir appliquer ces résultats à la pratique clinique courante. Il serait très pertinent d'évaluer la signification pronostique de la surexpression de la COX2 avec une cohorte de grande taille qui serait plus homogène quant aux modalités de 25 traitement, au stade TNM et au site de la tumeur. Étant donné que le larynx glottique est de loin le site le plus fréquent dans les tumeurs ORL, il serait logique d'effectuer une étude qui s'attarde précisément à ce site. De plus, étant donné que la surexpression de la eOX-2 peut être associée à la résistance à la radiothérapie, il serait intéressant' d'étudier une cohorte traitée par radiothérapie seule. Hypothèses La principale hypothèse de cette étude est que la surexpression de l~ protéine eOX-2 est associée à un pronostic plus ' sombre dans le cancer du larynx glottique de stade l et II traité par radiothérapie seule. Plus spécifiquement, il est supposé que la surexpression de la eOX-2 est associée à une augmentation de la récidive locale, de la récidive tous sites confondus (locale, régionale et à distance) et de la survenue de sep. Finalement, il est proposé que la surexpression de la eOX-2 soit associée à une augmentation des décès de toutes causes. Objectifs de l'étude Objectifs principaux Les objectifs principaux de l'étude sont: 1) d'évaluer par méthode immunohistochimique l'expression de la protéine COX-2 dans le cancer du larynx glottique de stade l et II traité par radiothérapie seule. 2) de détenniner si l'expression de la COX-2 est associée au décès, à la récidive locale, la récidive tous sites confondus et à la survenue de SCP. Les décès sont subdivisés en trois catégories: les décès attribuables au premier cancer (glottique), les décès attribuables aux SCP et les décès d'autres causes. 26 Objectif secondaires De plus, l'étude vise à : 1) évaluer l'association entre l'expression de la COX-2 et les autres facteurs pronostiques du cancer du larynx glottique, ainsi que l'association entre les autres facteurs pronostiques et les issues cliniques. 2) déterminer une méthode de choix pour évaluer l'expression immunohistochimique de la COX-2 de façon reproductible et applicable dans la pratique courante d'un laboratoire de pathologie diagnostique. 3) déterminer la reproductibilité de la méthode d'évaluation de la COX-2 choisie en mesurant la concordance inter-observateur. Matériel et méthodes Devis de l'étude Il s'agit d'une étude de cohorte rétrospective chez des patients avec un cancer épidermoïde du larynx glottique de stade 1 ou II traités par radiothérapie seule et suivis de façon prospective, dans le but d'évaluer la signification pronostique de l'expression de la COX-2 par méthode immunohistochimique dans les spécimens biopsiques pré-radiothérapie. Cette étude a été réalisée chez une population de patients ayant participé à un essai clinique randomisé, à double insu, contrôlé par placebo chez des patients avec un cancer épidermoïde de la sphère ORL de stade précoce traité par radiothérapie seule. L'objectif principal de cet essai clinique était de vérifier l'effet de la prise prolongée d'un supplément de vitamine E sur la survenue d'un second cancer primaire. Cette étude s'intitulait « Alphatocopherol Chemoprevention of Secondary Primary Malignancies in Head and Neck Cancer Patients .», était dirigée par Dr Isabelle Bairati de la Faculté de Médecine de l'Université Laval et subventionnée par l'Institut National du Cancer du Canada (101). L'essai clinique comportait, entre autres, 348 patients avec un cancer du larynx glottique. Population cible La population cible de cette étude est constituée de patients avec un cancer épidermoïde du larynx glottique de stade précoce traité par radiothérapie. Sélection ·des patients Critères d'inclusion Les patients avec tous les critères d'inclusion suivants étaient éligibles pour participer à l'essai clinique : 1) premier diagnostic de cancer de type épidermoïde de la sphère ORL 2) de stade 1 ou II (selon la classification de l'AJCC (102)) 28 3) documenté histologiquement 4) traitement par radiothérapie seule entre le 1er octobre 1994 et le 30 juin 2000 dans les centres de radio-oncologie du Québec 5) âge de plus de 18 ans 6) consentement écrit fourni Un critère supplémentaire a été ajouté uniquement pour le volet immunohistochimique de l'étude. La population à l'étude a été restreinte au sous-groupe de patients avec un cancer . du larynx glottique car les cancers provenant de différents sites de la sphère ORL ont une évolution et un pronostic différents (103). Étant donné que la grande majorité des cancers ORL proviennent du larynx glottique, il est donc logique de restreindre l'analyse à ce sousgroupe. Des 348 patients avec cancer du larynx glottique, la majorité (n=301 patients) avait du matériel biopsique pré-radiothérapie immunohistochimiques et ont été inclus d~s disponible pour effectuer les analyses la présente étude. Critères d'exclusion Les patients qui présentaient un ou plusieurs des critères d'exclusion suivants n'étaient pas éligibles pour participer à l'étude préalable: 1) traitement chirurgical prévu 2) multiples cancers primaires ORL ou cancer à un autre site (sauf pour les cancers basocellulaires de la peau et les cancers in situ du col utérin) 3) statut de performance de Kamofsky (104) de moins de 60% 4) maladie cardio-vasculaire sévère, insuffisance rénale (créatinine> 2 mg/dl), insuffisance hépatique (bilirubine> 1.5 mg/ml, AST > 2 fois la limite supérieure de la normale) ou anomalie hématologique (globules blancs < 3 000 mm3 ou plaquettes < 100 000/mm3) 29 5) prise d'anticoagulants (la vitamine E peut interférer avec le métabolisme de la vitamine K) 6) grossesse pendant la durée de l'étude 7) prise de suppléments de vitamine E à des doses de plus de 50 ru/jour Recrutement des patients Les patients ont été invités à participer à l'essai clinique lors de leur première visite à l'un des six centres de radio-oncologie participant à l'étude: l'Hôtel-Dieu de Québec du CHUQ, l'Hôpital Notre-Dame de Montréal du CHUM, l'Hôtel-Dieu de Montréal du CHUM, le Centre Hospitalier de Chicoutimi, le Centre Hospitalier Universitaire de Sherbrooke et l'Hôpital Maisonneuve-Rosemont de Montréal. Les radio-oncologues ont donné des explications aux patients au sujet de l'étude et leur ont demandé s'ils acceptaient de rencontrer une infinnière de recherche. Celle-ci était mandatée pour donner aux patients des explications plus détaillées au sujet de l'étude, vérifier les critères de sélection et obtenir un consentement éclairé écrit pour chaque sujet éligible qui désirait participer. L'infirmière de recherche notait, pour tous les patients, l'âge, le sexe, le diagnostic, le niveau d'éducation et l'emploi. De plus, pour les sujets non participants, elle consignait la raison de l'exclusion ou du refus de parti~iper. Collecte des données cliniques au moment de la randomisation Les radio-oncologues ont fourni les informations détaillées au sujet de la tumeur primaire (site précis, dimensions et stade clinique selon l'AJCC (102)), les résultats des radiographies pulmonaires ainsi que des autres examens. Les infirmières de recherche devaient questionner les patients à l'aide de questionnaires structurés et recueillir les informations sur les antécédents médicaux, les caractéristiques socio-démographiques (âge, sexe, éducation, revenu), la classe fonctionnelle (KPS) (104), ainsi que les habitudes nutritionnelles, de consommation d'alcool et de tabac. Elles devaient également mesurer la taille, le poids et la tension artérielle du patient. Les numéros de pathologie ont été notés 30 afm de se procurer les lames histologiques et spécimens biopsiques pré-radiothérapie pour les analyses immunohistochimiques. Confirmation du diagnostic et évaluation du grade histologique Toutes les lames histologiques ont été revues par un évaluateur (MKS) à l'insu quant à l'issue clinique et aux caractéristiques des patients afm de confrrmer le diagnostic de cancer épidermoïde et d'évaluer le grade histologique de la lésion. Les critères retenus pour l'évaluation du grade, après revue de la littérature et consultation avec un pathologiste expert (Dr R. Morency, spécialiste en pathologie ORL, Hôtel-Dieu de Québec-CHUQ), sont : la kératinisation ainsi que la présence de ponts inter-cellulaires (critère le plus important), le pléomorphisme cellulaire et les mitoses. Les lésions ont été catégorisées en grade 1 (bien différenciée), grade 2 (modérément différenciée) et grade 3 (pauvrement différenciée). En cas de divergence entre le grade évalué ainsi et le grade indiqué dans le rapport de pathologie, les lames histologiques ont été revues de façon indépendante par un autre évaluateur (BT) qui fut responsable de prendre une décision finale quand au grade. Sélection des anticorps Les critères de sélection pour l'anticorps dirigé contre la COX-2 étaient les suivants. D'abord, un anticorps monoclonal a été préféré pour sa plus grande spécificité par rapport aux anticorps polyclonaux. De plus, l'anticorps devait être facilement disponible. Le clone COX 229 de Zymed Laboratories inc. a été sélectionné. Il s'agit d'un anticorps monoclonal, d'isotype IgG 1-k, développé chez la souris et dont la réactivité a été confirmée chez l'humain. Technique immunohistochimique Les analyses immunohistochimiques ont été effectuées sur des coupes fraîches de 4 um faites à partir des blocs de paraffine des prélèvements biopsiques pré-radiothérapie fixés au formaldéhyde. Les coupes ont été déparaffmées avec du toluène et de l'alcool (100% et 95%). La technique de démasquage d'antigène par micro-ondes a été utilisée. Puis, l'activité de la peroxydase endogène a été bloquée par une solution de peroxyde - - - - - - - - - - - - 31 d'hydrogène à 3%. Du sérum de chèvre a été utilisé afm de bloquer les liaisons antigèneanticorps non spécifiques. Les coupes ont ensuite été incubées pendant une heure à 20°C avec l'anticorps primaire selon la dilution spécifiée par le fabriquant, soit 1/50. Un anticorps secondaire biotinylé (DAKO) a été appliqué, suivi de la solution streptavidineperoxydase (DAKO). Ensuite, le révélateur chromogène DAB (tétrachlorure de diaminobenzidine) a été employé. Finalement, les lames ont été contre-colorées avec l'hématoxyline de Mayer et les lamelles montées sur les lames. Un adénocarcinome colique a été utilisé comme contrôle positif et l'incubation avec l'anticorps primaire a été omise pour le contrôle négatif. Évaluation du marquage immunohistochimique L'évaluation du marquage immunohistochimique pour COX-2 a été effectuée par un évaluateur (MKS) à l'insu quant à l'issue clinique et aux caractéristiques des patients. Pour chaque spécimen, le pourcentage de cellules marquées et l'intensité du marquage ont été évalués quantitativement de 0 à 100% dans dix champs microscopiques à fort grossissement (400X) représentatifs de la tumeur. De plus, l'homogénéité du marquage, le patron de marquage (cytoplasmique, nucléaire, membranaire ou autre) et le marquage stromal ont été évalués de façon qualitative. La surexpression de la COX-2 a été définie comme plus de 50% de marquage dans les cellules tumorales. Afin d'évaluer la concordance inter-observateur, les lames d'un sous-échantillon sélectionné aléatoirement et correspondant à 15% de taille de l'échantillon original ont été réévaluées de façon indépendante par deux évaluateurs (BT et MKS) à l'insu quant au résultat de la première évaluation, à l'issue clinique et aux caractéristiques des patients. Suivi des patients Les visites de suivi des patients ont été. effectuées par les radio-oncologues et les infirmières de recherche à des dates pré-déterminées : immédiatement après que la fin de la radiothérapie, un mois après la fin de la radiothérapie, puis tous les six mois pour les trois premières années et ensuite annuellement à la date d'anniversaire de la fin de la .radiothérapie. Les effets secondaires aigus de la radiothérapie ont été évalués avec l'échelle 32 du RTOG (105) pendant la radiothérapie, à la fin du traitement et à la visite de suivi un mois post-radiothérapie. Les radio-oncologues ont mesuré à nouveau les tumeurs à la visite de suivi un mois post-radiothérapie afm de déterminer la réponse au traitement. La réponse était considérée complète s'il y avait disparition de toute la tumeur, partielle s'il y avait une diminution de plus de 50% du volume tumoral ou absente (106). Lors des visites de suivi, les radio-oncologues ont recherché la présence de récidive du cancer ORL et de seconds cancers primaires. Tout nouvel événement médical et les résultats des investigations étaient soigneusement documentés. Les effets secondaires tardifs de la radiothérapie étaient évalués aux visites de six et douze mois post-traitement à l'aide de l'échelle de la RTOG et EORTC (105). Les patients ont été suivis jusqu'au 30 juin 2003, ce qui correspond à trois ans de suivi pour le dernier patient randomisé. Évaluation des issues cliniques Les issues cliniques évaluées dans le volet immunohistochimique étaient la récidive locale, la récidive tous sites confondus (locale, régionale et à distance), la survenue d'un sep, la survie totale, la survie sans récidive et la survie sans cancer (i.e. la survie sans récidive ou Sep). L'évaluation de la survenue de récidives du cancer ORL et de SCP était effectuée par les radio-oncologues. Les récidives et les sep devaient être prouvéshistologiquement. Afin de distinguer les récidives des SCP, les critères suivants ont été appliqués (il s'agit d'une adaptation des critères utilisés par Warren et al. (16), Lefor et al. (18) et Hong et al. (17)) : 1) une tumeur du même type histologique que la première tumeur devait être séparée de celle-ci par plus de 2 cm d'épithélium normal pour être considérée comme un sep. De plus, la lésion devait, à l'examen histologique, provenir de l'épithélium pavimenteux; une tumeur stromale envahissante sans atteinte de l'épithélium pavimenteux sus-jacent était considérée comme une récidive locale ou à distance. 2) toute tumeur de type histologique différent de la tumeur pnmalre était considérée comme un sep. 33 3) dans le poumon, une tumeur du même type histologique que la première tumeur était considérée comme un sep si elle était solitaire et s'il n'y avait pas d'évidence de récidive régionale (de la première tumeur) dans les ganglions lymphatiques de la chaîne cervicale antérieure. En cas de doute, une révision des lames histologiques était demandée. 34 Méthodes statistiques Les détails de la méthode sont présentés dans l'article au chapitre suivant. Tous les patients répondant aux critères de sélection mentionnés ci-haut ont été inclus dans les analyses. Le temps de suivi des patients a été calculé à partir de la date de randomisation jusqu'à la date de l'événement étudié (récidive, SCP ou décès). Pour les patients n'ayant pas eu d'événement, le calcul du temps s'est arrêté à la date de fin d'étude. Pour les événements cliniques (récidives ou SCP), la date de fin d'étude est le 30 juin 2003, alors que pour le décès, la date de fin d'étude est le 31 décembre 2004. Les critères suivants ont été appliqués pour la censure de l'observation des patients lors des analyses de survie. Les perdus de vue ont été censurés à la date de leur dernière visite de suivi. Pour les récidives, la censure a été effectuée au moment où le diagnostic de récidive a été porté et l'observation a été censurée au moment de la mort pour ceux décédés sans récidive. Des courbes de survie de Kaplan-Meier ont été utilisées pour décrire la distribution du temps jusqu'à la récidive (locale ou à tous sites confondus), jusqu'à la survenue d'un SCP ou jusqu'au décès chez les patients surexpresseurs ou non de COX-2 (107). Un test du Logrank a été effectué pour détecter une différence de survie pour chacun des événements étudiés entre les patients qui surexprimaient la COX-2 et ceux qui ne la surexprimaient pas (107;108). Les facteurs pronostiques ont été évalués dans les modèles d'analyse multivariée par méthode de régression de Cox. L'effet de la COX-2 a été évalué, après ajustement pour les covariables (109). Les autres facteurs pronostiques considérés étaient l'âge, le sexe, le grade histologique de la tumeur, le stade TNM, les paramètres de la radiothérapie, l'index de comorbidités (Chari son (110)), la consommation d'alcool et de tabac. L'effet de traitement attribuable à la prise d'alpha-tocophérol a été pris en considération. Les facteurs qui ont été finalement retenus dans le modèle multivarié pour la mortalité globale sont l'âge, le stade TNM, le grade histologique, le bras de l'essai clinique et l'expression de la COX-2. Pour la survenue de SCP, les facteurs retenus dans le modèle multivarié sont l'âge, l'indice de comorbidité de Charlson, le statut tabagique dans l'année précédente, le bras de l'essai clinique et l'expression de la COX-2. De plus, des analyses bivariées ont été effectuées pour évaluer les associations entre l'expression de la COX-2 et les autres -- - - -- - - - - - - 35 les autres facteurs pronostiques ainsi que l'association entre les facteurs pronostiques et les issues cliniques. Le statut de COX-2 a été dichotomisé en surexpresseur et non surexpresseur. La médiane a été sélectionnée ~n tant que valeur seuil préalablement à l'analyse des données. La concordance entre observateurs a été évaluée à l'aide du Kappa. Confidentialité et considérations éthiques Le protocole initial de l'essai clinique et toutes les modifications subséquentes, incluant l'étude immunohistochimique, ont été approuvés par les comités d'éthique de toutes les institutions participantes. Des méthodes ont été mises en place afin de garantir la confidentialité des dOI1l1-ées et toute information nominale a été conservée dans seulement un fichier. Les autres fichiers ont été anonymisés et les sujets identifiés par un numéro identificateur unique. ----------------------------------------- Article: La signification pronostique de la surexpression de la cyclooxygénase-2 dans le cancer du larynx glottique Résumé Objectif: La cyclooxygénase-2 (COX-2) a été associée à un mauvais pronostic dans plusieurs cai1cers. L'objectif de cette étude est d'évaluer si la COX-2 est un facteur pronostique dans le cancer du larynx glottique. Patients et méthodes: Cette étude fait partie d'un essai clinique de phase III randomisé contre placebo qui évalue l'efficacité de l' alpha-tocophérol pour réduire la survenue de seconds cancers primaires (SCP) chez des patients avec un cancer de la sphère oto-rhinolaryngologique. Des analyses immunohistochimiques ont été effectuées sur les biopsies pré-traitement de 301 patients avec un cancer du larynx glottique de stade précoce traité par radiothérapie. La valeur médiane, correspondant à 50% de cellules tumorales positives pour COX-2, a été utilisée comme valeur seuil pour défmir la surexpression. Les issues cliniques considérées dans les analyses statistiques sont la récidive, les SCP et le décès. Le modèle de régression proportionnel de Cox a été utilisé pour détenniner les rapports d'incidence (RI) et leurs intervalles de confiance à 95% (IC). Résultats: Le RI associé à une surexpression de COX-2 était de 0,94 (le à 95%, 0,55-1,62) pour la récidive. Le RI pour les SCP était de 2,63 (IC à 95%, 1,32-5,23) pour les premières 3,5 années de suivi et de 0,55 (IC à 95%, 0,22-1,32) pour les 3,5 années subséquentes. Le RI associé à une surexpression de la COX-2 était de 1,57 (IC : 1,01-2,45) pour la mortalité globale. Conclusion: La surexpresssion de la COX-2 dans le cancer du larynx glottique est associée à une augmentation de la mortalité globale et confère une augmentation du risque de SCP durant les 3',5 premières années de suivi. Des études subséquentes sont nécessaires pour expliquer les effets observés sur la survenue de SCP. L'expression de la COX-2 pourrait s'avérer utile pour prédire le pronostic d'un patient sur une base individuelle. 37 Prognostic Significance of Cyclooxygenase-2 Overexpression in Glottic Cancer Abstract Purpose: Cyclooxygenase-2 (COX-2) overexpression has been associated with a poor prognosis in many cancers. However, the role of COX-2 overexpression in head and neck cancers remains undetermined. The objective ofthis study was to evaluate whether COX-2 is a prognostic factor in glottic cancer. Experimental Design: This study was part of a phase III placebo-controlled randomized trial evaluating the efficacy of alpha-tocopherol in reducing second primary cancers (SPC) in head and neck cancer patients. Immunohistochemical analyses were conducted on pretreatment biopsies of 301 patients with early stage glottic cancer treated by radiotherapy. The median value of 50% of positive tumor cells was the cut-off point used to define COX2 overexpression. Outcomes considered in the statistical analysis were recurrence, SPC and death. The Cox proportional hazards model was used to estimate the hazard ratios (HR) and their 95% confidence intervals (CI). Results: The HR associated with COX-2 overexpression was 0.94 (95% CI, 0.55-1.62) for recurrence. The HR associated with SPC was 2.63 (95% CI, 1.32-5.23) for the first 3.5 years of follow-up and 0.55 (95% CI, 0.22-1.32) for the following 3.5 years. The HR associated with COX-2 overexpression was 1.57 (95% CI, 1.01-2.45) for overall mortality. Conclusions: COX-2 overexpression in glottic cancer was associated with increased overall mortality and conferred an increased risk of SPC during the first 3.5 years of follow-up. Future studies are needed to explain observed effects on SPC. COX-2 expression may prove helpful in defining an individual patient's prognosis. 38 Introduction Glottic cancer is the most common early stage head and neck (H&N) cancer. The 5 year overall survival rate is between 72 and 85% for stage l cancer and from 59 to 77% for stage II cancer (9;13;14). Local recurrence occurs in about 6 to 28% of patients within 5 years (i 3). Another important outcome for patients with early stage glottic cancer is the occurrence of a second primary cancer (SPC), which is discovered in 15 to 18% of the patients within 5 years and is associated with poor survival (9;111;112). The most common site of SPC is the upper aerodigestive tract (9; 112). SPCs are attributed to a "field cancerization" effect induced by carcinogens such as tobacco, which can alter the respiratory, oral and oesophageal mucosa (20; 113). Although the early stage of glottic cancer is relatively well controlled by therapy, prognosls of these patients is often compromised by the occurrence of SPC. Cyclooxygenase (COX) is the rate-limiting enzyme in the conversion of arachidonic acid into prostaglandins (PGs). It exists in two isoforms, COX-l, which is constitutional, and COX-2, which can be induced by stimuli such as smoking and radiotherapy (22;24;98). COX-2 overexpression increases prostaglandins, which are known to promote tumor development, invasion and metastasis by many mechanisms, most importantly by stimulating angiogenesis through the action of vascular endothelial growth (26;29;65) . .Prostaglandins also induce cell proliferation, reduce apoptosis, suppress the immune response and favor invasion by their action on matrix metalloproteinases (21 ;65). High levels of COX-2 expression have been found in many cancers (31-33;40;42;44;46) and have been associated with poor survival and increased risk of recurrence (35;38;39;43;47;49;114). In head and neck cancers, COX-2 overexpression has been clearly shown (50;53) but its effect on prognosis is still uncertain (26;55;56;61;62). The purpose of this study was to determine the prognostic significance of COX-2 expression in glottic cancer. It was hypothesized that tumors associated with COX-2 overexpression would result in an increased risk of recurrence and overall mortality. Furthermore, it was hypothesized that COX-2 expression could be induced in the whole oral and respiratory mucosa by stimuli such as tobacco smoking, predisposing to the 39 development of SPC. To our knowledge, the association between COX-2 and 8PC has never been studied before. It is 'clear that an immunohistochemical marker that could predict which tumors are more at risk for death, SPC and recurrence might prove useful, especially if this marker is a potential phannaceutical target. 40 Materials and Methods Patient Selection and Study Design This study was conducted as part of a phase III multicenter, randomized, double-blind, placebo-controUed chemoprevention trial which had as primary objective to evaluate the efficacy of antioxidant vitamin supplementation in decreasing the occurrence of second primary cancer in head and neck cancer patients (115). The vitamin supplementation consisted of DL-alpha-tocopherol, a synthetic form of vitamin E, given at a daily dosage of 400 lU, and beta-carotene at a daily dosage of 30mg. The supplementation was given during radiotherapy and for 3 years after the end of radiotherapy. Concems about the adverse effects of beta-carotene supplementation prompted the investigators to haIt its use in January 1996 after the first 156 patients had been enroUed. The trial was then continued with alpha-tocopherol alone. Between October 1, 1994 and June 6, 2000, 540 patients with a first diagnosis of stage 1 or stage II head and neck squamous cell carcinoma treated by radiotherapy were recruited in five radiation oncology centers of the Province of Québec, Canada, to take part in this study. The study protocol was approved by the ethics committees of aU the institutions involved. For the purpose of this immunohistochemical study, the study population was restricted to glottic larynx cancer, which is by far the most frequent early stage head and neck cancer, to ensure homogeneity because the site of origin may influence prognosis. Diagnostic Confirmation and Histological Grade Assessment One observer (MKS) reviewed the histological slides of pre-treatment biopsies ta confirm the diagnosis of squamous cell carcinoma and ta evaluate the histological grade of tumours in a unifonn manner. Assessment of the histological grade was based on the extent of tumor keratinization, the presence of interceUular bridges, cellular pleomorphism, and mitosis. A11lesions were categorized as grade 1 (well differentiated), grade 2 (moderately differentiated) and grade 3 (poorly differentiated). 41 Immunohistochemical Analyses COX-2 expression was determined by immunohistochemistry on freshly cut 4-um tissue sections of the paraffin-embedded pre-treatment biopsies. Slides were deparaffinized with toluene and solutions of 100% and 95% ethanol. Microwave heat induced epitope retrieval was performed with a pH 6.0 citrate buffer solution. Endogenous peroxidase activity was blocked with a 3% solution of hydrogen peroxide. Goat serum was used to prevent nonspecific antigen binding. Slides were then incubated for 1 hour with a mouse monoclonal antibody, clone COX 229 (Zymed Laboratories Inc.), at a 1:50 dilution. A biotinylated secondary antibody (DAKO) followed by streptavidine-horseradish peroxidase (DAKO) was then incubated for 20 minutes each. The chromogen diamino-benzene was applied for 6 minutes. Slides were then counterstained with Mayer' s hematoxylin, dehydrated with increasing gradients of ethanol, ranging from 50% to 100%, and treated with toluene and xylene before being mounted. A colon cancer was used as the positive control. The COX-2 antibody was omitted for the negative control. One observer (MKS), blinded to patient baseline characteristics and outcomes, assessed tumor staining. The percentage of positive tumor cells was evaluated quantitatively from 0 to 100%. We elected a priori to use the median value, which corresponded to 50% of positive tumor ceIls, as the cut-off point to define overexpression. The intensity of staining was assessed using an arbitrary scale from 0% to 100% and 50% was also used as the cutoff point. Data Collection and Patient Follow-up Baseline data collection was completed before randomization. A structured questionnaire administered to aIl patients by research nurses provided data on patients' socioeconomic characteristics, weight, height, medical history, alcohol and tobacco consumption and diet. Radiation oncologists provided information on the primary tumor: site, dimensions and clinical TNM stage. Comorbidities were assessed using the Charlson comorbidity index (110). Follow-up visits with study nurses and radiation oncologist were scheduled immediately at the end of the radiation therapy, one month later, then every 6 months for the first 3 years followed by once a year until the end 'of the study (June 30, 2003). 42 Radiation oncologists monitored for recurrence ~f the primary cancer or development of a SPC. Medical notes, hospital records and pathology reports were obtained from the medical centers. Death certificates were obtained from medical records and the "Institut de la statistique du Québec". T0 ensure complete ascertainment, record linkage with the Québec mortality files was performed using the unique Québec health insurance identifier (116). ClinicalOutcomes The clinic al outcomes considered were death, local recurrence, any recurrence (local, regional and distant combined) and SPC. Death was subdivided into 3 categories according to cause: death from first (glottic) cancer, from SPC or from other causes. Strict criteria were applied for the diagnosis of SPC in order to distinguish them from first cancer recurrence (115). Statistical Analyses The clinical prognostic factors evaluated as potential confounders in the statistical analysis were TNM stage, histological grade, age, sex, intervention arm of the trial, smoking, alcohol consumption, Charlson comorbidity index and radiotherapy parameters (9). Standard statistical tests were used to assess the association between COX-2 expression and other prognostic factors. For overall mortality, Kaplan-Meier s~ival curves were used to de scribe time until the occurrence of the outcome depending upon the level of COX-2 expression. For the survival analyses, follow-up time was calculated from the time of randomization until the time of the last visit or tl)e date of the outcome of interest (recurrence, SPC or death). For death, follow-up was calculated from the time of randomization until death or December 31, 2004. The Cox proportional hazards model was used to estimate the associations between COX-2 overexpression and recurrence of the first primary cancer, occurrence of a SPC and death (overall and from specific causes). The proportionality·assumption of the Cox models was evaluated using models with a time-dependent coefficient. The effect of supplementation on the occurrence of a SPC varied according to time (p-value=O.007). We then conducted multivariate analyses evaluating the risk of SPC associated with COX-2 overexpression 43 according to two time periods: 1) from entry until 3.5 years, and 2) beyond 3.5 years after randomization. We also examined whether the associations between COX-2 expression and outcomes were modified by trial ann, using the Wald test. There was no statistically significant interaction between expression of COX-2 and trial arm for recurrence (p-value for interaction test =0.91), SPC (p-value for interaction test ~ 0.37) or for overall and specific death (p-value for interaction test ~ 0.34). These results indicated that the effect of COX-2 on the selected outcomes could be evaluated among all patients, without stratifying for trial arme For each outcome, the Cox model was also used to take into account potential confounders such as trial artn, standard prognostic variables, as well as variables strongly associated with each outcome in the data. For overall mortality, the factors included in the model were age (continuous), TNM stage (1 versus II), histological grade (1 versus 2 or 3), trial ann (supplementation arm versus placebo arm) and COX-2 expression (~50% versus >50%). For SPC, the factors included in the model were age (continuous), Charlson comorbidity criteria «1 versus ~ 1), smoking status in the year preceding the randomisation (smoker versus non-smoker), trial arm (supplementation arm versus placebo arm) and COX-2 expression (~50% versus >50%). To evaluate whether COX-2 added prognostic information to standard prognostic factors, we also generated the likelihood ratio test, which is the difference between the maximized log likelihood statistics for the models including standard prognostic factors with and without the COX-2 variable. All analyses were performed using SAS, version 8.2 (SAS Institute). A two-side alpha was fixed at 0.05 for all statistical tests. 44 Results Patient and Tumour Characteristics Of the 348 patients with glottic cancer in the clinical trial, 301 (86.5%) had material available for immunohistochemistry. The main baseline patient characteristics are presented in Table 1. The mean age was 63 -years (SD: 10). Two hundred thirty two (77%) patients had stage 1 cancer. The majority of patients were males and were smokers. One hundred forty nine (49%) patients with glottic cancer were in the trial arme AlI patients were treated for their glottic cancer by first intention radiation therapy. The mean dosage was 61 Grays (SD: 7.4). COX-2 staining was cytoplasmic in aIl cases. There was also sorne staining in the adjacent normal or dysplastic mucosa. Association between COX-2 and Prognostic Factors Figure 1 shows examples of immunostaining for COX-2. There was no statistically significant association between any of the prognostic factors studied and COX-2 overexpression (Table 1). Although not statistically signiticant, there was a trend for higher grade tumours to overexpress COX-2. Of the patients whose tumor overexpressed COX-2, 65% had grade 2 or 3 tumors, wheras of those whose tumor underexpressed COX-2, 55% had a grade 2 or 3 tumor (P = 0.06) . . COX-2 Overexpression and Outcomes After a median folIow-up of 4.3 years, a total of 53 patients had a recurrence of their tirst glottic cancer (including 47 local recurrences), and 60 patients had a SPC. The main site of SPC was the lung and trachea (n = 25). After a median follow-up of 6.5 years, there were 79 deaths: 22 from the first glottic cancer, 26 from SPC, and 31 from other causes. Crude associations between COX-2 expression and outcomes are reported in Table 2. There was no association between COX-2 and recurrence of the first glottic cancer (HR, 0.94; 95% CI: 0.55-1.62). Similarly, there was no association between mortality from the first glottic cancer and COX-2 overexpression (HR, 1.04; 95% CI, 0.45-2.40). Figure 2A shows that patients who overexpressed COX-2 had an increased risk of overall mortalit)' - - - - - - - -- - 45 compared to those <50% of COX-2 expression (P = 0.04). Table 3 shows that, even after ' taking into account other prognostic factors, the association between COX-2 and overall mortality remained similar and statistically significant (HR, 1.62; 95% CI, 1.04-2.53). Survival curves showed that an Ïncreased risk ofSPC was observed in patients with COX-2 overexpression, however this effect was only observed during the fIfSt 3.5 years of the trial (Figure 2B). After adjustment for other prognostic factors of SPC, COX-2 overexpression remained strongly associated with an increased risk of SPC during the first 3.5 years of the trial (HR, 3.05; 95% CI, 1.52-6.13), while there was an inverse non-significant association beyond 3.5 years (Table 4). 46 Discussion In our study, COX-2 tumour overexpression was associated with a significantly increased risk of overall mortality. In addition, patients who had COX-2 overexpression in their frrst glottic tumor presented an increased risk of having a SPC during the frrst three and a half years of the clinical trial. Current literature reveals conflicting results for the risk of overall mortality associated with COX-2 overexpression. Our results are in agreement with those of Gallo et al. (26) who found that COX-2 overexpression was associated with poorer overall survival. They studied in multivariate analysis 52 patients with stage l to IV head and neck cancer treated by surgery. In addition, Chang et al. (55) reported an association between COX-2 overexpression and decreased 3 year survival (odds ratio, 0.41; 95% CI, 0.20-0.84) in 82 patients with stage l to III oropharyngeal cancer receiving several treatment modalities. However, results were adjusted only for age. On the other hand, RaneIletti et al. (61) found that low levels of COX-2 expression were associated with a decrease in overaIl survival. This study was conducted among 61 patients with stage l to IV larynx cancer having received different treatment modalities. Bayazit et al. (62) found no correlation between ÇOX~2 expression and survival, but this study was restricted to a smaIl group of39 patients with stage l to IV larynx cancer treated by surgery. AlI these studies were carried out on patients with different tumor-node-metastasis stages and/or . exposed to a variety of therapies. It is weIl recognized that the prognosis differs between tumors from different head and neck sites as weIl as between early-stage (1 and II) and late-stage cancer (III and IV) (103). Furthermore, the literature suggests that COX-2 overexpression is induced by radiotherapy (65;98) but not by surgery. The difference in these results might also be explained in part by the lack of a uniform measurement method for COX-2 expression and definition for COX-2 overexpression. One of the strengths of our study is that it has the largest and most uniform group of patients in terms of tumor location, cancer staging and treatment modalities. The relationship found between COX-2 overexpression in the first glottic tumor and the risk of SPC is intriguing. Several hypotheses can be proposed to explain this finding. First, 47 we cannot exclude the possibility that this significant association might have been obtained by chance because we conducted several comparisons to assess the impact of COX-2 overexpression on several outcomes. However, this association is pl~usible in light of our knowledge concerning COX-2 expression and the biology of SPC. COX-2 is an inducible enzyme that has been reported to be overexpressed in the oral mu~osa of active smokers, as weIl as in premalignant and malignant tissues (117; 118). The etiology of SPC, especially those of the aerodigestive tract, may be in part explained by the clinical phenomena of "field cancerization" (113; 119). Mucosa may have undergone changes due to carcinogen expo sure , such as tobacco and alcohol~ and is therefore susceptible to the development of many foci of transformation (120;121). In addition, epidemiological studies supported the role of tobacco exposure on the occurrence of SPC. Dikshit et al. (122) reported an increased risk of SPC of the lung in heavy cigarette smokers among a cohort of 876 patients with laryngeal or hypopharyngeal carcinoma. Day el al. (123) showed that smoking status coIlected at the time of detection of the first primary oral/pharyngeal cancer was a predictor of a second aerodigestive tract cancer. Current smokers have a 4-fold increased risk of SPC compared to nonsmokers and former smokers. Altogether, these studies support the hypothesis that COX-2 overexpression of the first primary cancer, induced by smoking, IDight be an indicator of the presence of a latent SPC. The fact that the association between COX-2 overexpression of the first tumor and the occurrence of SPC was only observed during the early years offoIlow-up may support this hypothesis. Although our study found no relationship between COX-2 and recurrence, sorne authors found that COX-2 overexpression increased the risk of recurrerice. Cho et al. (56) studied 123 patients with early -stage laryneal cancer treated by radiotherapy. In a univariate analysis, there was no significant association between COX-2 overexpression and local recurrence (HR, 1.49; 95% CI, 0.73-3.02), but adjusted analyses showed an association with a relative risk of local recurrence of2.57 (P = 0.01). Gallo et al.(26) found that COX-2 overexpression was associated with a decreased risk of disease-free survival. Surprisingly, Ranelletti et al. (61) found that disease-free survival at 5 years was 84% in patients with COX-2-positive tumors compared to 30% in those with COX-2-negative tumors (P = 0.0012). These contradictory data are difficult to explain but may be related in part to heterogeneity in tumor sites, stage and treatment modalities among ~ifferent studies. 48 The significant association between COX-2 overexpression with SPC and mortality and lack of association with local recurrence is also intriguing. We do not have a good explanation for this finding. Although we cannot exclude the possibility that this significant association might have been obtained by chance, we think that it might relate to the biology of COX-2. lndeed, our analyses showed that the standard prognostic factors were different, at least in part, for the overall mortality, SPC, or local recurrence. This suggests that COX2 may act on a variety of biological variables and that overexpression may affect the mortality form other causes than cancer. 49 Conclusion In conclusion, COX-2 overexpression in glottic cancer was shown to be significantly associated with an increased risk of overall mortality and an increased risk of SPC during the first 3.5 years of the follow-up periode The potential clinical implications are that the level of COX-2 expression may prove helpful in defming more precisely an individual patient's prognosis and assist in tailoring therapy. The use of COX-2 inhibitors in larynx cancer is a promising therapeutic avenue that will need to be explored (65;124). Acknowledgements We are grateful for the contributions of Gilles Hamel, who performed the immunohistochemistry techniques, Dr Raynald Morency for his expert insight on head and neck cancer and Dr Claude Lavigne for his advice. 50 Tables and figures from the article Table 1. Association between COX-2 expression and standard prognostic factors in patients with glottic cancer n (010) Factors Age (y) 109 (36) 112 (37) <60 60- 69 :::;,, 70 Gender Trial arm Smoking in the preceding year Alcohol intake in t he preceding year Charlson comorbidity index Tumor stage Histologie grade Radiotherapy (total dose) COX-2 >50 0/0 (n n (010) Male Intervention Yes > 1 drink per day ~1 1 2 or 3 >64 Gy sa (27) 264 149 170 73 116 232 180 178 (88) (49) (57) (24) (39) (77) (60) (59) = 139), COX-2 :;;50°/0 (n 55 (40) 45 (32) 54 (33) 67 (41) :39 (Z6) 41 (Z5) 124 68 73 31 48 104 91 82 = 162), P n (°/0) (89) (49) (53) (22) (35) (75) (65) (59) 140 81 97 42 68 128 89 96 0.27 (86) (50) (60) (26) (42) (79) (55) (59) 0.46 0 .85 0 .20 0.46 0.19 0 .39 0.06 0.96 Abbreviation: n, number of patients. Table 2. Crude HRs of recurrence, SPC, and mortality associated with COX-2 expression Outcomes Any recurrence Loca 1 recurrence SPC During the first 3 .5 y of follow-up Beyond 3.5 y of follow-up Death From ail causes From first cancer From SPC From other causes COX-2 >500/0 (n no. events (010) = 23 (17) 21 (15) 25 (18) 7 (8), n 84 = 44 10 16 18 (32) (7) (12) (13) 139), COX-2 :;;50 0/0 (n no. events (010) = 162), 30 (19) 26 (16) 12 (7) 16 (14), n 35 12 10 13 = 113 (22) (7) (6) (8) Crude HR (95 0/0 CI) 0.94 (0.55-1.62) 0.99 (0.56-1.62) 2 .63 (1.32-5 .23) 0 .55 (0.22-1.32) 1.57 1.04 2.04 1.71 (1.01-2.45) (0.45-2.40) (0 .93-4.50) (0.84-3.49) ,- -- - - -- - - -- - - - - - - - - - - - - - - --------------------------------------- - - - - - - -- - - - - - - - - - - - - - - - - - - - - - - - - - 51 Table 3. Adjusted HRs of overall mortality associated with COX-2 expression and other prognostic factors Adjusted HR (95% Factors Age (eontinuous) Tumor-node-metastasis stage Stage l Stage II Histologie grade Grade 1 Grade 2 or 3* Trial intervention arm CI) 1.06 (1.03-1.08) LOO 1.56 (0.95-2.58) 1.00 1.12 (0.70-1.78) 1.00 Placebo arm Supplementation arm 1.54 COX-2 expression 5500/0 >50% 1.62 Ukelihood ratio test statistie for COX-2 expression = 4.51; ddl = 1; P (0.98-2.58) LOO (1.04-2.53) = 0.03 *There were 16 cases with grade 3. Table 4. Adjusted HRs ofSPC Second Primary Cancer associated with COX-2 expression and other prognostic factors according to two periods Factors Age (continuous) Charlson comorbidity index <1 ~1 During the Intervention perlod (first 3.5 yof the trial), HR (95 % CI) During the follow-up period (follow-up beyond 3.5 y), HR (95 % 1.03 (1.00-1.07) 1.03 (0.98-1.09) 1.00 1.64 (0.84-3.35) 1.00 1.06 (0.44-2.57) 1.00 1.67 (0.84-3.35) 1.00 1.40 (0.56-3.48) 1.00 2.21 (1.11-4.43) 1.00 0.29 (0.10-0.79) Smoking status in the preceding year Nonsmokers Smokers Trial intervention arm Placebo arm Supplementation arm COX-2 expression 5050% >50% 1.00 3.05 (1.52-6.13) Likelihood ratio test for COX-2 ddl = 1; P = 0.001 = 10.70; 1.00 0.54 (0.22-1.38) Likelihood ratio test for COX-2 ddl = 1; P = 0.19 = 1.72; CI) 52 Figure .1. Immunostaining for COX-2. (A) no immunostaining. (B) arrow, expression of <50% of cells. (C) overexpression of >50% cells. 53, A 100% ....~--"'-... 90% .. --._-.~_ ~ -1 __ 80% #. 70% J 60% ~ 50% .~ e ._-----'" L. 40% Log-rank test p=O.044 Q.J > ~ 30% 0 20% ----- Cox-2 ~ 50 10% - O%~ Cox-2> 50 ______~__p -_ _p-~~~_ _~_ _~_ _ _ _ _ _~ o 2 3 4 5 6 154 151 117 143 112 131 97 102 7 8 67 40 30 10 Years 23 3 17 3 9 Atrisk Cox-2~50 1:: 162 ' 160 Cox-2> 50 B 139 _ _ _ _ _ _ _._ . ______________________________,_ . . 125 135 ~_~ 81 53 ~ 80% ~ 70% ~ 60% '>::; 50% "" 40% 30% log-rank test p=O.0042 20% ___ w. Cox-2 ~ 50 10% - - Cox-2>SO O%T-----~----r_--_,r_--__----~----_r----_r 0.0 0.5 1.0 15 2.0 2.5 3.0 3.5 Years At rlsk Cox-2 s: 50 162 Cox- 2 >50 139 158 133 151 147 126 120 1115 143 107 141 104 113 84 "r--o 100% C 156 4-- ___ -- .. _..,.- --,-- 90% L-, --'~- --~-- -'. . ------"""----------...--------------el::: 80% 70% 60% ru > .~ :::l V\ 50% 40% 30% Log-rank test p=0.1735 20% ----- Cox-2 ~ 50 - - Cox-2>50 10% 0% 0 Atrisk (ox-2 S 50 113 Cox-2 >50 84 80 63 2 3 4 53 45 31 24 13 15 5 Years 3 Figure 2. Survival according to COX-2 expression. (A) Overall survival according to COX-2 expression. Kaplan-Meier survival curves until occurrence of a SPC according to COX-2 expression (B) during the frrst 3.5 Y after randomization, and (C) beyond 3.5 years after randomization. Résultats Les informations contenues dans ce chapitre sont complémentaires à celles de la section correspondante dans l'article du chapitre précédent. Caractéristiques des patient~ et des tumeurs Le premier tableau de l'article du chapitre précédent (Table 1) montre les caractéristiques principales des 301 patients à l'étude. L'âge moyen était de 63 ans (DS : 10). Soixante-dixsept pourcent des patients avaient un cancer de stade 1 et 23 % de stade II. La maj orité des patients étaient des hommes (88%) et fumaient dans l'année précédant leur diagnostic (57%). Quarante pourcent des tumeurs étaient de grade histologique 1 et 60% de grade histologique 2 ou 3. Cinquante et Un pourcent des patients étaient dans le bras placebo et 49% dans le bras d'intervention avec supplément vitaminique de l'essai clinique. Tous les patients ont été traités pour leur cancer glottique par radiothérapie seule avec une dose moyenne de 61 Gray (DS : 7,4)., Aucune association statistiquement significative entre ces caractéristiques et la surexpression de la COX-2 n'a été identifiée, mais il y avait une tendance pour les tumeurs de grade histologique 2 ou 3 à surexprimer la COX-2 par rapport aux tumeurs de grade 1 (65 vs 55%, p = 0,06). Le marquage pour COX-2 était cytoplasmique (Figure 1 de l'article du chapitre précédant). Cette étude a démontré que la COX-2 était surpexprimée dans le cancer du larynx glottique . et que cette surexpression était associée à un pronostic plus sombre. - ---- ----~ 55 Surexpression de la COX-2 et issues cliniques Cinquante-trois patients ont eu une récidive de leur premier cancer glottique (incluant 47 récidives locales), 60 patients ont eu un SCP et il y a eu 79 décès dont 22 attribuables au premier cancer, 26 aux SCP, et 31 d'autres causes (Figures 7 et 8). Issues cliniques (J) ....... c 0) E 0) c >'Jl) "0) "'D 100 79 80 60 40 0) L.- ...Q E 20 Ct z 0 Mortalité global e Figure 7. Fréquence des issues cliniques. N=301 patients. sep Récidives toutes Récidives locales causes 56 Causes de décès Figure 8. Causes de décès spécifiques. N=79 décès de toutes causes. La majorité des décès ne sont pas attribuables au premier cancer. Le second tableau de l'article du chapitre précédent (Table 2) et les figures 9, 10 et 12 montrent les rapports d'incidences bruts associés à la surexpression de la COX-2 pour les différe~tes issues cliniques de l'étude. Aucune association n'a été retrouvée entre la surexpression de la COX-2 et la récidive du premier cancer glottique (Table 2 et Figure 9). 57 Récidive selon la surexpression de COX-2 ~ 2 oC m u 1.5 c~ U c 0,99 0,94 'C 1 i6 ~ 0.5 cQ. Q. CG a: ° Récidive locale Toutes récidives Figure 9. Rapports d'incidence bruts pour la récidive associée à une surexpression de la eOX-2. Aucune association statistiquement significative n'a été démontrée entre la récidive et la surexpression de la eOX-2. La surexpression de la eOX-2 a été associée à une augmentation de la mortalité globale (RI = 1,57; le à 95% 1,01-2,45) mais il n'y avait pas d'association statistiquement significative avec les causes de décès spécifiques (Table 2 et Figure 10). Par contre, l'ampleur des associations suggère que la surexpression de la eOX-2 est associée au décès du fait des seconds cancers et des autres causes de mortalité. L'analyse multivariée démontre que même après prise en considération des autres facteurs pronostiques, la surexpression de la eOX-2 demeure un facteur pronostique indépendant pour la mortalité globale (RI = 1,62 ; le à 95% 1,04-2,53 ; Table 3 et Figure Il). Les courbes de survie de Kaplan-Meier montrent que les patients surexprimant la eOX-2 ont un risque accru de mortalité globale (p = 0,04 ; Figure 2A). 58 Décès selon la surexpression de COX-2 tn 5 CI) 4 2 oC G) () ~ 'u 3 .5 :g 2 oc. c. 1 ~ 0 ~ 1,71 1,04 tn 1:: 2,04 1,57 ~--~----~--------~~~~------- Toutes causes Premier cancer sep Autres causes Causes de décès Figure 10. Rapports d'incidence bruts pour les décès (selon leur cause) associés à une surexpression de la COX-2. La surexpression de la COX-2 est associée à un risque accru de décès de toutes causes. 59 Mortalité globale selon les facteurs pronostiques 3 OJ U C Q) 1,62 :E 2 cU'Q) ... 1,54 1,56 .en ::l 1,12 ...... ~ ~cu 0 1 c. c. co 0:: 0 . .~0<:::- ~0;0 F:J~ ~0 ~~ ~ ~0 n, ~0~O~ V ~o 0 b Co,'li .~o ~ ~0 '&~ &~~V CO G 0.0 ~~ ~0 ·0<:::- ~ ~ 0~ b0 'l; ~~~'li<Q<:': ~ 0(6 Facte,urs pronostiques Figure Il. Rapports d'incidences ajustés pour la mortalité globale associée à une surexpression de la COX-2 et aux autres facteurs pronostiques. Pour le stade, le rapport d'incidence est évalué pour les tumeurs de stade II par rapport à celles de stade 1. La surexpression de la COX-2 a également été associée à un risque accru de développer un SCP dans les 3,5 premières années de suivi de l'essai clinique seulement (Table 2, Figure 2 de l'article et Figure 12) et l'analyse multivariée montre qu'elle demeure un facteur pronostique indépendant après ajustement pour les autres facteurs pronostiques (RI = 3,05 ; IC à 95% 1,52-6,13; Table 4 et Figure 13). Aucune association statistiquement significative n'a été démontrée entre la surexpression de la COX-2 et les SCP après 3,5 années de suivi. La figure 13 montre également que l'âge et l'appartenance au bras d'intervention avec supplément vitaminique de l'essai clinique étaient associés à une incidence accrue de SCP dans les 3,5 premières années de suivi (voir Figure 13 et Table 4). Par contre, l'appartenance au bras d'intervention avec supplément vitaminique de l'essai clinique était associée à une incidence diminuée de sep après les 3,5 premières années de suivi (voir Figure 13 et Table 4). L _ _ _ __ _ -- - - - - - -- - - - - -- - -_ ._ - - - - -- - - - - - 60 tn 2 .c SCP selon la surexpression de COX-2 6 tn 8c: 5 "C ·u 4 CD .5 ;, 3 1:: tn 2 0 Co c.. 1 2,63 tO ~ 0 < 3,5 années >3,5 années Période de suivi Figure 12. Rapports d'incidence bruts pour la survenue d'un SCP associé à une surexpression de la COX-2. La surexpression de COX-2 est associée à un risque accru de développer un SCP dans les 3,5 premières années de suivi. sep selon les facteurs pronostiques o < 3.5 années ~ c Q) 0 Cl Q) :::J ..,C"" c~ c:.;:; m :::J m è: Cl) cOma. .., ~ UJ .~ .., Q) :::J :::J .~ lU Cl lU ..... ...en .c co .., "Cl) - .c. -0 ..... "0) Q):t:::: -0:2 x.c Q) ~ "'Co c: E 0 0 > 3.5 années ...--... c: 0 U) ~ co .J::. () '-"'" Facteurs pronostiques Figure 13. Rapports d'incidence ajustés pour survenue d'un SCP associé à une surexpression de la COX-2 et aux autres facteurs pronostiques. - -- - - 61 Afin de déterminer la meilleure méthode d'évaluation de l'expression de la COX-2, le marquage pour cet anticorps a été évalué de plusieurs façons. Le pourcentage de cellules tumorales positives pour la COX-2 corrélait davantage avec les issues cliniques que l'intensité du marquage, le patron de marquage et le marquage stroma!. Afin de déterminer la reproductibilité de cette méthode d'évaluation de l'expression de la COX-2, le coefficient de corrélation inter-observateur a été calculé avec la statistique Kappa. Un évaluateur (BT) a revu 15% de l'ensemble des lames immunohistochimiques sélectionnées de façon aléatoire afin de comparer son interprétation de l'expression de la COX-2 à celle de l'évaluateur principal (MKS). La statistique Kappa ainsi obtenue pour le statut d'expression dichotomisé en surexpresseur et sous-expresseur avec une valeur seuil fixée à 50% était de 0,67. Ceci correspond à une bonne reproductibilité ou concordance inter-observateur (soit 0,4 < Kappa < 0,77). 62 Discussion Les études antérieures avaient démontré qu'il y 'avait surexpression immunohistochimique de la protéine COX-2 dans les cancers de la sphère ORL et notre étude a confirmé qu'elle était surexprimée dans le carcinome épidermoïde du larynx glottique de stade l et II traité par radiothérapie seule. Les études antérieures rapportent des résultats contradictoires au sujet de la signification pronostique de la COX-2 dans les cancers de la sphère ORL. Cette étude a permis de confirmer notre hypothèse que la surexpression de la protéine COX-2 est associée à un pronostic plus sombre dans le cancer du larynx glottique de stade précoce traité par radiothérapie en mettant en évidence une association entre la surexpression de la protéine COX-2 et une augmentation des décès de toutes causes (voir Figure 10 et Table 2) ainsi qu'une augmentation de la survenue de SCP dans les 3,5 premières années de suivi (voir Figure 13 et Table 2). Bien qu'aucune association significative n'a été démontrée entre la surexpression de la protéine COX-2 et les décès de causes spécifiques (voir Figure 10 et Table 2), l'ampleur des associations suggère que la surexpression de la COX-2 est associée au décès du fait des SCP ~t des autres causes de mortalité. De plus, une association entre la surexpression de la protéine COX-2 et la récidive locale ainsi que la récidive tous sites confondus (locale, régionale et à distance) n'a pas été mise en évidence (voir Figure 9 et Table 2). On peut tenter d'expliquer ce résultat par le fait que notre population à l'étude est constituée de patients avec un cancer glottique de stade précoce. À ce stade, les récidives sont moins fréquentes et le pronostic de ces patients est davantage influencé par la présence de comorbidités et la survenue de SCP, en comparaison avec des patients avec un carcinome de stade avancé. En effet, dans cette étude, il y a eu 79 décès et 60 SCP alors que seulement 53 récidives sont survenues (voir Figure 7). Aucune association significative n'a été retrouvée entre la surexpression de la protéine COX-2 et les différents facteurs pronostiques du cancer du larynx glottique, mais il y avait une tendance pour les tumeurs de plus haut grade histologique à surexprimer la COX-2 (voir Table 1). Une analyse multivariée a montré que la surexpression de la protéine COX2 et l'âge étaient associés à une augmentation de la mortalité globale (voir Figure 11 et -- --- -------------------------------~ 63 Table 3). De plus, ces deux facteurs pronostiques ainsi que l'appartenance au bras d'intervention avec supplément vitaminique de l'essai clinique étaient associés à une incidence accrue de SCP dans les 3,5 premières années de suivi (voir Figure 13 et Table 4). L'immunohistochimie est une méthode relativement simple, peu coûteuse et applicable dans la pratique courante d'un laboratoire de pathologie diagnostique pour évaluer l'expression de la protéine COX-2. Puisqu'il . n'y a pas de méthode standardisée pour évaluer l'expression immunohistochimique de la COX-2, nous avons évalué quantitativement le pourcentage de cellules tumorales marquées, l'intensité du marquage, le patron de marquage et le marquage stromal pour chaque tumeur et avons constaté que le pourcentage de cellules tumorales marquées étaitle paramètre qui corrélait davantage avec le pronostic. Le statut d'expression a été dichotomisé en surexpresseur et sous-expresseur avec une valeur seuil fixée à 50%, soit la valeur médiane pour cette étude. D'autres études sont nécessaires pour valider ces résultats~ L'évaluation du pourcentage de marquage au niveau des cellules tumorales est une méthode simple et déjà utilisée régulièrement en pathologie pour plusieurs marqueurs (par exemple le Ki-67). De plus, la mesure de la concordance iriter-observateur a permis de démontrer que cette méthode avait une bonne reproductibilité (Kappa = 0,67). Comparaison des résultats avec les études antérieures Voir la section correspondante dans l'article ci-haut. Tableau 8. Comparaison des résultats de la littérature pour la signification pronostique de la surexpression de la COX-2 Auteurl Annb Nombr. d. plllinti ClnldirlltlqUII da plllll111 .t tumeurl Sltll StlCl. 1 et Il RilqullSlGcli 6111uraprlliion dll. CDX.2 Tr.ltlmlntl Morlllté globale Riddlvl SCP Rad iothérapie Augmentée RI1 p7 OC 1,01·2,45) NIS RI 0,94 OC D,55· 1,62) Augmentée pour les 3 p premières années de suivi RI 2,63 (IC 1,32·5,23) Sackett et al. 2008 301 Larynx glottique Gallo et al. 2002 52 22 larynx, 18 oraux et 12 oropharyngés 1 à IV Chirurgie (+1. traitements adjuvants) Augmentée Non évaluée Non évalué Chang et al. 2004 82 Oropharynx Il àlV Variables Augmentée, survie à 3 ans diminuée avec RC 0,41 OC 0,20-0 t34) NIS RI 0,94 OC 0,55· 1,62) Non évalué Ranelletti et al. 2001 61 Larynx (4 glottiques, 19 supra glottiques et 38 transglottiques) 1 àlV Chirurgie (+1- traitements adjuvants) Diminuée Diminuée Non évalué Nix et al. 2004 122 Larynx (55 glottique et 6 su praglottiqu es) 1 et Il Rad iothéra pie Non évaluée Augmentée (67% des cas de récidives COX+vs 41% COX·) Non évalué Cho et al. 2001 123 Larynx (98 glottiques et 25 supraglottiqu es) 1 et Il Radiothérapie NIS Augmentée RR de récidive locale de 2,57 OC 1.21 -5,47) Non évalué Terakado et al. 2004 41 Cavité orale Radiothérapie préopératoire Non évaluée Non évaluée Non évalué 8ayazit et al. 2004 39 Larynx Chirurgie NIS N,s Non évalué Atula et al. 2006 65 32 cavité orale ,29 oropharynx et 14 hypo ph arynx Variables N/S N,s Non évalué 1 à IV lIàlV Riponsi i 1. Diminuée Diminuée NIS=Non significatif 0'\ ~ ------------------------------------------------~ 65 Forces de l'étude La signification de l'expression de la COX-2 dans le cancer de la sphère ORL, dont le cancer du larynx glottique, n'est pas bien établie car les quelques études antérieures ont ~émontré des résultats contradictoires. Ces études sont de petite taille et comportent des populations de patients hétérogènes quant au site anatomique tumoral, au stade TNM et aux modalités thérapeutiques utilisées. De plus, les données sur ces patients ont été recueillies de façon rétrospective, ce qui diminue souvent l'exactitude de l'information par rapport aux collectes de données prospectives. En comparaison avec les autres études sur le même suj et, notre étude al' avantage d' avoir une population de plus grande taille et qui soit plus homogène quant au site anatomique de la tumeur, au stade TNM et aux modalités thérapeutiques. Aussi, le suivi prospectif minutieux des patients lors de l'essai clinique ainsi qu'une collecte de données plus exhaustive que la majorité des -études quant aux caractéristiques de base des patients et des issues cliniques est un atout. À notre connaissance, il n'y a aucune autre étude qui a évalué l'association entre l'expression de la COX-2 et la survenue de SCP ou le décès par SCP. Pourtant, il s'agit d'une issue clinique non négligeable dont le taux d'incidence à 5 ans est estimé à environ 18% et auquel on attribue le tiers des décès pour les cancer ORL de stade précoce. De plus, notre étude a comparé plusieurs façons d'évaluer le marquage pour la COX-2, ce qui a permis de détenniner que l'évaluation du pourcentage de cellules tumorales positives pour la COX-2 corrélait davantage avec les issues cliniques que l'intensité du marquage, le patron de marquage ou le marquage stromal. Notre étude a également mesuré le coefficient de corrélation inter-observateur. La statistique Kappa obtenue, soit 0,67, dénote une bonne reproductibilité, ce qui est parfois difficile à obtenir pour l'évaluation de marqueurs immunohistochimiques. Faiblesses de l'étude Le fait que cette étude ait été réalisée auprès de patients tirés d'un essai clinique randomisé dans lequel près de la moitié (49%) d'entre eux ont reçu des suppléments vitaminiques vient ajouter un facteur confondant potentiel dont il a fallu tenir compte lors des analyses statistiques. L'effet de la prise de suppléments vitaminiques sur la COX-2 n'est pas très 66 bien établi. De plus, l'utilisation de l'immunohistochimie est une force parce qu'il s'agit d'une technique simple mais peut également représenter une faiblesse en raison des caractéristiques inhérentes à la technique, soit la difficulté d'interprétation, la reproductibilité variable et le choix de l'anticorps qui reconnaît certains épitopes. Cependant, nous avons considéré toutes ces contraintes dans notre méthodologie afm d'en atténuer les inconvénients. Perspectives d'avenir D'autres études sont nécessaires pour confinner la relation entre la surexpression de la COX-2 et les SCP, ainsi qu'en évaluer les mécanismes d'action. Des études en biologie moléculaire pour quantifier l'expression de l'ARN messager pour COX-2 pourraient également être effectuées afm de vérifier si elle est associée aux issues cliniques pertinentes pour le cancer du larynx glottique. La COX-2 est un marqueur moléculaire prometteur et une cible thérapeutique potentielle dans plusieurs cancers, incluant le cancer du larynx glottique. L'évaluation de l'expression de la COX-2 pourrait peut-être prédire avec plus de précision le pronostic de la tumeur d'un patient en particulier et pennettre d'individualiser le traitement en conséquence. Le marquage immunohistochimique de la COX-2 a le potentiel de pouvoir aider à déterminer quels patients pourront bénéficier d'un traitement adjuvant avec un inhibiteur de la cox. Par contre, des études plus poussées sur le sujet s'imposent avant de pouvoir tirer profit de ces avantages potentiels alléchants. Nous entrons dans l'ère de la thérapie moléculaire ciblée aux caractéristiques individuelles des tumeurs et les inhibiteurs de la cox pourraient bien faire partie de l'arsenal thérapeutique dans plusieurs cancers, dont celui du larynx glottique. Conclusion La surexpression de la COX-2 dans le cancer du larynx glottique de stade précoce traité par radiothérapie est associée à un risque accru de mortalité globale, avec un rapport d'incidence de 1,57 (le à 95%, 1,01-2,45), ainsi qu'à un risque accru de SCP dans les premières années de suivi, avec un rapport d'incidence de 2,63 (IC à 95%, 1,32-5,23). Des études subséquentes sont requises afm de valider ces résultats et d'expliquer les mécanismes par lesquels la surexpression de la COX-2 contribue au développement de SCP. La COX-2 est ' un marqueur immunohistochi~ique et une cible thérapeutique prometteurs dans plusieurs cancers, dont le cancer du larynx de stade précoce traité par radiothérapie. Bibliographie 1. Barnes L, Eveson JW, Reichart PA, SidranskyD. Tumors of the Head and Neck, 1 ed. Who Publications, 2005:1-430. 2. Thompson LDR. Head and Neck Pathology, 1 ed. A Churchill Livingstone Title, 2006:1-640. . 3. Nix PA, Greenman J, Cawkwell L, Stafford N. Radioresistant laryngeal cancer: beyond the TNM stage. Clin.Otolaryngol. 2004;29:105-14. 4. Shaha AR, Shah JP. Carcinoma of the subglottic larynx. Am J Surg 1982;144:456-8. 5. Jin J, Liao Z, Gao L, Huang X, Xu G. Analysis of prognostic factors for T(1)N(0)M(0) glottic cancer treated with definitive radiotherapy alone: experience of the cancer hospital of Peking Union Medical College and the Chinese Academy Of Medical Sciences. Int J Radiat.Oncol.Biol.Phys. 2002;54:471-8. 6. Mendenhall WM, Morris CG, Amdur RJ, Hinerman RW, Mancuso AA. Parameters that predict local control after definitive radiotherapy for squamous cell carcinoma of the head and neck. Head Neck 2003;25:53542. 7. Franchin G, Minatel E, Gobitti C, Talamini R, Vaccher E, Sartor G et al. Radiotherapy for patients with early-stage glottic carcinoma: univariate and 69 multivariate analyses in a group of consecutive, unselected patients. Cancer 2003;98:765-72. 8. Franchin G, Minatel E, Gobitti C, Talamini R, Sartor G, Caruso G et al. Radiation treatment of glottic squamous ce" carcinoma, stage 1 and Il: analysis of factors affecting prognosis. Int J Radiat. Oncol. Biol. Phys. 1998;40:541-8. 9. Colasanto JM, Haffty BG, Wilson LD. Evaluation of local recurrence and second malignancy in patients with T1 and T2 squamous cell carcinoma of the larynx. CancerJ2004;10:61-6. 10. McLaughlin MP, Parsons JT, Fein DA, Stringer SP, Cassisi NJ, Mendenhall WM et al. Salvage surgery after radiotherapy failure in T1-T2 squamous ce" carcinoma of the grottic larynx. Head Neck 1996; 18:229-35. 11. Franchin G, Minatel E, Gobitti C, Talamini R, Vaccher E, Sartor G et al. Radiotherapy for patients with early-stage glottic ca"rcinoma: univariate and multivariate analyses in a group of consecutive, unselected patients. Cancer 2003;98:765-72. 12. Mendenhall WM, Amdur RJ, Morris CG, Hinerman RW. T1-T2NO squamous ce" carcinoma of the glottic larynx treated with radiation therapy. J Clin. Oncol. 2001; 19:4029-36. 70 13. Mendenhall WM, Amdur RJ, Morris CG, Hinerman RW. T1-T2NO squamous cell carcinoma of the glottic larynx treated with radiation therapy. J Clin.Onco/. 2001; 19:4029-36. 14. Thariat J, Bruchon Y, Bonnetain F, Barillot 1, Truc G, Peignaux K et al. Conservative treatment of early glottic carcinomas with exclusive radiotherapy. Cancer Radiofher. 2004;8:288-96. 15. Raitiola H, Wigren T, Pukander J. Radiotherapy outcome and prognostic factors in early glottic carcinoma. Auris Nasus Larynx 2000;27:153-9. 16. Warren S, Gates O. Multiple Primairy Malignant Tumors. A Survey of the Literature and a Statistical Study. Am J Cancer 2004; 16: 1358-414. 17. Hong WK, Lippman SM, Itri LM, Karp DO, Lee JS, Byers RM et al. Prevention of second primary tumors with isotretinoin in squamous-cell carcinoma of the head and neck. N.Engl.J Med. 1990;323:795-801. 18. Lefor AT, Bredenberg CE, Kellman RM, Aust JC. Multiple malignancies of the lung and head and neck. Second primary tumor or metastasis? Arch.Surg 1986;121:265-70. 19. Kumar-Singh S, Vermeulen PB, Weyler J, Seger~ K, Weyn B, Van Daele A et al. Evaluation of tumour angiogenesis as a prognostic marker in malignant mesothelioma. J Pafho/1997; 182:211-6. 71 20. Strong MS, Incze J, Vaughan CW. Field cancerization in the aerodigestive tract--its etiology, manifestation, and significance. J Oto/aryngo/. 1984;13:16. 21. Lin DT, Subbaramaiah K, Shah JP, Dannenberg AJ, Boyle JO. Cyclooxygenase-2: a novel molecular target for the prevention and treatment of head and neck cancer. Head Neck 2002;24:792-9. 22. Vane JR, Bakhle YS, Botting RM. Cyclooxygenases 1 and 2. Annu.Rev.Pharmaco/. Toxico/. 1998;38:97-120. 23. Smith WL, Dewitt DL. Prostaglandin endoperoxide H synthas,es-1 and -2. Adv./mmuno/. 1996;62:167-215. 24. DuBois RN, Abramson SB, Crofford L, Gupta RA, Simon LS, Van De Putte LB et al. Cyclooxygenase in biology and disease. FASEB J 1998;12:106373. 25. Cao Y, Prescott SM. Many actions of cyclooxygenase-2 in cellular dynamics and in cancer. J Cell Physio/2002; 190:279-86. 26. Gallo 0, Masini E, Bianchi B, Bruschini L, Paglierani M, Franchi A. Prognostic significance of cyclooxygenase-2 pathway and angiogenesis in head and neck squamous cell carcinoma. Hum.Patho/2002;33:708-14. 27. Jones MK, Wang H, Peskar SM, Levin E, Itani RM, Sarfeh IJ et al. Inhibition of angiogenesis by nonsteroidal anti-inflammatory drugs: insight into , . - - - - - - - - - -- - - - - - - - - - - 72 mechanisms and implications for cancer growth and ulcer healing. Nat. Med. 1999;5:1418-23. 28. Tsujii M, Kawano S, Tsuji S, Sawaoka H, Hori M, DuBois RN. Cyclooxygenase regulates angiogenesis induced by colon cancer cells. Cell 1998;93:705-16. 29. Gallo 0, Franchi A, Magnelli L, Sardi l, Vannacci A, Boddi V et al. Cyclooxygenase-2 pathway correlates with VEGF expression in head and neck cancer. Implications for tumor angiogenesis and metastasis. Neoplasia. 2001 ;3:53-61. 30. Gallo 0, Fabbroni V, Sardi l, Magnelli L, Boddi V, Franchi A. Correlation between nitric oxide and cyclooxygenase-2 pathways in head and neck squamous cell carcinomas. Biochem.Biophys.Res.Commun. 2002;299:51724. 31. Eberhart CE, Coffey RJ, Radhika A, Giardiello FM, Ferrenbach S, DuBois RN. Up-regulation of cyclooxygenase 2 gene expression in human colorectal adenomas and adenocarcinomas. Gastroenterology 1994; 107: 1183-8. 32. Yamauchi T, Watanabe M, Kubota T, Hasegawa H, Ishii Y, Endo T et al. Cyclooxygenase-2 expression as a new marker for patients with colorectal cancer. Dis. Colon Rectum 2002;45:98-103. 73 33. Soslow RA, Dannenberg AJ, Rush D, Woerner SM, Khan KN, Masferrer J et al. COX-2 is expressed in human pulmonary, colonic, and mammary tumors. Cancer 2000;89:2637-45. 34. Rigas B, Goldman 18, Levine L. Altered eicosanoid levels in human colon cancer. J Lab Clin. Med. 1993;122:518-23. 35. Achiwa H, Yatabe Y, Hida T, Kuroishi T, Kozaki K, Nakamura S et al. Prognostic significance of elevated cyclooxygenase 2 expression in primary, resected lung adenocarcinomas. Clin. Cancer Res. 1999;5: 1001-5. 36. Hida T, Yatabe Y, Achiwa H, Muramatsu H, Kozaki K, Nakamura S et al. Increased expression of cyclooxygenase 2 occurs frequently in human lung cancers, specifically in adenocarcinomas. Cancer Res. 1998;58:3761-4. 37. Hwang D, 8collard D, Byrne J, levine E. Expression of cyclooxygenase-1 and cyclooxygenase-2 in human breast cancer. J Nat/.Cancer /nst. 1998;90:455-60. 38. Kim YB, Kim GE, Cho NH, Pyo HR, Shim SJ, Chang SK et al. Overexpression of cyclooxygenase-2 is associated with a poor prognosis in patients with squamous cell carcinoma of the uterine cervix treated with radiation and concurrent chemotherapy. Cancer 2002;95:531-9. 39. Gaffney OK, Holden J, Davis M, Zempolich K, Murphy KJ, Dodson M. Elevated cyclooxygenase-2 expression correlates with diminished survival in - -- - - - - - - - - - - -- --------~---------------' 74 carcinoma of the cervix treated with radiotherapy. Int J Radiat. On col. Biol. Phys. 2001 ;49: 1213-7. 40. Shiota G, Okubo M, Noumi T, Noguchi N, Oyama K, Takano Y et al. Cyclooxygenase-2 expression in hepatocellular carcinoma. Hepatogastroenterology 1999;46:407-12. 41. Bae SH, Jung ES, Park YM, Kim BS, Kim BK, Kim DG et al. Expression of cyclooxygenase-2 (COX-2) in hepatocellular carcinoma and growth inhibition of hepatoma cell lines by a COX-2 inhibitor, NS-398. Clin. Cancer . Res. 2001 ;7:1410-8. 42. Lee LM, Pan CC, Cheng CJ, Chi CW, Liu TY. Expression of cyclooxygenase-2 in prostate adenocarcinoma and benign prostatic hyperplasia. Anticancer Res. 2001 ;21 :1291-4. 43. Buskens CJ, Van Rees BP, Sivula A, Reitsma JB, Haglund C, Bosma PJ et al. Prognostic significanceof elevated cyclooxygenàse 2 expression in patients with adenocarcinoma of the esophagus. Gastroenterology 2002; 122: 1800-7. 44. Okami J, Yamamoto H, Fujiwara Y, Tsujie M, Kondo M, Noura S et al. Overexpression of cyclooxygenase-2 in carcinoma of the pancreas. Clin. Cancer Res. 1999;5:2018-24. 75 45. Murata H, Kawano S, Tsuji S, Tsuji M, Sawaoka H, Kimura Y et al. Cyclooxygenase-2 overexpression enhances Iymphatic invasion and metastasis in human gastric carcinoma. Am J Gastroenterol. 1999;94:451-5. 46. Ristimaki A, Honkanen N, Jankala H, Sipponen P, Harkonen M. Expression of cyclooxygenase-2 in human gastric carcinoma. Cancer Res. 1997;57: 1276-80. 47. Khuri· FR, Wu H, Lee JJ, Kemp BL, Lotan R, Lippman SM et al. Cyclooxygenase-2 overexpression is a marker of poor prognosis in stage 1 . non-small ceillung cancer. Clin. Cancer Res. 2001;7:861-7. 48. Tsujii M, Kawano S, DuBois RN. Cyclooxygenase-2 expression in human colon cancer cells increases metastatic potential. Proc.Natl Acad.Sci.U.S.A 1997;94:3336-40. 49. Gaffney OK, Holden J, Zempolich K, Murphy KJ, Dicker AP, Dodson M. Elevated COX-2 expression in cervical carcinoma: reduced cause-specifie survival and pelvic control. Am J Clin. On col. 2001 ;24:443-6. 50. Chan G, Boyle JO, Yang EK, Zhang F, Sacks PG, Shah JP et al. Cyclooxygenase-2 expression is up-regulated in squamous cell carcinoma of the head and neck. Cancer Res. 1999;59:991-4. 51. Peng JP, Su CY, Chang HC, Chai CY, Hung WC. Overexpression of cyclooxygenase 2 in squamous cell carcinoma of the hypopharynx. Hum Pathol 2002;33:100-4. 76 52. Mestre JR, Chan G, Zhang F, Yang EK, Sacks PG, Boyle JO et al. Inhibition of cyclooxygenase-2 expression. An approach to preventing head and neck cancer. Ann.N. Y.Acad.Sci. 1999;889:62-71. 53. Renkonen J, Wolff H, Paavonen T. Expression of cyclo-oxygenase-2 in human tangue carcinoma and its precursor lesions. Virchows Arch. 2002;440:594-7. 54. Jaeckel EC, Raja S, Tan J, Das SK, Dey SK, Girod DA et al. Correlation of expression of cyclooxygenase-2, vascular endothelial growth factor, and peroxisome proliferator-activated receptor delta with head and neck a squamous cell carcinoma. Arch. tola ryngol. Head Neck Surg 2001 ; 127: 1253-9. 55. Chang BW, Kim OH, Kowalski OP, Burleson JA, Son YH, Wilson LD et al. Prognostic significance of cyclooxygenase-2 in oropharyngeal squamous cell carcinoma. Clin. Cancer Res. 2004; 10: 1678-84 .. 56. Cho El, Kowalski OP, Sasaki CT, Haffty BG. Tissue microarray analysis reveals prognostic significance of COX-2 expression for local relapse in T12NO larynx cancer treated with primary radiation therapy. Laryngoscope 2004;114:2001-8. 57. Terakado N, Shintani S, Yano J, Chunnan L, Mihara M, Nakashiro K et al. Overexpression of cyclooxygenase-2 is associated with radioresistance in oral squamous cell carcinoma. Oral On col. 2004;40:383-9. 77 58. Atula T, Hedstrom J, Ristimaki A, Finne P, Leivo l, Markkanen-Leppanen M et al. Cyclooxygenase-2 expression in squamous cell carcinoma of the oral cavity and pharynx: association to p53 and clinical outcome. Oncol Rep. 2006; 16:485-90. 59. Terakado N, Shintani S, Yano J, Chunnan L, Mihara M, Nakashiro K et al. Overexpression of cyclooxygenase-2 is associated with radioresistance in oral squamous cell carcinoma. Ora/Oncol. 2004;40:383-9. 60. Nix P, Lind M, Greenman J, Stafford N, Cawkwell L. Expression of Cox-2 protein in radioresistant laryngeal cancer. Ann.Oncol. 2004; 15:797-801. 61. Ranelletti FO, Almadori G, Rocca 8, Ferrandina G, Ciabattoni G, Habib A et al. Prognostic significance of cyclooxygenase-2 in laryngeal squamous cell carcinoma. Int J Cancer 2001 ;%20;95:343-9. 62. 8ayazit VA, Buyukberber S, Sari l, Camci C, Ozer E, Sevinc A et al. Cyclooxygenase 2 expression in laryngeal squamous cell carcinoma and its . clinical correlates. ORL J Otorhinolaryngol.Relat Spec. 2004;66:65-9. 63. Milas L. Cyclooxygenase-2 (COX-2) enzyme inhibitors as potential enhancers of tumor radioresponse. ·Semin.Radiat.Oncol. 2001 ;11 :290-9. 64. Milas L, Mason KA, Crane CH, Liao Z, Masferrer J. Improvement of radiotherapy or chemoradiotherapy by targeting COX-2 enzyme. Oncology (Huntingt) 2003; 17: 15-24. 78 65. Choy H, Milas L. Enhancing radiotherapy with cyclooxygenase-2 enzyme inhibitors: a rational advance? J Nat/.Cancer /nst. 2003;95:1440-52. 66. Raju U, Nakata E, Yang P, Newman RA, Ang KK, Milas L. In vitro enhancement of tumor cell radiosensitivity by a selective inhibitor of cyclooxygenase-2 enzyme: mechanistic considerations. /nt J Radiat.Onco/ Bio/.Phys. 2002;54:886-94. 67. Amirghahari N, Harrison L, Smith M, Rong X, Naumann l, Ampil F et al. NS 398 radiosensitizes an HNSCC ceilline by possibly inhibiting radiationinduced expression of COX-2. /nt J Radiat.Onco/.Bio/.Phys. 2003;57:140512. 68. Hashitani S, Urade M, Nishimura N, Maeda T, Takaoka K, Noguchi K et al. Apoptosis induction and enhancement .of cytotoxicity of anticancer drugs by celecoxib, a selective cyclooxygenase-2 inhibitor, in human head and neck carcinoma ceillines. /nt J Onco/2003;23:665-72. 69. Leahy KM, Ornberg RL, Wang Y, Zweifel BS, Koki AT, Masferrer JL. Cyclooxygenase-2 inhibition by celecoxib reduces proliferation and induces apoptosis in angiogenic endothelial cells in vivo. Cancer Res 2002;62:62531. 70. Masferrer JL, Leahy KM, Koki AT, Zweifel BS, Settle SL, Woerner BM et al. Antiangiogenic and antitumor activities of cyclooxygenase-2 inhibitors . . Cancer Res. 2000;60:1306-11. 79 71. Dicker AP, Williams TL, Grant DS. Targeting angiogenic processes by combination rofecoxib and ionizing radiation. Am J Clin Onco/2001 ;24:43842. 72. Hsu AL, Ching TT, Wang DS, Song X, Rangnekar VM, Chen CS. The cyclooxygenase-2 inhibitor celecoxib in~uces apoptosis by blocking Akt activation in human prostate cancer cells independently of Bcl-2. J Biol. Chem 2000;275: 11397-403. 73. Milas L, Hanson WR. Eicosanoids and radiation. Eur.J Cancer 1995;31A: 1580-5. 74. Nishimura G, Yanoma S, Mizuno H, Kawakami K, Tsukuda M. A selective cyclooxygenase-2 inhibitor suppresses tumor growth in nude mouse xenografted with human head and neck squamous carcinoma cells. Jpn.J Cancer Res. 1999;90: 1152-62. 75. Jacoby RF, Seibert,K, Cole CE, Kelloff G, Lubet RA'. The cyclooxygenase-2 inhibitor celecoxib is a patent preventive and therapeutic agent in the min mouse model of adenomatous polyposis. Cancer Res. 2000;60:5040-4. 76. Gee, J., Lee, 1., Fischer, S., Grossman, B., and Sabichi, A. COX-2 selective inhibitor celecoxib induces growth inhibition and apoptosis in bladder carcinoma. Proceedings of the American Association for Cancer Research 43, 643. 2002. Ref Type: Generic 80 77. Liu W, Chen Y, Wang W, Keng P, Finkelstein J, Hu D et al. Combination of radiation and celebrex (celecoxib) reduce mammary and lung tumor growth. Am J Clin.Onco/. 2003;26:S103-S109. 78. Teicher, B., Bump, E., Palayoor, S., Northey, D., and Coleman, N. Signal Transduction Inhibitors as Modifiers of Radiation Therapy in Human Prostate Carcinoma Xenografts. Radiat.Oncol.lnvestig. 4,221-230. 1996. Ref Type: Generic 79. Milas L, Kishi K, Hunter N, Mason K, Masferrer JL, Tofilon PJ. Enhancement of tumor response to gamma-radiation by an inhibitor of cyclooxygenase-2 enzyme. J Nat/.Cancer /nst. 1999;91 :1501-4. 80. Kishi K, Petersen S, Petersen C, Hunter N, Mason K, Masferrer JL et al. Preferential enhancement of tumor radioresponse by a cyclooxygenase-2 inhibitor. Cancer Res. 2000;60: 1326-31. 81. Davis TW, Hunter N, Trifan OC, Milas L, Masferrer JL. COX-2 inhibitors as radiosensitizing agents for cancer therapy. Am J Clin Onco/2003;26:S58S61. 82. SChrei,nemachers DM, Everson RB. Aspirin use and lung, colon, and breast cancer incidence in a prospective study. Epidemi%gy 1994;5:138-46. 83. Steinbach G, Lyn,ch PM, Phillips RK, Wallace MH, Hawk E, Gordon GB et al. The effect of celecoxib, a cyclooxygenase-2 inhibitor, in familial adenomatous polyposis. N.Eng/.J Med. 2000;342:1946-52. 81 84. Weppelmann B, Monkemeier D. The influence of prostaglandin antagonists on radiation therapy of carcinoma of the cervix. Gynecol.Oncol. 1984; 17: 196-9. 85. Umar A, Viner JL, Anderson WF, Hawk ET. Development of COX inhibitors in cancer prevention and therapy. Am J Clin Onco/2003;26:S48-S57. 86. Pruthi RS, Derksen JE, Moore D. A pilot study of use of the cyclooxygenase-2 inhibitor celecoxib in recurrent prostate cancer after definitive radiation therapy or radical prostatectomy. BJU.lnt 2004;93:275-8. 87. Lin, E., Morris, J., Chau, N., Crane, C., Wolff, R., Janjan, N., Xiong, H., Delcos, M., and Abbruzzese, J. Celecoxib aUenuated capecitabine induced hand-and-foot syndrome (HFS) and diarrhea and improved time to tumor progression in metastatic colorectal cancer (MCRC). Proceedings of ASCO 21, 138b. 2002. Ref Type: Generic 88. Pelzmann M, Thurnher D, Gedlicka C, Martinek H, Knerer B. Nimesulide and indomethacin induce apoptosis in head and neck cancer cells. " Oral Pathol Med2004;33:607-13. 89. Chen Z, Zhang X, Li M, Wang Z, Wieand HS, Grandis JR et al. Simultaneously targeting epidermal growth factor receptor tyrosine kinase and cyclooxygenase-2, an efficient approach to inhibition of squamous cell carcinoma of the head and neck. Clin. Cancer Res. 2004; 10:5930-9. 82 90. Shiotani H, Denda A, Yamamoto K, Kita"yama W, Endoh T, Sasaki Y et al. Increased expression "of cyclooxygenase-2 protein in 4-nitroquinoline-1oxide-induced rat tongue carcinomas and chemopreventive efficacy of a specifie inhibitor, nimesulidè. Cancer Res. 2001 ;61 :1451-6. 91. Tanaka T, Nishikawa A, Mori Y, Morishita Y, Mori H. Inhibitory effects of non-steroidal anti-inflammatory drugs, piroxicam an"d indomethacin on 4nitroquinoline 1-oxide-induced tongue carcinogenesis in male ACI/N rats. Cancer Lett. 1989;48: 177-82. 92. Nishimura N, Urade M, Hashitani S, Noguchi K, Manno Y, Takaoka K et al. Increased expression of cyclooxygenase (COX)-2 in DMBA-induced hamster cheek pouch carcinogenesis and chemopreventive effect of a selective COX-2 inhibitor celecoxib. J Oral Pathol Med 2004;33:614-21. 93. Wang l, Fuentes CF, Shapshay SM. Antiangiogenic and chemopreventive activities of celecoxib in oral carcinoma cell. LaryngÇJscope 2002;112:83943. 94. Davis TW, O'Neal JM, Pagel MD, lweifel BS, Mehta PP, Heuvelman DM et al. Synergy between celecoxib and radiotherapy results from inhibition of cyclooxygenase-2-derived prostaglandin E2, a survival factor for tumor and associated vasculature. Cancer Res. 2004;64:279-85. 95. lweifel, B., Ornberg, R., Woerner, M., Koki, A., Masferrer, J., Dannenberg, A., and Boyle, J. Inhibition of prostaglandins by Celecoxib results in . 83 suppressio.n of tumor growth and reduces VEGF levels in human head and neck xenograft model. Proceedings of the American Association for Cancer Research 43,77.2002. Ref Type: Generic 96. Panje WR. Regression of head and neck carcinoma with a prostaglandinsynthesis inhibitor. Arch. otola ryngol. 1981; 107:658-63. 97. Hirsch B, Johnson JT, Rabin BS, Thearle PB. Immunostimulation of patients with head and neck cancer. In vitro and preliminary clinical experiences. Arch Otolaryngol. 1983; 109:298-301. . 98. Steinauer KK, Gibbs l, Ning S, French JN, Armstrong J, Knox SJ. Radiation induces upregulation of cyclooxygenase-2 (COX-2) protein in PC-3 cells. Int J Ra dia t. Oncol. Biol. Phys. 2000;48:325-8. 99. Petersen C, Petersen S, Milas L, Lang FF, Tofilon PJ. Enhancement of intrinsic tumor cell radiosensitivity induced by a selective cyclooxygenase-2 inhibitor. Clin. Cancer Res. 2000;6:2513-20. 100. Pillsbury HC, III, Webster WP, Rosenman J. Prostaglandin inhibitor and radiotherapy in advanced head and neck cancers. Arch. otola ryngol. Head Neck Surg 1986;112:552-3. 101. Bairati l, Brochet F, Roy J, Gelinas M, Nabid A, Tetu B et al. Prévention des seconds cancers primaries par supplementation vitaminique chez les patients traits pour un cancer ORL. Bull. Cancer Radiother. 1996;83: 12-6. 84 102. Beahrs OH, Earl Henson D, Hutter RVP, Kennedy BJ. American Joint Committee on Cancer. Manual for staging of cancer. Philadelphia: JB Lippincott Company, 1992:27-44. 103. Carvalho AL, Nishimoto IN, Califano JA, Kowalski LP. Trends in incidence and prognosis for head and neck cancer in the United States: a site-specifie analysis of the SEER database.lntJ Cancer2005;114:806-16. 104. Karnofsky DA, Burchenal JH. The Clinical Evaluation of Chemotherapeutic Agents in Cancer. In: MacLoed CM. Evaluation of Cheniotherapeutic Agents. New York: Columbia Press, 1949:191-205. 105. Cox J.D, Stetz J, Pajak TF. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC). Int J Radiat.Oncol.Biol.Phys. 1995;31 :13416. 106. WHO Handbook for Reporting Results of Cancer Treatment. Geneva: World Health Organisation, 1979:1-45. 107. Kaplan EL, Meier P. Nonparametric Estimation from Incomplet Observations. Am Stat Assoc J 1958;53:457-81. 108. Kalbfleish JO, Prentice RL. The Stastical Analysis of Failure Time Data. New York: Wiley, 1980. 109. Cox DR, Oakes D. Analysis of Survival Data. London: Chapman and Hall, 1984. 85 110. Piccirillo JF, Spitznagel EL, Jr., Vermani N, Costas l, Schnitzler M. Comparison of comorbidity indices for patients with head and neck cancer. Med Care 2004;42:482-6. 111. Cooper JS, Pajak TF, Rubin P, Tupchong L, Brady LW, Leibel SA et al. Second malignancies in patients who have head and neck cancer: incidence, effect on survival and implications based on the RTOG experience. Int J Radiat. Oncol Biol.Phys. 1989; 17:449-56. 112. Gao X, Fisher SG, Mohideen N, Emami B. Second primary cancers in patients with laryngeal cancer: a population-based study. Int J Radiat.Oncol Biol.Phys. 2003;56:427-35. 113. Siaughter OP, Southwick HW, Smejkal W. Field cancerization in oral stratifiedsquamous epithelium; clinical implications of multicentric origin. Cancer 1953;6:963-8. 114. O'Connor JK, Avent J, Lee RJ, Fischbach J, Gaffney DK. Cyclooxygenase-2 expression correlates with diminished survival in invasive breast cancer treated with mastectomy and radioth,erapy. Int J Radiat.Oncol.Biol.Phys. 2004;58: 1034-40. 115. Bairati l, Meyer F, Gelinas M, Fortin A, Nabid A, Brochet F et al. A randomized trial of antioxidant vitamins to prevent second primary cancers · in head and neck cancer patients. J Natl Cancer Inst 2005;97:481-8. 86 116. Bairati l, Meyer F, Jobin E, Gelinas M, Fortin A, Nabid A et al. Antioxidant vitamins supplementation and mortality: a randomized trial in head and neck cancer patients. Int J Cancer 2006; 119:2221-4. 117. Moraitis D, Du B, De Lorenzo MS, Boyle JO, Weksler BB, Cohen EG et al. Levels of cyclooxygenase-2 are increased in the oral mucosa of smokers: evidence for the role of epidermal growth factor receptor and its ligands. Cancer Res. 2005;65:664-70. 118. Sudbo J, Ristimaki A, Sondresen JE, Kildal W, Boysen M, Koppang HS et al. Cyclooxygenase-2 (COX-2) expression in-high-risk premalignant oral lesions. OralOncol. 2003;39:497-505. 119. Braakhuis BJ, Tabor MP, Kummer JA, Leemans CR, Brakenhoff RH. A genetic explanation of SI,aughter's concept of ~ield cancerization: evidence and clinical implications. Cancer Res. 2003;63: 1727-30. 120. Pelucchi C, Gallus S, Garavello W, 80setti C, La Vècchia C. Cancer risk associated with alcohol and tobacco use: focus on upper aero-digestive tract and liver. Alcohol Res. Health 2006;29:193-8. 121. Talamini R, Bosetti C, La Vecchia C, Dai Maso L, Levi F, 8idoli E et al. Combined effect of tobacco and alcohol on laryngeal cancer rfsk: a casecontrol study. Cancer Causes Contro/2002;13:957-64. 87 122. Dikshit RP, Boffetla P, Bouchardy C, Merletti F, Crosignani P, Cuchi T et al. Risk factors for the development of second primary tumors among men after laryngeal and hypopharyngeal carcinoma. Cancer 2005; 103:2326-33. 123. Day GL, Blot WJ, Shore RE, McLaughlin JK, Austin OF, Greenberg RS et al. Second cancers following oral and pharyngeal cancers: role of tobacco and alcohol. J.Natl.Cancer Inst. 1994;86:131-7. 124. Choe MS, Zhang X, Shin HJ, Shin DM, Chen ZG. Interaction between epidermal growth factor receptor- and cyclooxygenase 2-mediated pathways and its implications for the chemoprevention of head and neck cancer. Mol. Cancer Ther. 2005;4:1448-55.