Téléchargez le PDF - Revue Médicale Suisse

M. Chargui
I. Uçkay
D. Suvà
P. Christofilopoulos
A. Lomessy
D. Pittet
introduction
Les microorganismes peuvent entraîner des infections cuta-
nées et des tissus mous en cas de brèche cutanée due à une
lésion traumatique ou à une macération. La plupart du temps, ces infections res-
tent superficielles et sans gravité.1 Toutefois, dans une minorité des cas, ces infec-
tions gagnent les tissus mous en profondeur et peuvent mettre en danger la vie
des malades. Cet article résume la microbiologie et la prise en charge de ces infec-
tions profondes et souligne l’importance d’une collaboration multidisciplinaire.2
microbiologie
Les deux germes principalement impliqués dans les infections profondes des
tissus mous sont
Streptococcus pyogenes
(avec d’autres streptocoques bêta-hémoly-
tiques) et
Staphylococcus aureus
.
S. aureus
provient souvent d’une colonisation cutanée
chronique chez environ 15-20% des patients, tandis que
S. pyogenes
est pratiquement
toujours acquis par l’environnement par des brèches cutanées microscopiques.
La microbiologie des infections sévères des parties molles n’a pas significative-
ment changé durant les dernières décennies 3 à l’exception de trois principales
tendances : le SARM (
S. aureus
résistant à la méthicilline) communautaire provo que
un nombre croissant d’infections sévères dans certaines régions du monde, mais
pas (encore) en Suisse ; les infections sévères à
Acinetobacter
spp sont typiques
suite à des blessures de guerre et des catastrophes naturelles dans les régions
arides de l’Afrique du Nord et du Moyen Orient ;4 et enfin les tsunamis et d’autres
catastrophes naturelles ont augmenté le potentiel de certains microorganismes
atypiques à entraîner des infections des tissus mous chez les patients rapatriés
(mycobactéries,
Aeromonas
spp,
Vibrio
spp, ou
Pseudomonas
spp).4
présentation clinique et diagnostic
Le diagnostic des infections profondes des parties molles est essentiellement
clinique. A cela s’ajoutent les examens complémentaires radiologiques et de labo-
Deep soft tissue infections
The clinical presentations of deep soft tissue
infections can, initially, mimicry superficial skin
infections such as erysipelas. However, a rapi-
dly deteriorating health status, the spreading
of the lesions and the lack of clear visual limi-
tation of the infection on the skin are hall-
marks of a more severe underlying infection,
which may endanger patients’ life. An imme-
diate adequate multidisciplinary approach
to therapy within a few hours is mandatory.
The first step is surgical exploration with debri-
dement of all infected tissues, accompanied
by antibiotic therapy and additional suppor-
tive measures. Despite progress in the under-
standing of the physiopathology, the delay
between suspicion of diagnosis and surgical
exploration remains critical. Because of the
low incidence of such severe infections, only
multicenter studies might reveal deeper in-
sights of optimal therapeutic strategies in the
future and for possible improved patients’
survival.
Rev Med Suisse 2014 ; 10 : 920-4
La présentation clinique des infections profondes des tissus
mous peut initialement mimer une infection plus bénigne telle
qu’un érysipèle. Toutefois, l’état général du patient, la progres-
sion des lésions et leur mauvaise délimitation sont fortement
évocateurs d’une atteinte gravissime, mettant en danger la vie
du patient si une prise en charge adéquate, multidisciplinaire,
n’est pas instaurée dans les quelques heures. Le traitement
initial est chirurgical, comporte un débridement large des tis-
sus contaminés, et est associé à une prise en charge antibio-
tique et de soutien. Le délai entre l’admission du patient et la
prise en charge opératoire conditionne la mortalité qui reste
à ce jour encore très élevée. En raison de la faible incidence
de ces affections, seules des études multicentriques permet-
tront à l’avenir de mettre au point de nouvelles stratégies afin
d’améliorer la prise en charge et la survie des patients.
Infections profondes
des tissus mous
le point sur…
920 Revue Médicale Suisse
–
www.revmed.ch
–
23 avril 2014
24_28_37856.indd 1 16.04.14 07:04

Revue Médicale Suisse
–
www.revmed.ch
–
23 avril 2014 921
ratoire.
In fine
, une exploration chirurgicale avec débride-
ment, lavage, et biopsies tissulaires permet très souvent
de confirmer le diagnostic initial.
Les examens paracliniques confirment l’inflammation et
peuvent être utiles au suivi des patients. Contrairement au
sentiment habituellement véhiculé, le portage cutané posi-
tif du SARM hospitalier est faiblement corrélé à la patho-
génie de l’infection cutanée sous-jacente 5 et les patients
traités par antibiotiques avant l’hospitalisation peuvent ré-
véler des résultats négatifs. La sérologie est d’importance
moindre : seule la sérologie permettant de titrer les anti-
corps antistreptolysine-O peut confirmer l’infection par un
streptocoque bêta-hémolytique des groupes A, C et G.6 Les
examens radiologiques (CT-scan, IRM) détectent les col-
lections liquidiennes, un abcès, ou une fascéite.7 L’histo-
logie est indiquée dans toute infection sévère comme aide
au diag nostic, en particulier dans les cas de fascéite nécro-
sante.8
Classification
Il est important d’avoir à l’esprit que le même agent pa-
thogène peut provoquer des tableaux cliniques différents.
Par exemple,
S. pyogenes
peut être responsable d’érysipèle
avec une infection des couches superficielles de la peau
ou diffuser dans les tissus profonds et entraîner des fas-
céites, voire des myosites. De même,
S. aureus
peut provo-
quer des abcès localisés ou évoluer vers une bactériémie
sans extension locale alors que certains streptocoques bêta-
hémolytiques tels que
S. pyogenes
ont tendance à s’étendre
dans les tissus mous et les fascias via des facteurs de viru-
lence spécifiques comme la hyaluronidase. En raison de la
diversité des tableaux cliniques, une classification des in-
fections profondes des tissus mous, basée uniquement sur
la microbiologie, peut prêter à confusion. C’est pourquoi ces
infections sont habituellement classées d’après les struc-
tures anatomiques touchées par le processus infectieux. Par-
mi les infections profondes, deux entités sont particulière-
ment redoutables et seront abordées ci-dessous : il s’agit
des fascéites nécrosantes et des myosites.
fascéites nécrosantes et myosites
Ces deux entités affectent la plupart du temps les per-
sonnes immunodéprimées,9 mais parfois également de
jeunes patients et en bonne santé. Le début des symp-
tômes est souvent brutal. La fascéite nécrosante débute
comme un érysipèle qui ne répond pas aux antibiotiques
et qui s’étend rapidement sous l’action des enzymes et des
toxines bactériennes, entraînant nécrose et liquéfaction des
tissus avoisinants.9 Il y a souvent une disproportion entre
l’aspect externe des lésions érythémateuses et l’intensité
des douleurs. La fièvre et les crépitations sont rares à l’ad-
mission. D’un point de vue physiopathologique, et contrai-
rement à l’érysipèle, la fascéite nécrosante est une maladie
systémique, résultant d’une atteinte du
fascia superficialis
, et
non pas des fascias musculaires. Le
fascia superficialis
est une
structure mal définie, localisée dans le tissu sous-cutané. Les
microthrombi8 et les troubles de la circulation sanguine
sont à l’origine d’une gangrène profonde. Des lésions bul-
leuses peuvent se former et les lésions tardives peuvent
ressembler aux brûlures profondes . Dans les formes non
traitées, il y a une extension rapide au tissu entourant la
zone infectée qui s’associe souvent à une bactériémie avec
défaillance multiviscérale aboutissant au décès. La morta-
lité est comprise entre 20 et 30% bien que des mortalités
plus faibles de 15-20% aient été rapportées (tableau 1).10
Selon l’agent pathogène en cause, on distingue deux types
de fascéites nécrosantes.9 Le type I correspond aux infec-
tions multibactériennes (chez les sujets immunodéprimés).
Les infections de type II sont causées par
S. pyogenes
et sont
rapidement progressives, y compris chez les patients en
bonne santé. Toutefois, il n’y a pas de différence de mor-
bidité, de mortalité ou de prise en charge entre ces deux
types d’infection. L’atteinte des organes génitaux est appe-
lée gangrène de Fournier.
Les fascéites atteignent souvent les muscles. Ainsi, la
plupart des fascéites nécrosantes sont, anatomiquement
parlant, des fasciomyosites bien que des myosites isolées
puissent également survenir. L’augmentation du taux san-
guin de la créatinine phosphokinase suggère une partici-
pation musculaire. L’infection bactérienne des muscles par
Clostridium perfringens
ou par
C. septicum
est souvent appe-
lée «gangrène gazeuse» du fait des crépitations. Cette forme
est rare de nos jours, car les facteurs prédisposants sont
les plaies contaminées par des germes anaérobies (plaies
de guerre ou plaies sur catastrophe naturelle non traitées).
Maladie produite par une toxine
Enfin, outre le tableau local, tant
S. aureus
que les strep-
tocoques bêta-hémolytiques peuvent entraîner un sepsis
par la production de superantigènes et de toxines.11 Ces
situations sont appelées syndrome de choc toxique sta-
phylococcique ou streptococcique et sont marquées par
l’apparition d’un choc septique.
traitement médico-chirurgical
En règle générale, seules les infections cutanées super-
ficielles, les érysipèles et les cellulites sont traitées par les
antibiotiques seulement, tandis que les fascéites et les
myosites représentent des urgences chirurgicales devant
être prises en charge dans les quelques heures suivant l’hos-
pitalisation du patient. Le traitement chirurgical est com-
plété par une antibiothérapie.2 Dans certains cas d’infec-
tions profondes des tissus mous, en l’absence de sepsis ou
Dermohypodermite Fascéite nécrosante
• Hémodynamiquement stable • Sepsis
• Mortalité l1% • Mortalité 15-25%
• Hémocultures positives 2% • Hémocultures positives 30%
• Jusqu’à 100/100 000 par année • l 1/100 000 par année
• Erythème homogène avec bords • Erythème inhomogène,
bien délimités nécroses, phlyctènes
• Porte d’entrée mycoses interdigitales • Traumatique ou inconnu
• Comorbidités fréquentes • Souvent bonne santé
(diabète, lymphœdèmes) habituelle
Tableau 1. Différences cliniques potentielles entre
une infection cutanée ou des tissus mous superfi-
cielle et une infection profonde de type fascéite
24_28_37856.indd 2 16.04.14 07:04

de collections, une attitude conservatrice médicale peut être
envisagée seule et avec succès.
Traitement chirurgical
Le traitement chirurgical consiste en une excision large
des tissus lésés.9,12 Au status opératoire, les tissus mous
infectés sont grisâtres, saignent peu, et ne résistent pas à
une dissection manuelle. La totalité du tissu atteint, décollé
par une pression minime ou par un simple passage de doigt
doit être débridée (figure 1).9,12 De nombreuses études
ont démontré l’importance de l’étendue du premier débri-
dement.9 Une reprise à 48 heures d’intervalle jusqu’à sta-
bilisation des lésions est recommandée. Dans les cas ex-
trêmes, si l’atteinte est localisée aux extrémités, une ampu-
tation peut être considérée comme un geste de sauvetage.
Quand l’infection est stoppée et tout le tissu nécrotique
débridé, la fermeture de la plaie nécessitera un recours à
des greffes de peau, ou des lambeaux musculo-cutanés.
L’utilisation d’un système VAC est courante, et permet de
favoriser le développement de tissu de granulation en main-
tenant les tissus dans des conditions hypoxiques et en dé-
pression.13
Traitement médical
Les agents antimicrobiens représentent l’arsenal théra-
peutique fondé sur des preuves d’expériences cliniques
lors du traitement des fascéites, des myosites, des cellulites
et des érysipèles. Les immunoglobulines et l’oxygénothé-
rapie hyperbare ont un rôle de soutien.
Dans la réalité quotidienne, l’antibiothérapie empirique
initiale comprend souvent une carbapénème ou d’autres
antibiotiques à large spectre (souvent avec la vancomycine
en plus) en attendant les résultats des cultures, ceci afin
d’éviter le plus possible une évolution potentiellement lé-
tale. Les streptocoques bêta-hémolytiques et
C. perfringens
sont sensibles à la pénicilline. En Suisse, et contrairement
au continent nord-américain,
S. aureus
(communautaire) est
généralement sensible aux céphalosporines de première
et de deuxième générations et à l’amoxicilline/acide clavu-
lanique. Ainsi, même lors des infections polymicrobiennes,
ces pathogènes dangereux restent largement couverts par
les céphalosporines et l’amoxicilline/acide clavulanique. Il
n’est donc pas nécessaire de couvrir plus large en dehors
des situations d’éventuelles allergies et du contexte d’in-
fections nosocomiales. Selon la littérature et partant d’ex-
périences personnelles, la plupart des couvertures initiales
par de larges spectres se sont avérées rétrospectivement
de trop et les antibiotiques auraient pu être restreints aux
pénicillines ou aux céphalosporines (tableau 2). La durée
de l’antibiothérapie chez les patients ayant été victimes de
choc septique dépend de la présence de localisation se-
condaire et de l’évolution de ces patients. Concernant les
infections non bactériémiques de la peau et des tissus
mous, la littérature manque de preuve quant à la durée de
l’antibiothérapie.5 C’est fréquemment l’évolution clinique,
la pré sence de micro-abcès non drainés et l’expérience du
médecin qui déterminent la durée de l’antibiothérapie.
Pour les fascéites, les myosites ainsi que les syndromes
de choc dus aux superantigènes et à la production de toxine,
la clindamycine dosée à 600 mg toutes les six heures (ou
900 mg toutes les huit heures), et administrée par voie in-
traveineuse, est souvent associée pour une durée de trois
à cinq jours11 même si l’agent pathogène est résistant à
cette molécule (tableau 2). Cet anti biotique inhibe en effet
la production de toxine,11 du moins in vitro. In vivo, une
seule étude observationnelle s’est intéressée au bénéfice
clinique d’associer la clindamycine et a rapporté des résul-
tats positifs, avec cependant un intervalle de confiance large
(analyse univariée ; odds ratio 4,7 ; IC 95% : 1,0-25,0), témoi-
gnant de l’incertitude persistante sur cette question.11
L’administration intraveineuse d’immunoglobulines est
régulièrement discutée comme une thérapie de soutien
aux antibiotiques. De nos jours, leur rôle réside en l’activa-
tion du complément, la promotion de cytotoxicité à média-
tion cellulaire dépendante des anticorps, la réduction de
l’interleukine 6 et du TNF-alpha11 et l’inhibition des supe-
rantigènes. Les données cliniques proviennent de plusieurs
articles sur des études conduites in vitro et d’au minimum
cinq articles relatant des études in vivo, publiées par le
même groupe et dans le même journal scientifique.14 Ce
groupe a publié les meilleures données disponibles en 2003
suite à un essai européen randomisé, mené en double aveu-
gle et comparé à un placebo chez des patients présentant
922 Revue Médicale Suisse
–
www.revmed.ch
–
23 avril 2014
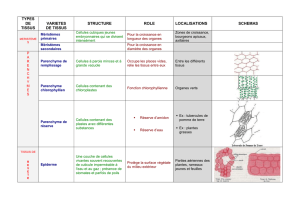
Figure 1. Fascéite nécrosante du bras gauche chez
un patient diabétique
Initialement la lésion cutanée a été uniquement incisée (A). Dans un
deuxième temps, les tissus contaminés ont été excisés (B) permettant
une bonne évolution avec greffe de peau mince (C).
A
B
C
24_28_37856.indd 3 16.04.14 07:04

Revue Médicale Suisse
–
www.revmed.ch
–
23 avril 2014 923
un syndrome de choc toxique. Le critère d’évaluation prin-
cipal était la mortalité après 28 jours. On observait une ten-
dance non significative à une moindre mortalité dans le
groupe traité par des immunoglobulines comparé au pla-
cebo (2/10 vs 4/11).14 L’ajustement pour la mixité des cas ne
pouvait être effectué à cause du nombre réduit de 21 pa-
tients dans cette étude. Les auteurs ont conclu que les im-
munoglobulines seraient bénéfiques à partir de l’ensemble
de données observées.
Les doses recommandées d’immunoglobulines varient
selon les auteurs et au cours du temps. La littérature pro-
pose des doses uniques de 2 g/kg ou une cure de trois jours
en commençant par 1 g/kg le premier jour puis 0,5 g/kg les
deux jours suivants.14 Dans l’ensemble, ces études sont
prometteuses. Cependant d’autres études sont nécessaires
avant d’établir les recommandations strictes con cernant l’uti-
lisation des immunoglobulines, coûteuses et potentielle-
ment nocives, dans le traitement des fascéites nécrosan tes.
A noter que les différentes préparations de mélanges po-
lyspécifiques d’immunoglobulines semblent ne pas avoir
la même efficacité contre les superantigènes streptococ-
ciques et staphylococciques dont la signification clinique
demeure peu claire.
Oxygénothérapie
L’oxygénothérapie hyperbare n’est pas disponi ble dans
tous les centres et son utilité n’est pas scientifiquement
démontrée. Toutefois, les bons résultats obtenus dans des
cas isolés ont permis au Centre for Medicare and Medicaid
Services, aux Etats-Unis d’Amérique, de rembourser cette
thérapie pour les fascéites nécrosantes et les gangrènes
gazeuses. Il en est de même dans beaucoup de pays euro-
péens. Formellement, l’oxygénothérapie hyperbare est
classée de nos jours au niveau de preuve C et à la catégorie
de recommandation IIb.15 Ce traitement reste moins im-
portant que le débridement chirurgical et les antibiotiques
et ne doit en aucun cas retarder l’intervention chirurgicale.
aspects futurs
Le futur apportera, espérons-le, des données solides
pros pectives concernant la gestion des infections sévères
des tissus mous. Du fait de leur faible incidence et de la
grande mixité des cas, des essais multicentriques et multi-
disciplinaires sont nécessaires concernant tous les aspects
des soins, de l’approche dans les suites du débridement
chirurgical jusqu’au rôle et au dosage de la clindamycine et
des immunoglobulines dans la prise en charge précoce de
ces infections.
Infection Principaux pathogènes Choix de l’antibiotique* Remarques**
Cellulite S. pyogenes, S. aureus ; Céphalosporine de 1re génération, • Résistance à la clindamycine possible chez
rarement autres organismes amoxicilline/acide clavulanique, S. pyogenes et S. aureus
clindamycine (en cas d’allergie sévère • Vancomycine si forte suspicion de SARM**
à la pénicilline)
Fascéite nécrosante Type I : mixte. Empiriquement, forte dose amoxicilline/ • Débridement chirurgical essentiellement
Espèces anaérobies, acide clavulanique IV, plus clindamycine IV • Ajouter vancomycine si SARM probable
streptocoques et entérobactéries • Immunoglobulines en cas de danger vital
Myosite Type II : S. pyogenes, S. aureus, Empiriquement, forte dose amoxicilline/ • Ajouter vancomycine si SARM probable
streptocoques bêta-hémolytiques, acide clavulanique IV, plus clindamycine IV • Immunoglobulines en cas de danger vital
rarement C. perfringens
* Dès que l’agent pathogène a été identifié, le choix de l’antibiotique peut être modifié et le spectre rétréci.
** Il faut être conscient de l’endémicité du Staphylococcus aureus résistant à la méthicilline d’origine communautaire ou nosocomiale (SARM). Le cotri-
moxazole ou la clindamycine représentent le choix dans la plupart des infections communautaires mineures, pour tous les autres cas c’est la vancomycine.
Tableau 2. Pathogènes et antibiothérapie présomptive* dans les infections sévères des tissus mous
(Adapté de I. Uçkay, H. Sax, P. Hoffmeyer, D. Lew, D. Pittet. Severe soft-tissue infections. Oh’s Intensive Care. Chapter 63, 2013).
Remerciements
Nous remercions toute l’équipe médico-soignante des Services de
chirurgie orthopédique et de traumatologie de l’appareil moteur et de
prévention et contrôle de l’infection des Hôpitaux Universitaires de
Genève.
Conflit d’intérêts
Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec
cet article.
Implications pratiques
La présentation clinique des infections profondes des tissus
mous peut initialement mimer une infection plus bénigne
telle qu’un érysipèle. Toutefois, l’état général du patient, la
progression des lésions et leur mauvaise délimitation sont
fortement évocateurs d’une atteinte gravissime
Le traitement initial est chirurgical, et comporte un débride-
ment large des tissus contaminés, et ce traitement est asso-
cié à une prise en charge antibiotique et de soutien
En raison de la faible incidence de ces affections, seules des
études multicentriques permettront à l’avenir de mettre au
point de nouvelles stratégies afin d’améliorer la prise en
charge et la survie des patients
>
>
>
24_28_37856.indd 4 16.04.14 07:04

924 Revue Médicale Suisse
–
www.revmed.ch
–
23 avril 2014
Drs Moez Chargui, Domizio Suvà, Panayiotis Christofilo-
poulos, Antoine Lomessy
Service de chirurgie orthopédique et de traumatologie
de l’appareil moteur
Dr Ilker Uçkay
Services de chirurgie orthopédique, des maladies
infectieuses et de prévention et contrôle de l’infection
HUG, 1211 Genève 14
Domizio [email protected]
Pr Didier Pittet
Service des maladies infectieuses et de prévention
et contrôle de l’infection, Centre Collaborateur OMS
pour la Sécurité des Patients
HUG et Faculté de médecine
1211 Genève 14
Adresses
1 ** Blum CL, Menzinger S, Genné D. Erysipèle :
manifestations cliniques et prise en charge. Rev Med
Suisse 2013;9:1812-5.
2 Darbellay P, Uçkay I, Dominguez D, et al. Traitement
du pied diabétique infecté : une approche multidiscipli-
naire par excellence. Rev Med Suisse 2011;7:894-7.
3 Tognetti L, Martinelli C, Berti S, et al. Bacterial skin
and soft tissue infections : Review of the epidemiology,
microbiology, aetiopathogenesis and treatment : A col-
laboration between dermatologists and infectiologists.
J Eur Acad Dermatol Venereol 2012;26:931-41.
4 Uçkay I, Sax H, Harbarth S, et al. Multi-resistant in-
fections in repatriated patients after natural disasters :
Lessons learned from the 2004 tsunami for hospital in-
fection control. J Hosp Infect 2008;68:1-8.
5 Reber A, Moldovan A, Dunkel N, et al. Should the
methicillin-resistant Staphylococcus aureus carriage
status be used as a guide to treatment for skin and soft
tissue infections ? J Infect 2012;64:513-9.
6 Uçkay I, Ferry T, Stern R, et al. Use of serum anti-
streptolysin-O-titers in the microbial diagnosis of or-
thopedic infections. Int J Inf Dis 2009;13:421-4.
7 Kim KT, KimYJ, Lee JW, et al. Can necrotizing in-
fectious fasciitis be differentiated from nonnecrotizing
infectious fasciitis with MR imaging ? Radiology 2011;259:
816-21.
8 * Stamenkovic I, Lew PD. Early recognition of po-
tentially fatal necrotising fasciitis : Use of frozen-section
biopsy. N Engl J Med 1984;310:1689-93.
9 Sarani B, Strong M, Pascual J. Necrotizing fasciitis :
Current concepts and review of the literature. J Am
Coll Surg 2008;208;279-88.
10 Anaya DA, McMahon K, Nathens AB, et al. Predic-
tors of mortality and limb loss in necrotizing soft tissue
infections. Arch Surg 2005;140:151-6.
11 * Kaul R, McGeer A, Norrby-Teglund A, et al.
Intra venous therapy for streptococcal toxic shock syn-
drome – A comparative observational study. Clin In-
fect Dis 1999;28:800-7.
12 Baxter CR. Surgical management of soft tissue in-
fections. Surg Clin North Am 1972;52:1483-99.
13 Öztürk E, Özgüç H, Yılmazlar T. The use of vacuum-
assisted closure therapy in the management of Four-
nier’s gangrene. Am J Surg 2009;197:660-5.
14 ** Darenberg J, Ihendyane N, Sjölin J, et al. Intra-
venous immunoglobulin G therapy in streptococcal
toxic shock syndrome : A European randomized, double-
blind, placebo-controlled trial. Clin Infect Dis 2003;
37:333-40.
15 Weaver LK. Hyperbaric oxygen in the critically ill.
Crit Care Med 2011;39:1784-91.
* à lire
** à lire absolument
Bibliographie
24_28_37856.indd 5 16.04.14 07:04
1
/
5
100%