Le réseau neural de la motivation chez l`homme

Revue thématique : Motivation et sujet âgé
Le réseau neural de la motivation
chez l’homme
RICHARD LÉVY
Fédération de neurologie et
Inserm U 610, Hôpital de la
Salpêtrière, Paris
Tirésàpart:
Résumé. La motivation est un concept psychologique dont le substrat neurobiologique ne
peut être envisagé qu’après un éclatement du concept en opérations pertinentes à l’échelle
biologique. Sont regroupées sous le terme de motivation, les opérations mentales élémen-
taires décodant la valeur affective d’un stimulus (endogène ou exogène) et l’intégrant aux
processus d’élaboration de l’action dans les buts d’assurer le maintien de l’homéostasie, le
bien-être et la survie de l’individu et de l’espèce. Ainsi, en situation expérimentale, les
marqueurs de la motivation sont mis en évidence par la réponse aux situations aversives ou
appétitives. Par conséquent, le réseau cérébral de la motivation concerne surtout le sys-
tème limbique : les noyaux amygdaliens, les cortex préfrontaux orbitaire et ventro-médian
(CPFOM), cingulaire antérieur et le striatum ventral. Au sein de ce réseau, il est possible de
distinguer : des structures telles que le CPFOM, de haut niveau adaptatif, permettant à
l’individu de décoder les variations en temps réel des contingences affectives, de les
intégrer au comportement et de maintenir au long cours un choix comportemental, indé-
pendamment des contraintes endogènes ou environnementales ; des structures comme les
noyaux amygdaliens permettant de construire des comportements stables et invariants,
automatiquement activables, indispensables pour la survie et l’évitement de situations
délétères pour l’individu.
Mots clés : système limbique, cortex préfrontal orbito-ventral, amygdale, striatum ventral
Summary. To relate motivation, a psychological concept, to a neurobiological substrate
requires that this concept should be translated in operations relevant at the biological level.
The term of motivation includes mental elementary processes decoding the emotional
value of a stimulus (endogenous or exogenous) and integrating it into the elaboration,
control and execution of goal-directed behaviors in order to ensure the maintenance of
homeostasis, the wellbeing and survival of the individual and the species. Thus, in experi-
mental condition, responses to aversive or appetitive situations are the classical markers of
motivation. Consequently, the cerebral network of motivation particularly relates to the
limbic system, ie, the amygdala, the orbital and ventromedial prefrontal cortex, the anterior
cingulum and the ventral striatum. Within this network, it is possible to distinguish: on one
part structures such as the orbital and ventromedial prefrontal cortex, which are essential
for the highest level of adaptive responses, allowing the individual to decode the variations
of the emotional contingencies in real time, to integrate them into the behavior, and to
maintain a behavioral choice during a long course, regardless of endogenous or environ-
mental constraints; on the other part structures like the amygdala allow to build stable and
invariants behaviors, that can be automatically activated and are essential for survival and
avoidance of noxious situations.
Key words:motivation, goal-directed behavior, orbital and ventromedial prefrontal cortex,
anterior cingulate cortex, amygdala, ventral striatum
La question des bases neurales de la motivation
est d’une grande complexité tant par la diffi-
culté à proposer une définition biologiquement
opérationnelle d’un concept psychologique que pour
cerner les structures cérébrales qui lui sont indispensa-
bles en admettant, dans le même temps, que l’ensem-
ble du cerveau participe d’une façon ou d’une autre à
l’élaboration, l’exécution ou le contrôle d’un comporte-
ment motivé. Il paraît donc nécessaire de faire quel-
ques remarques préliminaires afin de clarifier le propos
de cet article.
•L’auteur place la survie de l’individu ou la recherche
du bien-être (« tendre vers une balance homéostasique
favorable ») comme les primum novens de l’ensemble
des comportements, y compris chez l’homme. La moti-
vation est donc considérée principalement comme le
rhéostat affectif et émotionnel permettant d’atteindre
cet objectif. Dans ce sens, la cognition n’est que l’outil
utilisé (en particulier dans des conditions environne-
mentales complexes) pour résoudre un problème qui,
ultimement, se révèle de nature affective. L’auteur ex-
clut donc du réseau de la motivation des structures
Psychol NeuroPsychiatr Vieillissement 2004 ; vol. 2, n° 4 : 241-55 241
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

cognitives « froides » telles que l’ensemble des régions
corticales dorsales (en particulier, les cortex préfrontal
latéral, l’ensemble du cortex pariétal, les régions tem-
porales latérales et le lobe occipital dans son ensem-
ble), même s’il paraît évident que ces régions corticales
sont fortement connectées au réseau neural de la moti-
vation et que chez l’homme, nombre de comporte-
ments semblent motivés par la représentation cogni-
tive de la survie (pouvoir, prestige) ou du bien-être
(bonheur) plutôt que par l’état somatique associé à la
survie ou au bien-être. Ainsi, nous retiendrons comme
appartenant spécifiquement au réseau de la motivation
un ensemble de structures « limbiques » : l’amygdale,
le striatum ventral, le cortex préfrontal orbitaire et
ventro-médian et la partie ventro-médiane du cortex
cingulaire antérieur.
•La relation entre la fonction (« motivation ») et la
structure (« cerveau ») est rendue difficile par l’absence
d’expression comportementale directe du concept de
motivation. Ainsi, en clinique, un état apathique, un
émoussement affectif, une absence de projet pour
l’avenir, une clinophilie pourraient relever d’un dys-
fonctionnement motivationnel. Pourtant, il s’agit là
d’une interprétation probabiliste d’un comportement
ou d’un état et, dans ces cas, le défaut de motivation
n’est pas un fait établi.
•Dans le même ordre d’idées, la motivation est néces-
sairement une interprétation plutôt qu’une réalité car
elle est placée à un niveau de description qui reste une
conception psychologique dont la correspondance
avec la neurobiologie nécessite l’éclatement en méca-
nismes, processus, déterminants ou états multiples
plus élémentaires et pertinents à l’échelle biologique.
Ainsi, pour dessiner un réseau cérébral cohérent de la
« motivation », il convient de sortir du concept général
et d’accepter qu‘il recouvre des processus biologiques
regroupés artificiellement en son sein.
Proposition d’une définition
biologiquement opérationnelle
de la motivation et des processus
comportementaux
et neurobiologiques
qu’elle sous-tend
Selon le Grand dictionnaire de psychologie, la moti-
vation est définie par l’ensemble des « processus phy-
siologiques et psychologiques responsables du déclen-
chement, de l’entretien et de la cessation d’un
comportement ainsi que de la valeur appétitive ou aver-
sive conférée aux éléments du milieu sur lesquels
s’exerce le comportement ». Premièrement, selon cette
définition, la motivation correspond aux processus
mentaux intégrant les déterminants endogènes et exo-
gènes (« ceux qui poussent à agir ») pour permettre
l’élaboration, l’exécution et le contrôle des comporte-
ments dirigés vers un but. Ainsi, pour dessiner complè-
tement la neuroanatomie fonctionnelle de l’action, au-
delà des réseaux cérébraux participant à la
représentation et à l’exécution de l’action, il faut y asso-
cier les réseaux cérébraux de la motivation rendant
compte de processus mentaux non apparents et pour-
tant hiérarchiquement responsables de l’action telle
que la valeur qu’attribue l’individu à la réalisation de
l’action (En quoi celle-ci est utile ou nécessaire ? Quel-
les en seront les conséquences ? Quels sont moyens
pour la mettre en œuvre ? Quel en sera le coût ?).
Deuxièmement, la seconde partie de la définition ci-
dessus indique qu’une dimension fondamentale de la
motivation réside dans la capacité à conférer à une
information perçue une valeur affective intégrable au
comportement en cours ou à venir. Ainsi, la récom-
pense (l’objet que l’individu va tenter d’obtenir) et la
punition (l’objet que l’individu va tenter d’éviter) sont
deux paramètres essentiels pour l’étude expérimentale
de la motivation. Ces deux paramètres vont déclencher
une réponse dite « opérante » (un comportement arbi-
traire) pour obtenir une récompense ou éviter une pu-
nition. Le comportement est dit motivé quand l’indi-
vidu (un homme ou un animal) effectue une réponse
opérante. Les performances sont souvent mesurées
par la qualité de l’apprentissage de la réponse opérante
tels, par exemple, la réponse conditionnée de saliva-
tion de Pavlov ou l’établissement d’un renforcement
positif ou négatif si l’association entre un stimulus et la
récompense ou la punition permet d’augmenter la pro-
babilité ultérieure d’effectuer la réponse opérante la
plus adaptée. Il faut isoler les renforcements dits
« primaires », c’est-à-dire élicitant de façon innée le
renforcement de la réponse opérante (par exemple, la
douleur, le tact, le goût, l’odeur et, peut-être, les expres-
sions du visage) des renforcements « secondaires » ac-
quis par leur association avec le renforcement primaire
(par exemple, une information visuelle, qui ne détient
pas de façon inhérente un caractère renforçant).
Organisation générale
du réseau de la motivation
S’il ne s’agit que de répondre à des besoins élémen-
taires et immédiats pour notre survie ou celle de nos
R. Lévy
Psychol NeuroPsychiatr Vieillissement 2004 ; vol. 2, n° 4 : 241-55242
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

congénères, pour éviter les désagréments ou obtenir
un plaisir à portée de main, le réseau cérébral impliqué
est commun à tous les mammifères et fait appel aux
circuits cérébraux mettant en jeu les zones corticales
de décodage sensoriel, le système neurovégétatif, cer-
tains noyaux amygdaliens, le striatum ventral et le sys-
tème d’exécution motrice. Ce système permet d’ap-
prendre que tel signal de l’environnement ou du corps
(un animal dangereux, une soif intense...) est à associer
avec tel comportement (évitement, boire). Néanmoins,
ce système ne permet pas de répondre à toutes les
situations motivantes pour deux raisons :
1) pour être efficace cet apprentissage conditionné
doit être solidement ancré et il ne peut donc pas être
rapidement renversé ou éteint. Il devient inopérant
dans les situations inédites ou dans lesquelles la ba-
lance « favorable/défavorable » d’un comportement
peut varier d’un moment à l’autre ;
2) le caractère rapide et impulsif des réponses
conditionnées ne permet pas de rompre le cycle
perception/action et par conséquent d’interposer
d’autres paramètres comportementaux entre le signal
et la réponse. Ce système est inadapté pour les situa-
tions qui nécessitent de peser et de maintenir ses choix
pour le long terme. Ainsi, chez l’homme, animal social
doté d’outils cognitifs sophistiqués, comme les fac-
teurs environnementaux ou endogènes poussant à agir
sont souvent éloignés de la satisfaction de besoins
immédiats et quelquefois apparaissent même en oppo-
sition avec ceux-ci (sacrifice, don de soi, comportement
désintéressé voir suicide), un réseau efficace de la mo-
tivation doit être capable à la fois d’influencer le com-
portement sur le long terme, en maintenant ou réacti-
vant les buts fixés sans céder aux signaux interférents,
et, à l’inverse, de permettre une adaptation rapide
quand le sujet perçoit que le comportement en cours
perd ses avantages.
Au total, il faut dissocier les comportements moti-
vés invariants, qui reposent sur des associations
« stimulus-récompense » (ou « stimulus-punition »)
stables car la prédiction de la réponse opérante atten-
due est hautement probable, des comportements moti-
vés flexibles, c’est-à-dire dans lesquels la réponse opé-
rante peut rapidement être modifiée pour répondre aux
situations inédites. Cette distinction est essentielle car
elle différencie, du point de vue neuroanatomique et
phylogénique, les réseaux cérébraux assurant la stabi-
lité comportementale de ceux permettant le plus haut
niveau de flexibilité adaptative. En effet, si l’homme
partage avec les autres espèces animales un réseau
cérébral d’organisation identique pour les comporte-
ments motivés invariants (cortex sensoriels, système
neurovégétatif, complexe amygdalien-striatum ventral,
système d’exécution motrice), le développement extra-
ordinaire du cortex préfrontal, y compris de sa région
orbitaire et médiane (CPFOM) - prolongement frontal
du système limbique - confère à l’homme (et, dans une
moindre mesure, aux autres primates) la capacité d’éla-
borer des comportements motivés valides nécessitant
une adaptation rapide aux contingences inédites de
l’environnement ou au contraire le maintien d’un com-
portement dans le long terme indépendamment de la
pression environnementale afin d’aboutir à un choix
internalisé.
Ainsi, chez l’homme (et les autres primates), l’ana-
tomie du réseau de la motivation est avant tout cristal-
lisée autour des structures cérébrales permettant d’in-
tégrer au comportement l’influence favorable ou
défavorable d’informations de nature affective (l’amyg-
dale, les régions ventrales des ganglions de la base, le
CPFOM). Parmi ces structures, certaines sont indispen-
sables pour la flexibilité adaptative (CPFOM), tandis
que d’autres sont nécessaires pour les réponses com-
portementales invariantes (noyaux amygdaliens). Ce
réseau est en interaction avec les structures cérébrales
exécutives, décisionnelles et de contrôle de l’action
volontaire (le cortex préfrontal dorsolatéral, les zones
dorsales des ganglions de la base, la région dorsale du
gyrus cingulaire antérieur) et les systèmes non spécifi-
ques de neuromodulation (en particulier, les systèmes
dopaminergiques nigro-striatal et méso-cortico-
limbique).
Les régions essentielles
du réseau de la motivation
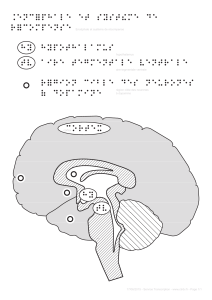
Les noyaux amygdaliens
Ils s’inscrivent dans un réseau fonctionnel dit « lim-
bique », en connexion plus particulièrement avec le
CPFOM, la formation hippocampique, le striatum ven-
tral et des structures végétatives (hypothalamus,
noyaux autonomes du tronc cérébral) [1]. Chez
l’homme, les lésions amygdaliennes sont souvent as-
sociées à d’autres lésions touchant les structures adja-
centes. Ainsi, dans les encéphalites limbiques ou les
méningo-encéphalites herpétiques, il est possible de
mettre en évidence des troubles de l’affect, des émo-
tions, de la motivation et de la cognition sociale. Au
maximum, ces troubles peuvent constituer le syn-
drome de Kluver et Bucy [2] dans lequel il est possible
d’observer des modifications portant sur les comporte-
ments alimentaire (hyperoralité) et sexuel (hypersexua-
Motivation et réseau neural
Psychol NeuroPsychiatr Vieillissement 2004 ; vol. 2, n° 4 : 241-55 243
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

lité), une impulsivité obligeant l’individu à saisir les
objets à sa portée ainsi qu’une relative indifférence
affective. Une partie de ces déficits pourrait être inter-
prétée comme secondaire à une dérégulation motiva-
tionnelle du fait d’un défaut d’intégration des affects et
des émotions. Chez l’homme, les lésions amygdalien-
nes isolées sont exceptionnelles. Les cas décrits sont
secondaires à une affection appelée maladie d’Urbach-
Wiethe, entraînant des lésions bilatérales et symétri-
ques des amygdales. Dans ces cas, il est possible d’ob-
server des troubles isolés du traitement des émotions
ou de leur conséquence sur les autres systèmes (par
exemple, des difficultés pour décoder la peur sur un
visage, pour mémoriser à long terme un épisode à
forte coloration affective...) [3-5]. Les études expéri-
mentales chez le singe et l’approche neuropsychologi-
que chez l’homme montrent que les lésions amygda-
liennes produisent le plus souvent des troubles de
l’apprentissage associatif « stimulus-renforcement »,
que celui-ci soit négatif, comme par exemple l’associa-
tion entre un stimulus visuel (une lumière) et une puni-
tion (un choc électrique) [6], ou positif [7], des troubles
de l’adaptation aux modifications de la contingence
stimulus-récompense ou stimulus-punition [8] ou
encore des difficultés à évaluer les conséquences de
l’action future [9]. D’une façon générale, les troubles
cliniques s’inscrivent dans le champ des déficits
affectivo-émotionnels [10]. En particulier, il existe une
désadaptation des réponses liées à la peur, sous-
tendue par la démonstration que l’amygdale est indis-
pensable à l’élaboration du phénomène de « peur
conditionnée » [11-13]. En outre, les animaux et les
hommes porteurs de lésions amygdaliennes ont des
difficultés à décoder les affects et les émotions liées aux
expressions faciales [14, 15] et à attribuer une valeur
pertinente à un choix alimentaire ou à un comporte-
ment sexuel [2, 6].
Les travaux en électrophysiologie vont dans le sens
de ces observations dans la mesure où les neurones de
l’amygdale sont capables de discriminer des stimula-
tions visuelles sur la base d’une récompense [16], d’as-
socier des stimulations auditives à une punition [10], de
détecter la nouveauté ou la familiarité de stimuli vi-
suels [16], de discriminer des visages sur la base de
leur identité [17] et de leur expression [18].
Cependant, une analyse plus fine des données sug-
gère que l’amygdale posséderait un rôle bien distinct
des régions corticales du système limbique (en particu-
lier du CPFOM). La principale différence avec le CPFOM
réside dans le caractère robuste et durable des appren-
tissages associatifs entre le stimulus et la récompense.
Ces apprentissages, le plus souvent conditionnés, repo-
sent sur des mécanismes neuronaux et biochimiques
aboutissant à la création de liaisons synaptiques sta-
bles (potentialisation et dépression à long terme) sous
la dépendance entre autres de l’activation des récep-
teurs NMDA [19]. Ainsi, le phénomène d’extinction de
l’association stimulus-récompense est d’obtention
lente (bien plus lente que dans le CPFOM). De plus,
l’amygdale intervient également dans la consolidation
en mémoire à long terme épisodique en colorant affec-
tivement les souvenirs [20-22]. Cette intervention se
fait par les connexions amygdalo-hippocampiques [23,
24] et le renforcement de la potentialisation à long
terme dans la formation hippocampique [25]. Inverse-
ment, dans le CPFOM, l’activité neuronale est très flexi-
ble : par exemple, une seule altération de la contin-
gence « stimulus récompense » est susceptible de
stopper la réponse neuronale. En outre, les processus
de plasticité cérébrale du CPFOM sont indépendants
des récepteurs NMDA. Enfin, à l’inverse du CPFOM,
l’amygdale n’a pas de projection directe vers le cortex
préfrontal dorsolatéral (DLPFC) [1], ce qui l’empêche
d’agir directement sur la structure cérébrale essentielle
pour les comportements planifiés et non réflexifs.
Ainsi, l’amygdale intervient dans les comporte-
ments motivés quand ceux-ci nécessitent une réponse
immédiate et impulsive. Il s’agit d’une intervention es-
sentielle pour la survie et les comportements routiniers
basés sur les émotions et les affects. Pour être efficace,
ces comportements nécessitent d’être profondément
ancrés (c’est-à-dire consolidés et difficilement réversi-
bles). En cela, l’amygdale s’oppose au CPFOM qui, au
contraire, permet une haute flexibilité comportemen-
tale en modifiant rapidement le comportement vers
celui qui est le plus adapté pour l’individu.
Le striatum ventral et les régions limbiques
des ganglions de la base
Ils sont en relation avec les autres structures limbi-
ques : noyaux amygdaliens, formations hippocampi-
ques et surtout le CPFOM avec lequel il forme une
boucle fonctionnelle [26-28]. Chez l’homme, les consé-
quences cliniques d’une lésion isolée de la partie ven-
trale du striatum (nucleus accumbens) ou des autres
structures limbiques des ganglions de la base ne sont
pas connues. En revanche, des lésions plus larges mais
incluant ces structures peuvent entraîner un syndrome
apathique sévère appelé aboulie, athymormie ou en-
core perte d’auto-activation psychique. Ce syndrome
consiste en une inertie comportementale et cognitive
majeure associée à un émoussement affectif. Il est tota-
lement réversible par stimulation externe et peut s’ac-
R. Lévy
Psychol NeuroPsychiatr Vieillissement 2004 ; vol. 2, n° 4 : 241-55244
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

compagner d’un état de « vide mental » quelquefois
associé à la libération d’activités mentales stéréo-
typées pseudo-compulsives comme l’arithmomanie
[29-32]. Les lésions responsables de ces états sévères
d’apathie siègent le plus souvent dans les noyaux cau-
dés (incluant la partie ventrale limbique), le pallidum
interne (recevant des connexions limbiques et associa-
tives) et les noyaux dorso-médians des thalami [33].
Pour autant, l’apathie est-elle un reflet clinique d’un
défaut de motivation ? Pour les uns, l’apathie est au
premier chef un trouble de motivation [34]. Pour
d’autres, l’apathie est une réduction quantitative des
comportements volontaires dirigés vers un but [35],
quel que soit le mécanisme sous-jacent qui en est res-
ponsable (qui peut être, alternativement au mécanisme
« a-motivationnel », un défaut d’initiation de la pensée
ou de l’action). Cette discussion est résumée dans la
taxinomie de ces états apathiques, qui suggère soit un
trouble affectif à l’origine de l’apathie (athymormie)
soit un défaut d’auto-activation mentale (perte d’auto-
activation psychique). Toutefois, si les lésions expéri-
mentales du striatum ventral chez le singe s’accompa-
gnent d’un trouble de la régulation du comportement
face à la récompense (par exemple, une extrême agres-
sivité en réponse à la non-réception d’une récompense
attendue), ils ne produisent pas d’apathie [36, 37].
Le profil d’activité des neurones du striatum ventral
indique qu’ils réagissent à l’obtention de la récom-
pense ou à un stimulus associé à une récompense,
mais pas à la réponse elle-même [38]. Des réponses
sont obtenues que l’animal effectue lui-même un mou-
vement pour obtenir la récompense ou qu’il la reçoive
passivement, de façon prévisible [39] ou imprévisible
[40]. Cependant, les situations dans lesquelles l’occu-
rence d’une récompense est imprévisible induisent une
modulation plus fréquente et plus ample de la réponse
neuronale par comparaison aux situations dans les-
quelles l’occurence de la récompense est prévisible
[40]. Ainsi, certains neurones cessent de répondre
lorsqu’un intervalle temporel fixe sépare l’indice de la
récompense [41]. D’autres groupes de neurones stria-
taux déchargent de façon phasique et graduelle durant
la phase antérieure à l’obtention de la récompense
[42-45]. Il pourrait donc s’agir de neurones « prédic-
teurs » de la récompense à venir [42]. Comme les neu-
rones du CPFOM, leur activité est modulée par le type
de récompense en jeu et les décharges cessent rapide-
ment en cas d’omission de la récompense. Dans une
épreuve cognitive (go/no-go) durant laquelle l’animal
doit effectuer plusieurs essais successifs (1, 2 ou 3)
pour obtenir la récompense [46], l’obtention prochaine
de la récompense, indiquée par une augmentation pro-
gressive de la luminosité d’une lampe, s’accompagne
de la nette augmentation des décharges anticipatoires
des neurones du striatum ventral. En outre, ces activi-
tés liées à la récompense sont associées à des activités
neuronales « prémotrices » comparables à celles ob-
servées dans les régions dorsales du striatum. Ce dou-
ble codage d’informations liées à la récompense et à
l’organisation de la réponse peut expliquer que la dé-
nervation dopaminergique du striatum ventral se mani-
feste par des troubles pour sélectionner la nourriture
préférée [47]. Plus précisément, l’animal ne semble
plus capable de sélectionner ou d’initier un comporte-
ment de type instrumental pour obtenir la récompense
préférée ou d’évaluer le rapport coût/bénéfice dans une
situation donnée (l’animal se limite à consommer la
nourriture située à proximité directe). En outre, il faut
aussi noter que le striatum ventral interviendrait de
façon importante dans la consolidation d’une règle as-
sociative « stimulus-comportement » [45].
Le fonctionnement du striatum ventral est tributaire
de la modulation dopaminergique en provenance de
l’aire tegmentale ventrale du mésencéphale. La dopa-
mine exerce un double effet au niveau du striatum :
d’une part, elle augmente la sélectivité des activités
corticales transmises en sortie des ganglions de la base
et, d’autre part, elle renforce l’efficacité des synapses
qui ont généré une action récompensée. Ces deux ef-
fets contribuent à faciliter la sélection de l’action adap-
tée à un contexte donné. Cependant, à ce jour, il existe
un débat concernant l’influence précise de l’innerva-
tion dopaminergique au sein du striatum ventral. Pour
certains, la dopamine signale les erreurs et les modifi-
cations environnementales prédisant des événements
motivants [48] ou renforce le signal neural permettant
l’apprentissage de l’association stimulus-récompense
Points clés
•Les bases neurales de la motivation sont souvent
déduites de l’impact de lésions cérébrales ou étu-
diées expérimentalement en situations comporte-
mentales d’évitement ou d’appétence.
•Le réseau de la motivation est cortico-sous-cortical
faisant appel principalement aux structures limbi-
ques (amygdale, cortex préfrontaux orbitaire et
ventro-médian, striatum ventral).
•Les cortex préfrontaux orbitaire et ventro-médian
jouent le rôle central dans la motivation lorsqu’il
s’agit de s’adapter à un environnement aux règles
complexes et variables.
Motivation et réseau neural
Psychol NeuroPsychiatr Vieillissement 2004 ; vol. 2, n° 4 : 241-55 245
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%