comportement ondulatoire de la matière (Mise à jour 09/2013)

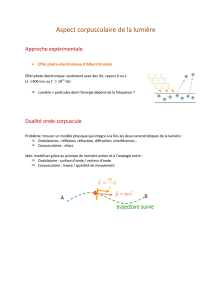
III) Comportement ondulatoire des corpuscules
1) Relation de de Broglie
On a trouvé une relation entre une propriété corpusculaire du photon
et une propriété de l’onde associée.
Louis de Broglie a proposé une relation s’appliquant à une particule
quelconque (de masse différente de zéro). Si l’on associe une onde
de la forme
a cette particule, alors la relation liant la propriété corpusculaire à la
propriété ondulatoire est :
photon
E h
ν ω
= =
ℏ
)
0
i(kx t
e
ω
ψ ψ
−
=
kVm
ℏ
=
Masse de la particule Vitesse de la particule
nombre
d’onde
π
2
h
=ℏ

Soit :
p
h
oukp ==
λ
ℏ
Quantité de mouvement Longueur d’onde
N.B pour l’énergie d’une particule relativiste (par exemple le photon !),
il faut utiliser l’invariant relativiste :
Et en posant m=0 pour le photon, on obtiens :
et donc
On retrouve la formule de l’énergie du photon
2 2 2 2 4
particule
E p c m c
− =
hc
E h
ν
λ
= =
E pc
=
et
2 2 2
2 2
cin particule
p k
E
m m
= =
ℏ

Pour un acarien de 10
-8
kg se déplaçant à 0,1 mm s-1 on obtient :
λ=6,6 10
-22
m
Pour détecter cette onde par diffraction, il faudrait
une fente avec une ouverture de l’ordre 10
-22
m !
Seul l’aspect « particule » est visible.
Pour un électron de masse m = 9,1 10
-31
kg ayant une énergie cinétique
Rappel : 1 eV est l’énergie acquise par un électron soumis à un
potentiel d’1 Volt.
Dans un potentiel de 150,4 V on a donc T=150,4 eV et donc λ=10
-10
m
Qui est une dimension caractéristique du monde microscopique auquel
appartient l’électron.
m
p
T2
2
=
10
150, 4 ( )
( ) 10
2
h eV
mT
mT
λ
−
= =

Lorsque v devient petit, λaugmente
Pour obtenir une longueur d’onde
λ=10-10 m avec une masse de 1 kg, il faut une
vitesse v=6,6 10-24 m s-1 !
Il faudra alors 1027 années pour que l’objet parcoure 1 m, ce qui
rend toute expérience impossible.

2) Mise en évidence expérimentale
Les plans réticulaires forment des familles
de plans parallèles dans les cristaux.
Les plans sont définis par les indices de
Miller.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%