Évaluation de la prise en charge de l`arrêt - Dumas

´
Evaluation de la prise en charge de l’arrˆet cardiaque par
le SAMU de Bordeaux en 2011
Maxime Villard
To cite this version:
Maxime Villard. ´
Evaluation de la prise en charge de l’arrˆet cardiaque par le SAMU de Bordeaux
en 2011. M´edecine humaine et pathologie. 2014. <dumas-01060826>
HAL Id: dumas-01060826
https://dumas.ccsd.cnrs.fr/dumas-01060826
Submitted on 4 Sep 2014
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-
entific research documents, whether they are pub-
lished or not. The documents may come from
teaching and research institutions in France or
abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est
destin´ee au d´epˆot et `a la diffusion de documents
scientifiques de niveau recherche, publi´es ou non,
´emanant des ´etablissements d’enseignement et de
recherche fran¸cais ou ´etrangers, des laboratoires
publics ou priv´es.

1
Université Bordeaux 2
U.F.R. DES SCIENCES MEDICALES
Année : 2014 N° 51
Thèse pour l’obtention du
DIPLOME d’ETAT de DOCTEUR EN MEDECINE
Présentée et soutenue publiquement par
VILLARD Maxime
Né le 16/07/1984 à LYON
Le 15 Mai 2014
Evaluation de la prise en charge de l’arrêt cardiaque par le
SAMU de Bordeaux en 2011
Directeur de thèse
Dr THICOIPE Michel
Jury
Pr SZTARK François : Président.
Pr DOS SANTOS Pierre.
Pr VARGAS Fréderic.
Dr THICOIPE Michel.
Dr PRADEAU Catherine.

2
REMERCIEMENTS
Aux membres du jury, avec tous mes remerciements et ma reconnaissance pour m’avoir fait
l’honneur de participer à cette thèse,
Monsieur le Pr SZTARK François : Président du jury.
Monsieur le Pr DOS SANTOS Pierre.
Monsieur le Pr VARGAS Fréderic.
Madame le Dr PRADEAU Catherine.
A Monsieur le Dr THICOIPE Michel, directeur de thèse qui m’a guidé tout le long de ce
travail. Je tiens à témoigner particulièrement ma reconnaissance pour l’ensemble des
connaissances et la rigueur qu’il a su me transmettre. Je le remercie pour sa patience, sa
disponibilité et son accompagnement inconditionnels dans la réalisation de ce projet.
A Monsieur le Pr COSTE Pierre, pour sa relecture attentive, sa patience et sa disponibilité,
qui furent une aide précieuse à la construction de ce travail.
A mes parents, ma sœur, et le reste de ma famille, qui ont su m’accompagner tout au long
de ces longues études. Merci pour votre soutien, vos encouragements, pour l’amour et
l’éducation que vous m’avez donné. Je tiens à vous exprimer tout l’amour que je vous porte
et ma reconnaissance infinie.
A Aude qui a su m’accompagner dans cette épreuve et à sa compréhension au quotidien.
A mes amis pour les bons moments passés ensemble :
- Les tontons, JS, Greg, Frans, pour toutes ces années d’amitié et pour celles à venir.
- Les sudistes, gaz, papys, Géraud, cousin ed., Mathieu, bib’s, matelot, didou, et al.
- Les bordelais, grillou, papou, FU, man, et al.

3
SOMMAIRE :
INTRODUCTION
PREMIERE PARTIE : RAPPELS
1. GENERALITES SUR LES ARRETS CARDIAQUES
1.1. EPIDEMIOLOGIE
1.2. HISTORIQUE
1.3. ETIOLOGIE
1.4. PHYSIOPATHOLOGIE
2. ORGANISATION DE L’AIDE MEDICALE URGENTE
2.1. RECEPTION ET REGULATION DES APPELS
2.2. CADRE LEGISLATIF ET REGLEMENTATIONS SUR L’AIDE MEDICALE URGENTE
2.3. LA SITUATION EN GIRONDE
3. LES RECOMMANDATIONS 2010
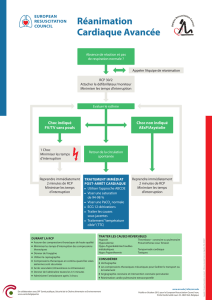
3.1. LES MAILLONS DE LA CHAINE DE SURVIE
3.2. LA REANIMATION CARDIO-PULMONAIRE DE BASE CHEZ L’ADULTE
3.3. LA DEFIBRILLATION
3.4. LA REANIMATION CARDIO-PULMONAIRE MEDICALISEE CHEZ L’ADULTE
DEUXIEME PARTIE : MATERIEL ET METHODES
1. OBJECTIFS DE L’ETUDE
2. MATERIEL
2.1. CRITERES D’INCLUSION
2.2. CRITERES D’EXCLUSION
3. METHODE SELON LE MODELE D’UTSTEIN
3.1. LA FICHE D’INTERVENTION SMUR MANUSCRITE
3.2. LA FICHE INFORMATISEE DE LA REGULATION

4
3.3. LE DOSSIER MEDICAL
3.4. LES DONNEES
4. ANALYSE STATISTIQUE
TROISIEME PARTIE : RESULTATS
1. LA POPULATION DE L’ETUDE
2. LE TAUX DE SURVIE
3. EPIDEMIOLOGIE DE LA POPULATION TOTALE
4. POPULATION NON REANIMEE
5. POPULATION REANIMEE
6. REANIMATION SPECIALISEE
7. LES DONNEES POST-RACS
8. BILAN DE LA POPULATION TOTALE
9. ANALYSES STATISTIQUES
QUATRIEME PARTIE : DISCUSSION
1. LIMITES ET BIAIS DE L’ETUDE
2. ANALYSE DE LA SURVIE
3. POPULATION DE L’ETUDE
4. LES MAILLONS DE LA CHAINE DE SURVIE
5. LA REANIMATION SPECIALISEE
CONCLUSION
ANNEXES
BIBLIOGRAPHIE
SERMENT D’HIPPOCRATE
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
1
/
110
100%