3 Résultats

27
3 Résultats
3.1 Introduction
Le cycle de vie d’une plante abouti toujours à
une multiplication des graines à partie d’une
seule.
Mais que se passe-t-il entre le semis et la
formation des prochaines graines? .
Nous savons que, pendant ce temps, la plante
vit, elle augmente de taille, elle présente des
changements morphologiques, physiologiques
et biochimiques.
Le poète scientifique Johann-Wolfgang Goethe
dans l’ouvrage intitulé « La métamorphose des
plantes » écrit en 1790, décrit le cycle de vie
d’une plante idéal de la façon suivante:
Dans le sec le noyau garde vie immobile,
adonné à l’humidité douce, il se gonfle et se
tend, et s’élève aussitôt de la nuit qui
l’entoure; mais quand il apparaît, la forme en
reste simple, dans les plantes aussi, c’est de
l’enfant le signe.
Tout aussitôt se dresse une pousse suivante,
ajoute nœud à nœud, renouvelle la prime force,
non, certes, toujours la même; car la feuille
suivante est toujours, tu le vois, mieux formée,
plus variée, plus étendues, plus
échancrées,mieux séparées en pointes et
parties, celles qui reposaient mêlées en
l’organe inférieur.
Enfin elle culmine en perfection précise […]
Bientôt la forme montre de plus doux effets[…]
La hampe de la tige se forme plus parfaite.
Mais sans feuilles, très vite, le pédoncule
s’élève et le regard découvre une merveille.
Tout autour en un cercle, comptées et
innombrables, la feuille plus petite se joint à sa
semblable.
Pressé autour de l’axe, le calice protecteur se
révèle, lançant vers la suprême forme corolle
colorées […] les plus tendres des formes
apparaissent en double, destinées à s’unir.[…]
Hymen descend sur eux et des vapeurs
splendides versent de doux parfums vivifiant
l’alentour.
Des germes bien distincts s’enflent alors sans
nombre, au sein de fruits renflés cachés et
protégés, nature clôt l’anneau des forces
éternelles; mais en cycle nouveau tôt succède à
l’ancien, pour que se continue à tout jamais la
chaîne, et que tout et partie soient animés de
vie.
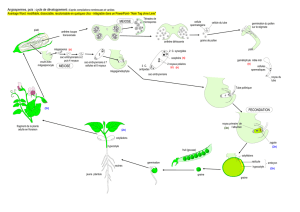
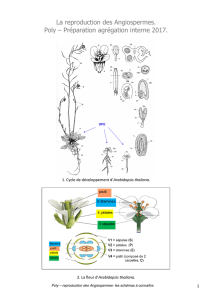
3.2 Cycle de vie
d’
Arabidopsis thaliana
La taille moyenne d’une graine
sèche
d’Arabidopsis thaliana est de 0.3 mm x 0.5
mm comme il est montré dans la figure 4. Ces
valeurs ont été obtenues en faisant une
moyenne sur 5 graines du même écotype (Ws)
récoltées en novembre 2000.
Figure 4. Calcul de la surface de la graine sèche
d’Arabidopsis thaliana écotype Ws. Les
photographies avec la règle millimétrée ont été
prises par le Dr M. Crèvecoeur du laboratoire
d’Histologie et Cytologie Végétales de l’Université
de Genève.
Les figures 5 et 6 permettent d’avoir une vison
générale du cycle de vie d’Arabidopsis
thaliana. Dans nos conditions (voir Matériel)
la plante nécessite environ 65 jours pour
effectuer le cycle complet (obtention des
nouvelles graines).
area ≈ 480110 pixel
area = 182267 pixel
0.2mm*0.2mm=0.04mm
2
Surface moyenne un mm
2
de la graine sèche:
area = 480110/182267*0.04 ≈ 0.1mm
2

28
Figure 5. Cycle de vie d’Arabidopsis thaliana (écotype Ws) en condition de 12 h de lumière et 12 h d’obscurité.
Chaque photo est espacée par un intervalle d’une semaine. Dans la photo de fond, Arabidopsis a atteint l’âge de
50 jours.
29 jours
8 jours 15 jours
22 jours
36 jours
43 jours
cotylédons
radicule
1 cm

29
Figure 6. Schéma du cycle de vie d’Arabidopsis thaliana (Degli Agosti et al. 2000) adapté ici pour l’écotype Ws
(L:D =12h:12h, T = 22 +/-1˚C, Hr = 60 +/-5%, intensité lumineuse à la surface de la rosette ~ 30 μmol/m
2
/s).
Radicule (ra), cotylédon (cot), hypocotyle (hyp), feuilles primaires (1
st
le), feuilles de la rosette (le), silique (si).
Avec notre système de camera vidéo IR (voir
Méthode) nous nous sommes intéressés à
l’étude des dynamiques macroscopiques
(mouvements et croissance) d’Arabidopsis
thaliana lors de son cycle de vie. La partie
suivante contient les résultats de nos
expériences.
3.2.1 Germination
Dans la majorité des cas, lors de la maturation
de la graine, la dernière étape est caractérisée
par une dessiccation. La graine sèche va
ensuite rester dans un état de quiescence
métabolique pendant un temps plus ou moins
long. Le commencement de la germination est
intimement lié avec l’hydratation de la graine.
La germination, comme illustré dans la figure
7, peut être divisée en trois phases:
-imbibition(I).
-augmentation de l’activité métabolique(II).
-commencement de la croissance(III).
Figure 7. Les trois stades de la germination.
(http://seed.proteome.free.fr/ara.htm)
~3 mm
~5 cm
~8 cm
~7 cm
~2 mm
~1 cm
~500 μm
ra. cot.
Seed
seedling
Rosette (upper
view)
stamen sepal
petal
carpel
si.
si. Flower
hyp.
cot.
le.
1st le.
Floral
stem
1st
internode
~7-10 days ~25 days
~45 days
~55 days
+Root +Root
sepal
petal

30
Figure 8. Schéma général des facteurs qui contrôlent la germination d’Arabidopsis (Bentsink et Koornneef
2002). GA=gibbérellines, ABA= acide abscissique, BR= brassinostéroides.
La germination sensu stricto commence par
l’imbibition et fini par la sortie de la radicule et
l’élongation de l’axe de l’embryon (Bewley
1997). Une analyse protéomique de la
germination pour Arabidopsis a permis de
mettre en évidence des nouvelles protéines
associées aux différents stades de la
germination (Gallardo et al. 2001), tandis que
une analyse génétique a mit en évidence
l’existance de locus (ex. comatose)
responsables de la réduction du potentiel de
germination (Holdsworth et al. 2000). L’état
des connaissances sur les mécanismes
moléculaires impliqués dans la germination
d’Arabidopsis est résumé dans l’article écrit
par Bentsink (voir figure 8).
Des animation pour le stade III peuvent être
trouvées sur les deux sites web suivants:
http://www.bio.warwick.ac.uk/millar/Video/m
d5banw3.gif,http://sunflower.bio.indiana.edu/~
rhangart/plantmotion/earlygrowth/germination/
arabidopsis/atgermination.html.
Nous savons que le stade III aboutit à la
formation de la plantule, dont les cotylédons
présentent un rythme circadien (Engelmann et
al. 1992). Le moment de la naissance de ce
rythme à notre connaissance n’a pas été
caractérisé. Nous avons donc effectué une

31
expérience pour définir le commencement du
rythme circadien des cotylédons
d’Arabidopsis. Un support a été construit pour
cette expérience (figure 9) sur lequel une
graine, n’ayant pas subi de vernalisation
précédemment, a été positionnée.
Figure 9. Support pour l’étude de la germination
Des photos digitales prises tous les 15 min ou
10 min nous ont permis de suivre la
dynamique de croissance et des mouvements à
partir du commencement du stade III (pour
Arabidopsis il faut compter environ 3 jours
après le commencement de l’imbibition). Nous
avons ainsi obtenu des animations (voir CD:
Germ1.avi et Germ2.avi). Le calcul de
l’évolution de la surface a été obtenu à l’aide
du programme area.m (voir 2.3.3.3.1
Programmes). Les résultats sont présentés dans
la figure 10. Trois phases on été mise en
évidence:
-phase 1: croissance de la radicule.
-phase 2: sortie des deux cotylédons de la
graine.
-phase 3: plantule complète, commencement
du rythme circadien des deux cotylédons.
Par nos observations nous pouvons dire que les
cotylédons commencent à se lever
verticalement pendant la nuit et à se
positionner horizontalement pendant le jour,
une fois que l’hypocotyle se trouve en position
verticale. Les changements ou décroissances
rapides de la surface sont dû à des
mouvements « rapides » de la radicule ou des
cotylédons. Il est important de noter que la
radicule a la capacité de pénétrer un petit peu à
l’intérieur du filtre à charbon et sa position par
rapport aux sources lumineuses de 950 nm
peut varier. Ces événements impliquent une
variation de la luminosité des pixels qui
peuvent ne plus être détectables par la valeur
du seuil (filtre) choisi dans le programme
area.m.
Boite de Petri
remplie d ’eau
Filtre de charbon qui mouille
dans l ’eau et pemet de mantenir
humide le support sur lequel est
posée la graine.
Support couvert d ’un
filtre à charbon sur lequel
se trouve la graine
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
1
/
50
100%