Milieux de Culture en Bactériologie : Guide Complet

BIO303 Rédigé par Chringel
Page | 1
Les Milieux de Culture en
Bactériologie
Les Milieux de Culture
Gélose au Cétrimide - milieu sélectif
Composition
Mélanges d’acides aminés, facteurs de croissance : peptone
Glucide et dérivés : /
Autres molécules carbonées : /
Indicateurs S2- : /
Inhibiteurs : cétrimide (antiseptique), acide nalidixique
Divers : /
Indicateurs de pH : /
Ions minéraux : chlorure de magnésium MgCl2, sulfate de potassium K2PO4,
hydrogénophosphate de potassium
Agar : oui
Eau : oui
Caractéristiques
Milieu proche du King A, favorise la production de pyocyanide.
Milieu relativement pauvre.
Acide nalixidique : inhibiteur des Gram –
Cétrimide : inhibiteur des Grams + donc des Gram – par extension.
Ensemencement en cadran.
Usage
Recherche des Pseudomonas, notamment Pseudomonas earuginosa.
Lecture
Incubation 24h à 37°C :
Développement Pseudomonas aeruginosa et éventuellement Pseudomonas putida,
Pseudomonas stutzeri et Pseudomonas maltophilia.
Incubation 24h à 42°C :
Développement presque exclusif de Pseudomonas aeruginosa.
Pyocyanine : milieu bleu
Pyoverdine : milieu jaune-vert indicateur de la présence de Pseudomonas

BIO303 Rédigé par Chringel
Page | 2
Gélose de Chapman – milieu sélectif
Composition
Mélanges d’acides aminés, facteurs de croissance : Peptones, extrait de viande
Glucides et dérivés : /
Autres molécules carbonées : mannitol
Indicateur S2- : /
Inhibiteurs : NaCl à 75g/L
Divers : /
Indicateurs de pH : rouge de phénol
Ions minéraux : NaCl
Agar : oui
Eau : oui
Caractéristiques
Permet la croissance des bactéries halophiles.
Très forte concentration en NaCl permettant l’inhibition des Gram-
Permet l’étude de l’attaque du mannitol (si baisse du pH, alors teinte jaune)
Ensemencer richement en stries ou cadran.
Incubation : 24-48h
Usage
Isolement de Staphylococcus aureus.
Numération des staphylocoques.
Lecture
Si Staphylococcus aureus : colonie jaunes avec halo clair. Mannitol +
Les autres colonies sont Mannitol -.
Contamination possible par Enterococcus et certains Bacillus.

BIO303 Rédigé par Chringel
Page | 3
Drigalski – milieu sélectif
Composition
Mélanges d’acides aminés, facteurs de croissance : Peptones, extraits de viande et levure
Glucide et dérivés : Lactose
Autres molécules carbonées : /
Indicateurs S2- : /
Inhibiteurs : Cristal violet, Désoxycholate de sodium
Divers : /
Indicateurs de pH : Bleu de Bromothymol
Ions minéraux : Thiosulfate de sodium
Agar : oui
Eau : oui
Caractéristiques
Cristal violet : inhibe les bactéries Gram +
Désoxycholate de sodium : inhibe les bactéries Gram +
Sélectionne les bactéries Gram –
Inoculation en cadran.
Usage
Isolement des entérobactéries.
Lecture
Bactéries lactose + : colonies jaunes (utilisation du lactose)
Bactéries lactose - : colonies bleu-vert
Lexique
Mannitol : utilisé pour étudier sa voie d’attaque par les bactéries (fermentation…).
Bleu de Bromothymol : vert (basique) et jaune (acide)
Entérobactéries : bactéries se trouvant dans les cavités internes des êtres vivants comme
l’appareil digestif.
Rouge de phénol : rouge (basique) à jaune (acide)

BIO303 Rédigé par Chringel
Page | 4
Hektoen – milieu sélectif
Composition
Mélanges d’acides aminés, facteurs de croissance : Peptones, extraits de levure
Glucide et dérivés : salicine, lactose, saccharose
Autres molécules carbonées : /
Indicateurs S2- : citrate de fer
Inhibiteurs : sels biliaires
Divers : /
Indicateurs de pH : Bleu de bromothymol, fuschine acide
Ions minéraux : Thiosulfate de sodium, NaCl
Agar : oui
Eau : oui
Caractéristiques
Sels biliaires : limitent le développement des Gram +
Fuschine : vire au rose s’il y a production d’aldéhyde.
Favorise Salmonelle et Shigella du fait des peptones.
Mise en évidence de la production d’H2S
Usage
Isolement des entérobactéries pathogènes : principalement pour vérifier la présence de
Shigella et Salmonella.
Lecture
Aspect des colonies :
H2S
Attaque
glucide
Production
aldéhyde
Saumon
-
+
+
Saumon et
centre noir
+
+
+
Bleu-vert
-
-
-
Bleu-vert
et centre
noir
+
-
-
Interprétation :
o Saumon : Escherichia, Levinea, Citrobacter, Klebsiella, Enterobacter, Serratia,
Yersinia.
o Saumon et centre noir : Proteus vulgaris.
o Bleu-vert : suspicion de Shigella ou Salmonella.
o Bleu-vert et centre noir : suspicion de Salmonella.

BIO303 Rédigé par Chringel
Page | 5
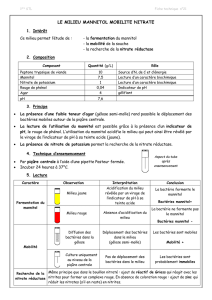
Hugh et Leifson – milieu différentiel
Composition
Mélanges d’acides aminés, facteurs de croissance : peptones, extrait de levures
Glucide et dérivés : glucose
Autres molécules carbonées : /
Indicateurs S2- : /
Inhibiteurs : /
Divers : /
Indicateurs de pH : bleu de bromothymol
Ions minéraux : NaCl, K2HPO4
Agar : oui
Eau : oui
Usage
Détermination de la voie d’attaque des Glucides, utilisés comme principale source
d’énergie par les bactéries.
L’utilisation du glucose acidifie le milieu, le BBT va alors virer au jaune.
Technique
Régénérer les 2 tubes : création gradient d’oxygène.
Les ramener à 45°C.
Ajouter aseptiquement quelques gouttes d’une solution de glucose stérile.
Concentration finale dans le tube environ 10g/L.
Agiter le tout pour répartir le glucose dans tout le tube.
Solidifier les deux tubes en les plongeant dans l’eau froide.
Ensemencer chaque tube par piqûre centrale avec la pipette Pasteur.
Recouvrir l’un des deux tubes de paraffine ou vaseline stérile.
Incubation 24h à 37°C.
Tube recouvert = tube fermé
Tube non recouvert = tube ouvert
NE PAS REVISSER A FOND LES BOUCHONS.
Lecture
Il peut y avoir formation de gaz par les bactéries.
Résultats après
cultures 24h à 37°C
Interprétation
Le glucose est
dégradé en
aérobiose et en
anaérobiose :
bactérie
fermentative du
glucose.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%