Problème 2 : synthèse d`un « anneau de Möbius

32ème OIC Épreuve de sélection — Corrigé 1
Problème 2 : synthèse d’un « anneau de Möbius »
1. Expliquer pourquoi le furane substitué A peut être considéré comme un composé aromatique.
Le furane est un composé aromatique car le cycle plan possède 6 électrons
délocalisés (critère de Hückel) : les 4 électrons des deux doubles liaisons et les deux
électrons de l’un des doublets non liants de l’atome d’oxygène.
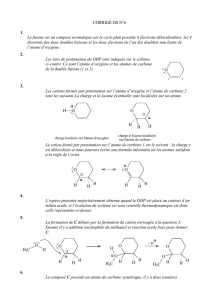
2. Indiquer les sites de protonation du DHP.
Les sites de protonation du DHP sont indiqués sur le schéma
ci-contre. Ce sont l’atome d’oxygène et les atomes de carbone
de la double liaison (1 et 2). O
12
3. Écrire s’il y a lieu les formules mésomères de chaque cation obtenu par protonation du DHP.
Les cations formés par protonation sur l’atome d’oxygène et l’atome de carbone 2
sont les suivants.La charge et la lacune éventuelle sont localisées sur un atome.
OH
charge localisée sur l'atome d'oxygène
O
HHH
charge et lacune localisées
sur l'atome de carbone
Le cation formé par protonation sur l’atome de carbone 1 est le suivant : la charge y
est délocalisée et nous pouvons écrire une formule mésomère où les atomes satisfont
à la règle de l’octet.
O
HHH
O
HHH
4. En déduire la structure de l’espèce cationique majoritairement obtenue quand le DHP est
placé au contact d’un milieu acide, si l’évolution du système est sous contrôle
thermodynamique (autrement dit si l’espèce cationique majoritaire est la plus stable).
L’espèce protonée majoritairement obtenue quand le composé A est placé au contact
d’un milieu acide, si l’évolution du système est sous contrôle thermodynamique est
donc celle représentée ci-dessus.
5. Montrer qu’une seule formule semi-développée est compatible avec les données
spectroscopiques fournies. Indiquer sur cette formule les déplacements chimiques des différents
protons.
L’examen des formules brutes montre que la formation de C résulte d’une addition
de méthanol sur A. Les deux produits possibles sont représentés ci-après.

32ème OIC Épreuve de sélection — Corrigé 2
OH3COH O
HHHOCH3
O
HHH
O
H3C
ou
Dans la structure de gauche, le proton au pied du groupe méthoxy donne un signal
qui ne peut être un triplet (il est couplé avec les protons portés par les atomes C1 et
C3). En revanche, le spectre est compatible avec la structure de droite. Le proton
porté par l’atome C1 est a priori couplé uniquement aux deux protons de l’atome C2
ce qui donne en première appro-ximation un système 2
AX donc un triplet.
O
HHH
O
H3C
HH
H
HH
H
multiplet 2 H
δ = 3,90-3,45 ppm
massif 6 H
δ = 1,86-1,48 ppm
singulet 1 H
δ = 3,38 ppm
triplet 1 H
δ = 4,5 ppm
6. Proposer un mécanisme pour la formation de C.
La formation de C débute par la formation du cation envisagée à la question 3.
Ensuite il y a addition nucléophile du méthanol et réaction acide base pour donner
C.
O
HHH
O
H3C
O
HHH
H3COHO
HHH
O
H3C
H− H
7. Le composé C présente-t-il des stéréoisomères ?
Le composé C possède un atome de carbone symétrique, il y a deux isomères
possibles.
Combien de formules tridimensionnelles peut-on écrire ?
Nous pouvons donc écrire deux formules tridimensionnelles correspondant à deux
structures énantiomères.

32ème OIC Épreuve de sélection — Corrigé 3
Combien de stéréoisomères sont obtenus lors de la réaction ? En quelles proportions ? Justifier
le raisonnement.
Ces deux composés sont obtenus en proportions égales car les attaques du méthanol
sur chaque face énantiotopique du plan local sont équiprobables.
O
HHH
H3COH
− H
O
MeO
O
OMeO
MeO
8. Quel est le nom de la transformation effectuée ?
Réaction de Williamson (formation d’un éther oxyde)
9. Quelle est la nature du produit intermédiaire obtenu après traitement de A par l’hydrure de
sodium ?
Alcoolate double (déprotonation par les ions hydrure, base forte)
O
O
O
O
O
O2 H −
− 2 H2
10. Structure de D et mécanisme de la réaction conduisant à D ? Justifier la réponse.
Le mécanisme est de type 2
N
S, substitution nucléophile bimoléculaire car l’atome
de carbone du composé halogéné est primaire, le groupe partant acceptable et le
nucléophile excellent (dans le DMF).
O
O O
O
OTHP
OTHP
O
O OTHP
Cl
O
O
O
deux fois
Justifier le choix du DMF, solvant polaire non protogène.
Le DMF, solvant polaire non protogène, ne solvate pas les anions et donc, les rend
plus nucléophiles.
11. Quel est le groupe caractéristique ainsi mis en évidence dans E ?
Bande caractéristique de la vibration d’élongation de la liaison
H
O−
dans un
groupe OH d’alcool.
12. Quelle est la structure du composé E ? Représenter sa formule semi-développée.
Il y a eu déprotection du groupe OH. Le composé E est le diol correspondant à D.

32ème OIC Épreuve de sélection — Corrigé 4
O
O O
O
OTHP
OTHP
OH+
O
O O
O
OH
OH
O
13. Quel a été l’intérêt de la protection du groupe OH masqué dans B ?
Le groupe OH terminal aurait pu être déprotoné par échange avec l’alcoolate issu
de B. Il y aurait eu des produits parasites dans la formation de D.
14. Par analogie avec la réaction d’acylation d’un alcool conduisant, à partir d’un chlorure
d’acyle, à un ester, proposer un mécanisme à la réaction de formation d’un tosylate (ou
paratoluènesulfonate d’alkyle).
Il y a addition nucléophile de l’alcool sur l’atome de soufre électrophile, suivi du
départ de l’ion chlorure et d’une réaction acide-base quantitative.
ArS
O
O
Cl
ROHAd. Nuc. S
O
O
Cl
O
H
R
Ar
OS
O
O
Ar
H
R
− Cl −
OS
O
O
Ar
H
Rpy
Ac. B
− pyH+
OS
O
O
Ar
R
15. Quel est le rôle de la pyridine ?
Déprotoner l’intermédiaire réactionnel. Ainsi le milieu n’est pas acide, ce qui peut
être préjudiciable à la survie de l’alcool. Par ailleurs, la pyridine peut jouer le rôle
d’activateur nucléophile en formant un ion sulfonylpyridinium qui réagit plus vite
que le chlorure de sulfonyle.
16. Donner la formule semi-développée de F. On notera
OTs
le groupe 3463 SOHCCH
−
−
.
F est le ditosylate correspondant à E :
O
O O
O
OH
OH
OTsCl
O
O O
O
OTs
OTs
O
EF
17. Le mécanisme de la réaction est analogue à celui de la formation de E (le groupe
OTs
est
un excellent groupe partant). Sachant que le composé H possède 2 cycles (en plus des cycles
tétrahydropyraniques des groupes OTHP) et que sa formule brute est 156438 OHC, en déduire la
structure de H.

32ème OIC Épreuve de sélection — Corrigé 5
G est déprotoné sur les deux groupes OH, il se forme un dianion qui réagit avec les
deux atomes de carbone portant les groupes OTs par substitution nucléophile. Il y a
donc formation d’un composé cyclique (la seconde réaction est intramoléculaire) :
O
O O
O
OTs
OTs
O
FG'
O
O O
O
OTHP
OTHP
O
O
O
O
O
OO
O
O
O
O
O
OO
O
O
O
double SN2
H
18. Représenter le composé J ainsi isolé.
J et H ont la même structure générale, à la nature des groupes terminaux près
(OTHP remplacé par OTs).
OTs
OTs
O
OO
O
O
O
O
O
OO
O
J
 6
6
 7
7
 8
8
1
/
8
100%