Devoir surveillé n° 6 - Sciences physiques TSI-1 Pierre

TSI 1 2011-2012
Lycée Pierre-Paul Riquet
Devoir surveillé n° 6
Durée : 4h
Mécanique :
Exercice n°1 : Partie A du sujet Mines d’Albi 2005
Étude dans le référentiel du laboratoire.
Le mouvement est étudié dans le référentiel du
laboratoire assimilé à un référentiel galiléen et
associé à un repère (O,
X
e
,
Y
e
,
Z
e
). Un palet M de
masse m peut se mouvoir sans frottement dans le
plan (O, x, y) horizontal (table à coussin d’air par
exemple). Le champ de pesanteur est suivant la
verticale Oz :
g
= –g
Z
e
(avec g > 0).
Le palet M est accroché à l’extrémité d’un ressort
(point M) de longueur à vide ℓ0, de raideur k, dont
l’autre extrémité est fixée en O.
La position de M est repérée dans la base (
X
e
,
Y
e
)ou
dans la base (
r
e
,
e
).
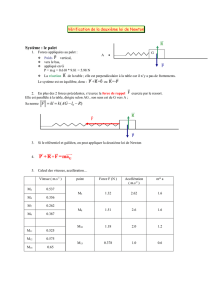
1) Faire un bilan des forces. Montrer qu’il y a conservation du moment cinétique
O
L
, par rapport à
O.
2) À t = 0, le palet est lâché, sans vitesse initiale, d’une longueur 1,2.ℓ0 :
X
etOM 0
2.1)0(
a) Calculer
O
L
. Quelle est la nature de la trajectoire ?
b) Déterminer l’évolution temporelle de la longueur du ressort, ℓ(t) = OM(t). Préciser l’intervalle
de variation de ℓ, longueur du ressort.
3) On lance la particule d’un point
X
etOMOM 10 )0(
avec une vitesse
Y
ev
10
. Dans
la suite, on travaillera en coordonnées polaires dans le plan (O, x, y).
a) Préciser
O
L
en fonction r(t) et
dt
d
puis en fonction des conditions initiales et des vecteurs de
base. On notera L le module de
O
L
.
b) Rappeler l’expression de l’énergie potentielle élastique. Doit-on tenir compte de l’énergie
potentielle de pesanteur pour étudier le mouvement ? Montrer qu’il y a conservation de
l’énergie mécanique EM. Préciser l’expression de EM en fonction des conditions initiales, en
fonction de r(t),
dttdr )(
,
dt
d
, m, k et ℓ0.
c) Montrer que l’énergie mécanique peut s’écrire :
)(
2
1,
2rErmE effpM
. Expliciter Ep,eff(r) et
représenter le graphe de Ep,eff(r).
d) Le palet peut-il s’éloigner indéfiniment du pôle d’attraction ?
e) La vitesse de la particule peut-elle s’annuler au cours de son mouvement ?
4) On cherche à déterminer une condition entre ℓ1 et pour avoir un mouvement circulaire. Montrer
que dans ce cas, le mouvement est uniforme. Déterminer ℓ1 en fonction de k, ℓ0 et . Est-elle
valable pour tout ?

TSI 1 2011-2012
Lycée Pierre-Paul Riquet
Exercice n°2 : Extrait du sujet Mines d’Albi 2007

TSI 1 2011-2012
Lycée Pierre-Paul Riquet
Chimie :
Exercice n° 1 : agro véto 2007
Un mode de préparation industrielle du dihydrogène met en jeu la réaction en phase gazeuse,
d’équation suivante : CH4 + H2O = CO + 3 H2
La réaction se déroule sous une pression totale constante, Ptot = 10 bar.
La température du système demeure constante et telle que la constante d’équilibre K° est égale à 15.
Initialement, le système contient 10 moles de méthane, 30 moles d’eau, 5 moles de monoxyde de
carbone et 15 moles de dihydrogène.
1) Exprimer la constante d’équilibre en fonction des pressions partielles des constituants et de P° = 1
bar.
2) Exprimer le quotient de réaction Qr en fonction de la quantité de matière de chacun des
constituants, de la pression totale Ptot et de P°. Calculer la valeur de Qr à l’instant initial.
3) Le système est-il en équilibre thermodynamique ? Justifier la réponse.
4) Si le système n’est pas en équilibre, dans quel sens se produira l’évolution ? Justifier brièvement
la réponse.
5) Selon votre réponse à la question 4), donner sans la résoudre l’équation permettant de déterminer
l’état d’équilibre final.
Exercice n°2 : pH du sang et effort musculaire à T = 37°C (inspiré de CCP TSI 2005)
L’acide lactique (CH3-CHOH-COOH) est un monoacide faible de constante d’acidité Ka = 1,38.10-4.
H2CO3(aq) est un diacide faible de constantes d’acidité :
Ka1(H2CO3/HCO3-)= 4,3.10-7 et Ka2(HCO3-/CO32-)= 5,6.10-11
Produit ionique de l’eau à 37°C: Ke = 2,4.10-14
Dans le sang d’une personne au repos, les concentrations en HCO3 - et H2CO3 sont respectivement de
0,027 mol.L-1 et 0,0014 mol.L-1.
1) D’où proviennent les espèces carbonées présentes dans le sang ?
2) Calculer le pH du sang, à l’état de repos.
3) Montrer que l’espèce CO32- est négligeable.
4) Au cours d’efforts physiques importants, il se forme de l’acide lactique, noté HA dans les muscles.
Cet acide passe dans le sang où pour être éliminé, il doit être transformé en ions lactates, notés A-,
par la réaction HA + HCO3- = H2CO3 + A-. Calculer sa constante d’équilibre.
5) Après un effort violent, l’acide lactique passe dans le sang à raison de 0,003 mol.L-1.
a) Indiquer le sens de variation du pH dans le sang.
b) Calculer les concentrations à l’équilibre des espèces H2CO3, HCO3-, HA et A-.
c) Calculer le pH du sang après cet effort.
6) Ce pH est en fait régulé par les concentrations des espèces carbonées. A votre avis comment ?
1
/
3
100%