Épidémiologie moléculaire des avipoxvirus chez l`Outarde houbara

En vue de l'obtention du
DOCTORAT DE L'UNIVERSITÉ DE TOULOUSE
Délivré par :
,QVWLWXW1DWLRQDO3RO\WHFKQLTXHGH7RXORXVH,137RXORXVH
Discipline ou spécialité :
3DWKRORJLH7R[LFRORJLH*pQpWLTXHHW1XWULWLRQ
Présentée et soutenue par :
M. GUILLAUME LE LOC'H
OHOXQGLDYULO
Titre :
Unité de recherche :
Ecole doctorale :
(3,'(0,2/2*,(02/(&8/$,5('(6$9,32;9,586&+(=
/287$5'(+28%$5$
6FLHQFHV(FRORJLTXHV9pWpULQDLUHV$JURQRPLTXHVHW%LRLQJpQLHULHV6(9$%
,QWHUDFWLRQV+{WHV$JHQWV3DWKRJqQHV,+$3
Directeur(s) de Thèse :
067(3+$1(%(57$*12/,
00(&+5,67(//(&$086%28&/$,19,//(
Rapporteurs :
0*$%5,(/(625&,81,9(56,7('(%285*2*1(
0*(5'6877(5/8':,*0$;,0,/,$1681,9(56,7$7081&+(1
Membre(s) du jury :
0&+5,6723+(3$648,(5&+8728/286(3UpVLGHQW
0PH&+5,67(//(&$086%28&/$,19,//((&2/(1$7,21$/(9(7(5,1$,5('(728/286(0HPEUH
00,&+(/6$,17-$/0(086(80'+,672,5(1$785(//(0HPEUH
03$6&$/$51((190$,621$/)2570HPEUH
067(3+$1(%(57$*12/,(&2/(1$7,21$/(9(7(5,1$,5('(728/286(0HPEUH

i
Remerciements
Je remercie tout d’abord les bailleurs de fond des programmes de conservation
d’outardes houbaras, son Altesse Cheikh Mohamed bin Zayed Al Nahyan, Prince Héritier
d'Abou Dhabi et président de l’International Fund for Houbara Conservation (IFHC), son
Excellence Mohammed Al Bowardi vice-président de l’IFHC, son Altesse Cheikh
Mohamed bin Rashid Al Maktum, fondateur de l’Emirates Centre for Conservation of
Houbara (ECCH) et Mohamed Beljafla, directeur de l’ECCH. Je remercie également
Jacques Renaud, fondateur de RENECO.
Merci à Gabriele Sorci et Gerd Sutter d’avoir accepté d’être rapporteurs de ce
travail, à Christophe Pasquier, Michel Saint Jalme et Pascal Arné d’avoir accepté de faire
partie de mon jury, et à Philippe Jacquiet et Thierry Baldet d’avoir fait partie de mon
comité de thèse.
Merci à Frédéric Lacroix, directeur exécutif de RENECO qui a accepté, malgré
toutes les contraintes que cela impliquait quant à mon travail chez RENECO, que je
réalise cette thèse. Merci de m’avoir permis de réaliser ce travail et d’avoir mis à ma
disposition tous les moyens nécessaires à sa réalisation.
Merci à Stéphane Bertagnoli et Christelle Camus-Bouclainville d’avoir accepté de
me diriger pendant ces trois années et demie. Merci pour votre disponibilité et le temps
que vous avez pu me consacrer. Merci Stéphane pour tes mille idées et merci Christelle
d’avoir remis Stéphane dans le droit chemin par moment.
Merci à Jean-Luc Guérin qui m’a accueilli au sein de cette équipe où je me suis
toute de suite senti bien. Merci pour tes conseils avisés et ta disponibilité, et merci pour
la suite…
Merci à Pascal Arné qui me suit depuis de nombreuses années, m’a poussé à
suivre ma passion des oiseaux puis m’a poussé vers la recherche.
Merci à Mariette Ducatez, Mathilde Paul et Guillaume Croville d’avoir chacun à
leur tour partagé leur science et de m’avoir consacré leur temps précieux sans compter.

ii
Merci à Maxence Delverdier pour les analyses histologiques des lésions, à Yves
Hingrat pour ses relectures et ses conseils, à Carole Heyd pour les différentes cartes et à
Alexandre François pour nos tentatives de travailler sur les insectes vecteurs.
Merci à Florian Grard d’avoir été un appui fiable et solide quand j’étais loin de
Toulouse et merci à Mam-Noury Amadou Souley pour sa participation à une partie du
travail de thèse.
Merci à Josyane Loupias et Brigitte Peralta pour leur aide technique et à toute
l’équipe IHVV de l’UMR 1225 pour son accueil chaleureux lors de mes brefs passages et
pour avoir su montrer patience et disponibilité.
Merci à Mar Carrasco, Imane Smaïni, Mohamed Tangarfi, Mohamed Abdessamad,
Angel Perez-Grimaldi, Mohamed Idendel, Hassan Chadli et toutes les équipes élevage et
vétérinaire des projets de conservation de m’avoir aidé en collectant ces nombreuses
données et en m’apportant leur appui.
Merci à Adeline, Guillaume et Pipou de m’avoir offert gîte, couvert et amour lors
de mes passages sur Toulouse. Merci aussi à Clément et ses colocs de m’avoir permis de
me sentir à nouveau étudiant et merci à Pauline de m’avoir accueilli malgré ses travaux.
Merci à Gwen, Eric, Pierre, Yves, Romain, Delphine, Marjorie, Jérôme, Chloé,
Sylvain, Juan, Imane, Latifa, Clio, Benoît, Nicolas et tous les Missouris et Enjilois d’avoir
fait de ces années au Maroc une magnifique page de notre vie. Merci à Mar(iquita),
Cédric, Toni de m’avoir accueilli loin du Maroc et de la France.
Delphine, merci d’avoir été là, même quand je n’étais pas là ! Mariette, merci pour
ton incisivité ! Florian, merci pour ton humour ! Merci pour votre amitié.
Et pour finir, je ne remercierai jamais assez celle qui accepte depuis des années
de me suivre pour le meilleur et pour le pire. Merci Aurélie pour n’avoir jamais cessé de
me pousser à réaliser mes rêves même quand cela impliquait des sacrifices pour toi.
Merci d’avoir accepté mes absences pendant ces années. Merci pour ton amour. Merci de
nous avoir donné deux magnifiques enfants, Camille et Mathilde.

iii
Table des matières
LISTE DES FIGURES ................................................................................................................................................ V
LISTE DES TABLEAUX ........................................................................................................................................... VII
LISTE DES ABREVIATIONS ................................................................................................................................. VIII
CHAPITRE I : INTRODUCTION ............................................................................................................................... 1
A. LES AVIPOXVIRUS .................................................................................................................................................... 1
1. Structure et caractéristiques ........................................................................................................................... 1
2. Taxonomie, évolution et phylogénie ............................................................................................................. 7
3. Variole aviaire ...................................................................................................................................................... 12
i. Épidémiologie ........................................................................................................................................ 12
ii. Clinique ..................................................................................................................................................... 16
B. L’OUTARDE HOUBARA ......................................................................................................................................... 21
1. Taxonomie et distribution ............................................................................................................................... 21
2. Biologie .................................................................................................................................................................... 21
3. Conservation .......................................................................................................................................................... 23
4. Élevage ..................................................................................................................................................................... 27
5. Gestion sanitaire .................................................................................................................................................. 31
i. Épidémiosurveillance ......................................................................................................................... 32
ii. Prophylaxie ............................................................................................................................................. 33
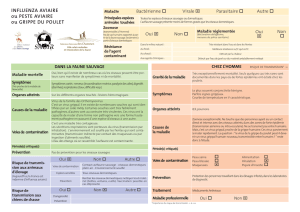
6. Variole aviaire et Outarde houbara ........................................................................................................... 34
C. OBJECTIFS DE RECHERCHE.................................................................................................................................. 38
CHAPITRE II : PARTIE EXPERIMENTALE ........................................................................................................... 41
A. ÉPIDEMIOLOGIE DE LA VARIOLE AVIAIRE EN ELEVAGE CONSERVATOIRE D’OUTARDES HOUBARA ......... 41
1. Contexte ................................................................................................................................................................... 41
2. Problématique et objectifs .............................................................................................................................. 42
3. Démarche expérimentale ................................................................................................................................ 43
i. Population ................................................................................................................................................ 43
ii. Collecte des données ........................................................................................................................... 43
iii. Indicateurs calculés ............................................................................................................................. 45
iv. Analyse moléculaire ............................................................................................................................ 47
4. Article 1 .................................................................................................................................................................... 48
5. Conclusion ............................................................................................................................................................... 61
i. Manifestations cliniques .................................................................................................................... 61
ii. Facteurs climatiques ........................................................................................................................... 62
iii. Espèce et captivité ................................................................................................................................ 62
iv. Age et statut vaccinal........................................................................................................................... 63
B. IMPACT DE LA VARIOLE AVIAIRE SUR LES PERFORMANCES DE L’OUTARDE HOUBARA EN ELEVAGE ...... 65
1. Contexte ................................................................................................................................................................... 65
2. Problématique ...................................................................................................................................................... 65
3. Démarche expérimentale ................................................................................................................................ 66
i. Choix effectués ....................................................................................................................................... 66
ii. Matériel et méthodes .......................................................................................................................... 67
(a) Populations et période d’étude .................................................................................................. 67
(b) Variables dépendantes : performances de reproduction ............................................... 68
(c) Variables explicatives : variole aviaire et variables confondantes. ............................ 68
(d) Analyse statistique .......................................................................................................................... 70
4. Résultats .................................................................................................................................................................. 72
i. Description des variables .................................................................................................................. 72
ii. Analyse statistique ............................................................................................................................... 74
5. Discussion et conclusion ................................................................................................................................... 77

iv
C. DIVERSITE ET EVOLUTION DES AVIPOXVIRUS .................................................................................................. 81
1. Contexte ................................................................................................................................................................... 81
2. Problématique et objectifs .............................................................................................................................. 81
3. Démarche expérimentale ................................................................................................................................ 82
i. Prélèvements .......................................................................................................................................... 82
ii. PCR, séquençage et analyses bio-informatiques ...................................................................... 84
4. Article 2 .................................................................................................................................................................... 87
5. Article 3 ................................................................................................................................................................. 104
6. Conclusion ............................................................................................................................................................ 117
i. Diversité et origine des souches virales ................................................................................... 117
ii. Coïnfection, recombinaison et spécificité d’hôte .................................................................. 119
D. INFECTIONS EXPERIMENTALES ....................................................................................................................... 121
1. Contexte ................................................................................................................................................................ 121
2. Problématique et objectifs ........................................................................................................................... 122
3. Démarche expérimentale ............................................................................................................................. 123
i. Choix de la souche ............................................................................................................................. 123
ii. Choix des oiseaux ............................................................................................................................... 124
iii. Choix du mode opératoire .............................................................................................................. 125
iv. Matériel et méthodes ....................................................................................................................... 125
(a) Virus ................................................................................................................................................... 125
(b) Oiseaux et infections ................................................................................................................... 126
(c) Suivi des oiseaux ........................................................................................................................... 127
(d) PCR quantitative ........................................................................................................................... 128
(e) Hématologie et électrophorèse des protéines plasmatiques ..................................... 129
(f) Histologie ......................................................................................................................................... 130
(g) Analyses statistiques ................................................................................................................... 130
4. Résultats ............................................................................................................................................................... 131
i. Mise en place de la PCR quantitative ......................................................................................... 131
ii. Infections avec l’inoculum issu d’une semi-purification virale ...................................... 132
(a) Expression clinique ..................................................................................................................... 132
(b) Virémie .............................................................................................................................................. 135
(c) Analyses moléculaires et histologiques des lésions ....................................................... 135
iii. Infections avec l’inoculum issu d’un broyat de lésion ........................................................ 136
(a) Expression clinique ..................................................................................................................... 136
(b) Poids et consommations d’aliments ..................................................................................... 138
(c) Paramètres hématologiques .................................................................................................... 139
(d) Analyses moléculaires et histologiques des lésions ....................................................... 139
5. Discussion et conclusion ................................................................................................................................ 141
i. Reproduction de la maladie ........................................................................................................... 141
ii. Expression clinique et modifications physiologiques ........................................................ 143
iii. Conclusion ............................................................................................................................................ 147
CHAPITRE III : DISCUSSION ET PERSPECTIVES ............................................................................................... 148
A. TAXONOMIE DES AVIPOXVIRUS ....................................................................................................................... 149
B. ÉCOLOGIE DES AVIPOXVIRUS ........................................................................................................................... 151
C. APPORT A LA GESTION SANITAIRE D’ELEVAGES CONSERVATOIRES .......................................................... 155
1. Prophylaxie sanitaire ..................................................................................................................................... 155
2. Prophylaxie médicale ..................................................................................................................................... 156
3. Prise en charge médicale .............................................................................................................................. 157
4. Déplacements d’oiseaux ................................................................................................................................ 158
5. Évaluation des risques et surveillance épidémiologique ............................................................... 158
D. CONCLUSION ...................................................................................................................................................... 159
BIBLIOGRAPHIE ................................................................................................................................................ 160
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
1
/
185
100%