Des éléments de réponse

Biotechnologies 1re STL
– CRDP Aquitaine, 2012
Thème 3 – Chapitre 3 – Activité 1.
IDENTIFIER UN MICROORGANISME DANS UN PRÉLÈVEMENT URINAIRE
Éléments de réponse
1re partie
1.
2. Observation microscopique du frottis coloré à l’aide de l’objectif X100 et sous huile à immersion.
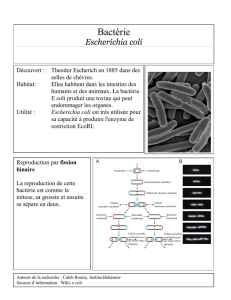
Observation de bactéries en forme de bâtonnets, de quelques micromètres de longueur et colorées en
rose car Gram négative.
3. L’urine contient plus de 10 000 leucocytes/mL et plus de 105 UFC/mL. Ces deux éléments signent une
infection urinaire.
4. L’urine est normalement un liquide biologique stérile ; la présence d’un très grand nombre de bactéries
dans ce liquide biologique (plus de 105 UFC/mL) suffit à diagnostiquer l’infection, sans qu’il soit
indispensable de connaître l’espèce bactérienne.
5. L’identification de l’espèce bactérienne permet de déterminer l’origine de l’infection.
6.1.
Les antibiotiques présents dans les disques diffusent dans la gélose Muller-Hinton et leur présence peut
inhiber la croissance de la souche bactérienne ensemencée en nappe sur la gélose.
Sur l’urine « entière »
- Examen macroscopique
- Dénombrement des leucocytes et des globules
rouges en cellules de comptage (hématimètre)
- Dénombrement des microorganismes avec une
lame immergée ou sur gélose Cled et anse
calibrée incubation 24
h à 37°C
Centrifugation de l’urine
Sur le culot urinaire
Coloration de Gram et
observation
microscopique des
microorganismes.
Lecture de la lame immergée ou de la gélose Cled et
détermination du nombre de microorganismes dans
l’urine.
À partir d’une colonie isolée ensemencement d’une
galerie miniaturisée pour identification de l’espèce
bactérienne.
Incubation 24
h à 37°C.
Lecture de la galerie miniaturisée et identification de
l’espèce bactérienne
Jour 1
Jour 2
Jour 3
Recueil des urines – Conservation à 4
°C

Biotechnologies 1re STL
– CRDP Aquitaine, 2012
6.2. Antibiotique Diamètre en mm Résultats
Antibiotique 1
sensible
Antibiotique 2
résistant
Antibiotique 3
intermédiaire
6.3.
Dans le document 1,
E.coli
, responsable de l’infection urinaire, est sensible à tous les antibiotiques testés.
6.4.
Le médecin pourra prescrire n’importe lequel de ces antibiotiques pour traiter l’infection urinaire
diagnostiquée.
2e partie
1. Le signe « ? » signifie que le résultat de la mobilité est inconnu pour l’espèce bactérienne identifiée. Pour
déterminer la mobilité il faut mettre en œuvre l’examen microscopique nommé « état frais ».
2.1.
Le caractère oxydase est déterminé par la mise en œuvre du test enzymatique du même nom. Les
caractères OF/O et OF/F sont déterminés par ensemencement puis incubation d’une gélose VF
régénérée.
2.2.
Après 24 h à 37°C il y aura présence de colonies bactériennes dans la totalité de la gélose VF.
2.3.
Le type respiratoire de E.coli est aéro-anaérobie.
3.1.
Ensemencer une gélose Hugh et Leifson ou CTA régénérée et additionnée de chaque glucide stérile à
étudier à une concentration finale de 1 %.
3.2.
Il existe plusieurs voies de fermentation du glucose. Si le test VP est négatif c’est que E.coli fermente le
glucose par une autre voie comme celle des acides mixtes (test RM) absent de la galerie API20E.
3.3.
Si E.coli est ONPG+ cela signifie qu’elle possède l’enzyme nommée béta-galactosidase.
3.4.
Le substrat naturel ce et enzyme est le lactose.
3.5.
Le milieu choisi doit contenir du lactose (substrat de l’enzyme) et un indicateur de pH permettant de
visualiser la dégradation du lactose par acidification du milieu. Deux milieux peuvent être choisis : Mac
Conkey et BCP, le milieu Mac Conkey contient en plus des inhibiteurs des bactéries Gram + (sels biliaires
et cristal violet) ce qui le rend sélectifs des bactéries Gram - (cas de E.coli).
3.6.
Mac-Conkey : colonies beiges entourées d’un halo rouge (teinte acide de l’indicateur de pH car
dégradation du lactose par la bactérie).
BCP : colonies beiges entourées d’un halo jaune (teinte acide de l’indicateur de pH car dégradation du
lactose par la bactérie).
4.1.1.
Milieu de culture synthétique : milieu de culture dont la composition qualitative et quantitative est
exactement connue.

Biotechnologies 1re STL
– CRDP Aquitaine, 2012
4.1.2.
Urée : substrat de l’uréase
Tryptophane ; substrat de la tryptophanase et de la tryptophane désaminase.
4.1.3.
L’urée est dégradée en CO2 et NH3 ; le tryptophane est dégradé en indole, acide pyruvique et ammoniac
par la tryptophanase ou en acide indolpyruvique et ammoniac par la tryptophane désaminase.
4.1.4.
Le nom plus approprié serait urée-tryptophane car il fait référence aux deux substrats présents dans le
milieu.
4.1.5.
Pour mettre en évidence la présence de tryptophanase, on rajoute le réactif de Kovacs dans la cupule du
test «IND ».
4.1.6.
Formation d’un anneau rouge dans la cupule du test IND, car le réactif de Kovacs réagit avec l’indole et
forme un composé rouge en sa présence, or E.coli est IND +.
4.2.
Le caractère biochimique mis en évidence est la présence d’une protéase nommée gélatinase.
4.3.1.
A = arginine ; L = lysine ; O = ornithine.
4.3.2.
Cupule LDC api positive : coloration orange à rouge due à l’alcalisation du milieu par libération de l’amine
issue de la décarboxylation de la lysine.
Moeller LDC positif : milieu trouble (culture) + teinte violette du BCP due à la réalcalinanisation du milieu
lié à la libération de l’amine issue de la décarboxylation de la lysine.
4.3.3.
Dans la cupule LDC on peut faire l’hypothèse que le tampon acide remplace le glucose du milieu de
Moeller, ce qui permet d’être immédiatement en milieu acide, condition favorable à la synthèse de la lysine
décarboxylase.
1
/
3
100%