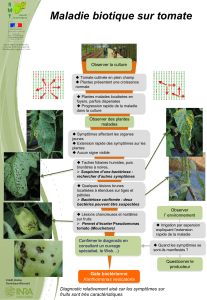
Organogenèse et embryogenèse somatique directe chez la tomate

REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE.
MINISTERE DE L’ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE SCIENTIFIQUE.
UNIVERSITE D’ORAN
FACULTÉ DES SCIENCES
DÉPARTEMENT DE BIOLOGIE
LABORATOIRE DE BIOTECHNOLOGIE DES RHYZOBIUMS ET
AMELIORATION DES PLANTES.
MEMOIRE
POUR L'OBTENTION DU TITRE DE MAGISTER EN AMELIORATION DES PLANTES
Par
LACHACHI SARA
Jury composé de:
President: Mr. Bekki A. Professeur Université d’Oran
Rapporteur: Mme. Fyad-Lameche F/Z. . Professeur Université d’Oran
Examinateur: Mr. Lothmani B. Maitre de conférence Université de Mostaganem
Examinateur: Mr. Hadjadj-Aoul Seghir. . Maitre de conférence Université d’Oran
Examinateur: Mr. Henni J. Professeur Université d’Oran
2009/2010
Organogénèse et embryogénèse
somatique directe chez la tomate.

Remerciement
RemerciementRemerciement
Remerciement
Ce mémoire a été accompli sous la direction de Mme Fyad-
Lameche F/Z, Professeur à l’Université d’Oran Es-Sénia. Je tiens à lui
exprimer ma plus profonde reconnaissance pour m´avoir épaulé tout
au long de ce travail, pour m´avoir fait profiter de ses connaissances
et pour son soutien précieux lors de la rédaction de ce mémoire malgré
ses très nombreuses charges.
Je souhaite remercier également toute
l’équipe du laboratoire de génétique et amélioration des plantes pour l’aide,
le temps et l’attention qu’ils m’ont accordés pendant ces années.
Ma gratitude et mes vifs remerciements vont aussi à Mr
Bekki
Abdelkader, Professeur au Département de Biotechnologie de
l’Université d’Oran Es-Sénia qui n’a pas hésiter à présider le jury de ce
mémoire.
J’exprime aussi mes vifs remerciements à Mr Lothmani B,
Professeur à l’Université de Mostaganem, Mr Hadjadj A, Professeur à
l’Université d’Oran Es-Sénia et à Mr Henni J, Professeur à l’Université
d’Oran Es-Sénia de me faire l’honneur de participer à mon jury de
thèse.
Je voudrais remercier mon père, ma mère, mes frères, pour tout le
soutien, la confiance et leurs mots d´encouragement qu´ils m´ont
accordés.
Mais surtout à toi, Djawed mon mari, mon confident, mon
partenaire. Merci pour ton soutien, ta patience et tes encouragements.
Enfin, merci à toute l’équipe du laboratoire de génétique et
amélioration des plantes qui m’a accueillie chaleureusement. Je
garderai un merveilleux souvenir de leur amitié et de leur aide.


Table des matières
Chapitre I : Généralités sur la tomate
Introduction 1
I.1- Introduction 2
I.2- Intérêt de la culture de tomate 3
I.2.1- Alimentation humaine 3
I.2.2- Phytothérapie 3
I.3- Importance économique de la plante 4
I.3.1- Dans le monde 4
I.3.2- En Algérie 5
I.4- Origine phylogénétique de la plante 6
I.5- Les variétés cultivées 7
I.6- Biologie de la tomate 11
I.6.1- Morphologie de la plante 11
I.6.2- La biologie florale 11
I.6.3- La fructification et la maturation des tomates 12
I.6.4- La graine 12
I.6.5- La pollinisation des tomates 13
I.6.6- Types de croissance des pieds de tomates 14
I.6.6.1- Croissance indéterminée 14
I.6.6.2- Croissance déterminée 14
I.6.6.3- Croissance semi déterminée 14
I.7- Problèmes phytosanitaires 15
I.7.1-Variétés résistantes 15
I.7.2- Amendements organiques et minéraux 15
I.7.3- Moyens de lutte biologique 16
I.8- Amélioration de la plante et culture in vitro 16
I.8.1- Amélioration de la tomate pour la résistance aux maladies 17
I.8.2- Amélioration de la tomate pour la résistance à la sécheresse 17
I.8.3- Amélioration de la qualité gustative des tomates 17

Chapitre II : La culture in vitro
II.1- Introduction 20
II.2- Qu'est-ce que la culture in vitro? 21
II.2.1- Définition 21
II.2.2- Historique et fondement de la culture in vitro 21
II.2.2.1- Historique 21
II.2.2.2- Fondement 22
a- La différenciation 22
b- La dédifférenciation 23
c- La totipotence 24
II.3- Les applications de la culture in vitro 24
II.3.1- Le sauvetage d'embryons 24
II.3.2- La micropropagation 24
II.3.2.1- Cultures de méristème 25
II.3.2.2- Organogenèse 26
a-
Caulogenèse
26
b- Rhizogenèse 27
II.3.2.3- L'embryogenèse somatique 27
II.3.3- Production de plantes haploïdes 28
II.3.4- Culture et fusion des protoplastes 28
II.3.5- La variation somaclonale et la culture in vitro 28
II.4- Les bénéfices de la culture in vitro 29
II.4.1- Collection de génotypes et état physiologique du matériel conservé 29
II.4.2- Obtention de matériels indemnes de maladies 30
II.4.3- Développement de méthodes de production de plants 30
I.8.4- Les tomates OGM créées 18
I.8.4.1- Tomates transgéniques 1401F, H282F, 11013F et 7913F 18
I.8.4.2- Tomate transgénique 1345-4 19
I.8.4.3- Tomate transgénique contre le cancer 19
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
1
/
117
100%