Classe 2M12

Chapitre 4 : Les différentes liaisons chimiques
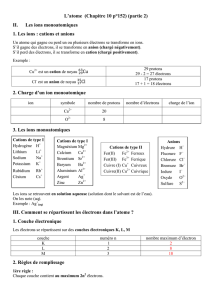
La liaison ionique
Introduisons du chlore (un non-métal) dans une éprouvette contenant du sodium (un
métal) :
Equation chimique :
Modèle de Bohr :
Na
Na
+ Cℓ
Cℓ
Na
Na
Cℓ
Cℓ
Structure électronique :
Structure d’un gaz rare ?
Nombre de protons :
Nombre d’électrons :
Charge :
Entité :
Classe :
Corps :
Nom :
Les ions sodium et chlorure sont de charge opposée : ils exercent
l’un sur l’autre une ............................. de nature .............................
et s’assemblent à l’état solide en une structure régulière à ............
dimensions appelée réseau ionique. Le composé obtenu, formé de
ions, est appelé composé ionique ou sel.
On peut donc poser la définition : sel = ............................................... .
La force de liaison entre ions, faible à l’état gazeux, forte à l’état solide, est appelée liaison ionique.

Comment trouver la charge d’un ion ?
Les exercices 1-4 laissent à penser que les ions n’ont toujours qu’une seule charge possible, et qu’elle est évidente à
trouver. Si cette affirmation est correcte pour les anions (à quelques rares exceptions près) et pour la majorité des
cations des groupes A, ce n’est par contre pas le cas pour les cations provenant des groupes B. En effet, comme leur
structure électronique est complexe, les métaux de transition peuvent perdre un nombre variable d’électrons. Les cations
ainsi formés n’auront général pas la structure d’un gaz rare… ce qui ne simplifie pas les choses. Heureusement, le
« Formulaire et Tables » fournit de précieuses indications.
Exemples :
pour le fluor (…………………………………………………), il existe …………………………………………………
pour le calcium (…………………………………………………), il existe ………………………………………………
pour le vanadium (…………………………………………………), il existe ……………………………………………
Comment trouver la charge d’un ion dans la formule d’un sel ?
Nous avons vu précédemment que la formule d’un sel peut être exprimée sans mentionner la charge des ions. Cela
allège l’écriture. Mais il faut malgré tout être capable de retrouver ces charges si nécessaire ; cela se fait par une
méthode en trois étapes.
Exemple : quelle est la charge des ions formant le sel Ni3N2 ?
1) Repérer où est le cation et où est l’anion
Normalement, le cation (ion positif) est écrit en premier. Mais l’auteur peut avoir choisi de positionner les ions par
ordre alphabétique ! Il est donc plus prudent de se souvenir de la règle suivante : lors de l’assemblage entre un métal et
un non-métal, le métal devient positif (cation) et le non-métal devient négatif.
Ainsi :
Le signe de la charge étant posé, sa valeur exacte doit être encore déterminée.
2) Trouver la charge exacte de l’anion
La charge de l’anion est facile à trouver : une seule valeur est possible. Cette valeur correspond au nombre d’électrons
que le non-métal reçoit pour atteindre la structure électronique d’un gaz rare.
Ainsi : L’atome d’azote N, qui possède ……… électrons de valence, en reçoit ……… supplémentaires pour
ressembler au gaz rare le plus proche et devient l’anion ………… .
La charge de l’anion Nb– peut aussi être lue dans le « Formulaire et Tables » (tableau périodique de la dernière
page) : selon le tableau, N peut avoir les charges ……………………………… . Nous savons que l’azote
devient négatif, il s’agit forcément de l’anion ……… .

3) Trouver la charge exacte du cation
On peut considérer qu’un sel résulte de la réaction entre des atomes initialement neutres. On a vu précédemment que
tous les électrons perdus par un élément (le métal) lorsqu’il devient cation sont récupérés par l’autre élément (le non-
métal) qui devient anion. Ainsi donc, la charge globale lors de la formation d’un sel reste ………………… .
Cette propriété permet de déduire la charge exacte du cation Nia+ :
La somme des charges négatives faisant …………………… , la somme des charges positives doit compenser et arriver
à la valeur ………… . Cette charge étant répartie entre 3 cations (Nia+)3
(N3–)2, chaque cation est de charge ...…… .
Vérification : le tableau périodique du « Formulaire et Tables » indique bien le ion Ni2+ parmi les charges possibles.
Ainsi, Ni3N2 = …………………………… = ……………………………………………………………… .
Nomenclature des sels
Un sel peut être décrit à l’aide d’une formule, mais aussi d’un nom. Comment passer de la première à la seconde ?
FeI2= =
Formule chimique
sans les charges
Formule chimique
avec les charges
Nom
1) EN FRANÇAIS, tout commence par le nom de l’anion.
Le nom de l’anion est le nom de l’élément suivi du suffixe « -ure ».
Exemple : F– = fluorure.
Exceptions importantes : H– hydrure
O
2– oxyde
S
2– sulfure
N
3– nitrure
2) Cela continue par la préposition de
3) Cela se termine par le nom du cation.
Le nom du cation est le nom de l’élément complété par la mention de la charge, indiquée à l’aide d’un chiffre
romain. Si le « Formulaire et Tables » indique qu’il n’existe dans la nature qu’une seule charge pour le cation
considéré, cette mention est inutile.
Exemple : Cu2+ = cuivre (II) ou cuivre II
Mg2+ = magnésium.
1
/
3
100%