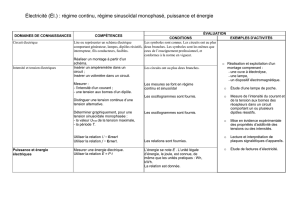
Atomes, molécules, et régime sinusoïdal forcé

Colles semaine 13, sujet A Langevin–Wallon, PTSI 2015-2016
Atomes, molécules, et régime sinusoïdal forcé
Question de cours
Définir sur un exemple de votre choix le moment dipolaire d’une molécule. Expliquer son origine physique.
Exercice 1 : Équivalence entre dipôles [♦]
A
B
L
CC
1 - Déterminer l’impédance complexe du dipôle AB représenté ci-contre.
2 - Peut-il être équivalent à une résistance ? une bobine ? un condensateur ? un fil ? un
interrupteur ouvert? Préciser le cas échéant la pulsation ou le domaine de pulsation où
c’est le cas.
Solution de l’exercice 1 :
1Détermination des impédances équivalentes :
Impédance de l’association LC série : (1 −LCω2)/jCω ;
Admittance de l’association avec C :
Y=jCω +jCω
1−LCω2=jCω 2−LCω2
1−LCω2d’où Z=1
jCω
1−LCω2
2−LCω2
2Équivalence de dipôle :
résistance : jamais car toujours imaginaire pur ;
bobine : possible si partie imaginaire positive, donc si 1/√LC ≤ω≤p2/LC ;
condensateur : possible si partie imaginaire négatives donc pour toutes les pulsations hors de l’intervalle ci-dessus ;
interrupteur ouvert : possible si dénominateur nul donc ω= 1/√LC ;
fil : possible si numérateur nul donc ω=p2/LC.
Exercice 2 : Propriétés oxydantes des dihalogènes [♦]
On souhaite comparer le pouvoir oxydant de différentes molécules de dihalogènes X2, où X est Cl, Br ou I. Pour
cela, on fait réagir des solutions de dihalogène avec des solutions d’halogénure de potassium (K++X–). Les observa-
tions expérimentales sont récapitulées dans le tableau à double entrée ci-dessous, qui indique si une transformation
chimique est observée.
Br2Cl2I2
Br–non OUI non
Cl–non non non
I–OUI OUI non
1 - Où se trouvent les éléments de la famille des halogènes dans la classification ?
2 - Donner la configuration électronique du chlore. En déduire l’ion monoatomique le plus stable qu’il peut former
et le couple redox impliquant le dihalogène et l’ion halogénure monoatomique. Mêmes questions pour le brome et
l’iode.
3 - Écrire l’équation de réaction associée à la tranformation observée lorsqu’un OUI est indiqué dans le tableau.
4 - Comparer le pouvoir oxydant des dihalogènes et proposer une explication simple à cette évolution.
Les dihalogènes sont faiblement solubles dans l’eau, mais fortement solubles dans le cyclohexane. Les solutions
de dihalogène ont les couleurs données dans le tableau ci-dessous, alors que les solutions aqueuses d’halogénures de
potassium sont incolores.
Solvant Br2Cl2I2
Eau incolore jaune jaune
Cyclohexane brun jaune pâle rose
1/11 Étienne Thibierge, 21 janvier 2016, www.etienne-thibierge.fr

Colles semaine 13, sujet A : Atomes, molécules, et régime sinusoïdal forcé Langevin–Wallon, PTSI 2015-2016
5 - Justifier la différence de solubilité des dihalogènes entre l’eau et le cyclohexane. Pourquoi l’énoncé ne mentionne-t-il
pas la couleur des solutions d’halogénures de potassium dans le cyclohexane ?
6 - Pourquoi est-il nécessaire d’utiliser un solvant comme le cyclohexane pour mettre en évidence les transformations
chimiques éventuelles entre dihalogènes et halogénures ?
7 - En se basant sur les informations précédentes, proposer un protocole expérimental pour mettre en évidence la
réactivité des dihalogènes vis-à-vis des ions halogénures.
Solution de l’exercice 2 :
1Avant dernière colonne.
2Numéro atomique Z= 17 (à retrouver) : 1s22s22p63s23p5. Forme Cl–pour obtenir la structure électronique de
l’argon. Couple redox Cl2/Cl–. Idem pour le brome et l’iode car même famille, donc mêmes propriétés.
3Demi-équations redox de la forme X2+ 2e= 2X−.
4En termes de pouvoir oxydant : Cl2>Br2>I2, à relier à l’électronégativité.
5Les dihalogènes sont des molécules apolaires, comme le cyclohexane. Les halogénures de potassium sont des
espèces ioniques qui ne sont pas solubles dans les solvants apolaires.
6Dans l’eau, Cl2et I2ont la même couleur.
2/11 Étienne Thibierge, 21 janvier 2016, www.etienne-thibierge.fr

Colles semaine 13, sujet B Langevin–Wallon, PTSI 2015-2016
Atomes, molécules, et régime sinusoïdal forcé
Questions de cours
1 - Établir les expressions des impédances complexes d’une résistance, d’une bobine et d’un condensateur.
2 - Nommer et donner les valeurs permises pour les nombres quantiques d’un électron dans un atome.
3 - Énoncer et nommer les règles permettant de déterminer la configuration électronique d’un atome dans son état
fondamental.
Exercice 1 : Chlorure de thionyle [♦♦]
Construire le schéma de Lewis du chlorure de thionyle SOCl2, où l’atome de soufre est l’atome central auquel
sont liés les trois autres atomes. Le soufre se trouve sous l’oxygène dans le tableau périodique.
Solution de l’exercice 1 :
Schémas de Lewis des atomes : S O Cl
Nombre d’électrons de valence : 6+6+2×7 = 26 ;
Nombre de doublets : 13 ;
Squelette :
Cl S
O
Cl
Liaisons multiples : si toutes les liaisons étaient simples, il faudrait 3×3 + 1 = 10 doublets non-liants pour que
tous les atomes respectent la règle de l’octet, ce qui correspond exactement au nombre de doublets qu’il reste à
attribuer.
Répartition des doublets, sans oublier les charges formelles :
Cl S⊕
O
Cl
Autre répartition, sans charge formelle mais dans laquelle le soufre est hypervalent :
Cl S
O
Cl
Comme le soufre fait partie de la troisième période, il peut sans problème être hypervalent. Ainsi, la seconde
représentation sans charge formelle est bien plus représentative de la structure réelle de la molécule que la première.
Exercice 2 : Équivalence entre dipôles RL [♦♦]
L0R0
L
R
Les dipôles ci-contre sont alimentés par une tension harmonique de pulsation ω.
1 - Déterminer en fonction de ωles valeurs de R0et L0pour lesquelles les deux dipôles sont
équivalents.
2 - Si l’on remplace la bobine L0par un condensateur C0, peut-il encore y avoir équivalence ?
Commenter.
Solution de l’exercice 2 :
1L’impédance complexe du montage en série vaut
Z0=ZL0+ZR0=jL0ω+R0
3/11 Étienne Thibierge, 21 janvier 2016, www.etienne-thibierge.fr

Colles semaine 13, sujet B : Atomes, molécules, et régime sinusoïdal forcé Langevin–Wallon, PTSI 2015-2016
De même, l’impédance complexe du montage en parallèle est telle que
1
Z=1
ZL
+1
ZR
=1
jLω +1
Rsoit Z=jRLω
R+jLω
Les deux dipôles sont équivalents s’ils ont les mêmes impédances complexes. Il suffit donc pour trouver R0et L0
d’identifier les parties réelle et imaginaire de Zet Z0. Écrivons donc Zsous forme algébrique,
Z=jRLω(R−jLω)
(R+jLω)(R−jLω)=RL2ω2
R2+L2ω2+jR2Lω
R2+L2ω2.
Ainsi, il y a équivalence entre les deux dipôles pour
R0=RL2ω2
R2+L2ω2et L0=R2Lω
R2+L2ω2.
Remarquez que les deux dipôles ne sont donc pas équivalents tout le temps, mais seulement pour une
valeur précise de fréquence ... et si R0et L0sont choisis aléatoirement il n’y a même aucune raison que
l’équivalence existe.
2Si L0est remplacée par un condensateur, l’impédance complexe de l’association série s’écrit
Z0=R0+1
jC0ω=R0−j1
C0ω
La condition d’équivalence obtenue par identification des impédances devient
R0=RL2ω2
R2+L2ω2et −1
C0ω=R2Lω
R2+L2ω2.
Néanmoins, comme toutes les grandeurs sont positives, la deuxième condition portant sur C0ne peut jamais être
vérifiée. Il n’est pas possible d’avoir équivalence entre les deux dipôles : un circuit capacitif est fondamentalement
différent d’un circuit inductif.
4/11 Étienne Thibierge, 21 janvier 2016, www.etienne-thibierge.fr

Colles semaine 13, sujet C Langevin–Wallon, PTSI 2015-2016
Atomes, molécules, et régime sinusoïdal forcé
Question de cours
Expliquer qualitativement le mécanisme microscopique de mise en solution d’une espèce chimique moléculaire ou
ionique et l’interpréter en termes de polarité, pouvoir dispersif et proticité du solvant.
Exercice 1 : Circuit en régime sinusoïdal forcé [♦]
e
u1 - Déterminer l’impédance complexe vue par le générateur imposant la tension e,
harmonique de pulsation ω.
2 - Établir l’équation différentielle vérifiée par la tension u.
3 - Déterminer la solution décrivant le régime permanent.
4 - Ce circuit peut-il être résonant ?
Solution de l’exercice 1 :
1Association parallèle :
Y=jCω +1
Rsoit Z=R
1 + jRCω
Association série avec la bobine :
Zéq =jLω +R
1 + jRCω =R1−LCω2+jLω
1 + jRCω
2Pont diviseur de tension :
U
E=jLω
jLω +R
1 + jRCω
puis
jLω U +R
1 + jRCω U=jLωE
et enfin
RU +jLω U + (jω)2RLC U =jLω E + (jω)2RLC E
On identifie alors
RLC d2u
dt2+Ldu
dt+Ru =Lde
dt+RLC d2e
dt2
3On repart de l’écriture complexe pour écrire
U
E=jLω −RLCω2
R(1 −LCω2) + jLω
Discussion en termes de module et phase. Discussion de la résonance, qui est de type résonance en tension du RLC.
Exercice 2 : Soufre et cinabre [♦]
Le soufre est connu depuis l’Antiquité, car on peut le trouver à l’état natif au voisinage des zones volcaniques.
C’est vers la fin des années 1770 qu’Antoine Lavoisier attribue au soufre le statut d’élément chimique. Le corps simple
se présente sous de nombreuses formes selon son mode d’obtention : cristaux ou aiguilles jaune pâle, poudre jaune
mat (fleur de soufre), etc.
5/11 Étienne Thibierge, 21 janvier 2016, www.etienne-thibierge.fr
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%