Neuralation et migration nucleaire intercinetique

/. Embryol. exp. Morph.
Vol.
34, 2, pp. 339-354, 1975
339
Printed in Great Britain
Neuralation
et
migration nucleaire intercinetique
chez des embryons de poulet
ParPAUL-EMIL MESSIER1 ET C. AUCLAIR
Department d'Anatomie, Universite de Montreal
SUMMARY
Neurulation and interkinetic nuclear migration in the chick embryo
Neurulation and interkinetic nuclear migration were studied in cells of the forming neural
tube
of
chick embryos submitted
to a
variety
of
treatments. Our results show that cyto-
chalasin B (5 /tg/ml) does not protect microtubules against disruption occurring after 3h
at
2°C
nor
does
it
prevent their repolymerization once they
are
cold-disrupted. However,
db-cAMP protects microtubules against such cold disruption. We indicate that the inhibitory
effect of cytochalasin B on interkinetic nuclear migration cannot be ascribed
to an
effect
on
microtubules.
INTRODUCTION
Dans plusieurs epitheliums embryonnaires (e.g. placodes nasales, placodes
optiques, fosses nasales, tubules mesonephrotiques, segment epais
de la
paroi
de coelome, etc. (Sauer, 1936, 1937))
les
noyaux interphasiques sont animes
d'un mouvement migratoire. Sauer,
en
1936, decrivait deja ce processus de
la
migration nucleaire intercinetique dans le tube neural chez l'embryon de poulet.
Le processus
fut
definitivement confirme par les etudes de Langman, Guerrant
& Freeman en 1966.
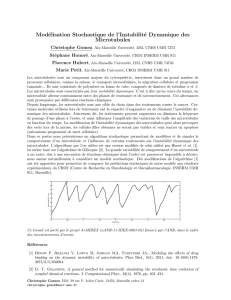
Selon Langman, Guerrant & Freeman (1966) 97,5 % des cellules nouvellement
formees dans
le
tube neural chez l'embryon de poulet presentent leurs regions
apicales reliees entre elles
par des
complexes
de
jonction (elles forment
le
feuillet neuro-epithelial proprement dit) alors que seulement 2,5 % des jeunes
cellules sont libres dans l'epithelium
et
pourraient etre
a
l'origine des neuro-
blastes. De plus, dans ces cellules attachees par leur apex en un edifice tissulaire
coherent, la phase S qui est
la
plus longue du cycle cellulaire (5 h), produit une
accumulation de noyaux qui tous se retrouvent
a
la base de l'epithelium neural.
Nous avons deja etudie le phenomene de la migration nucleaire intercinetique
chez des embryons de poulet en voie de neurulation et fait ressortir l'importance
du role joue par les microtubules dans ces mouvements (Messier, 1972; Messier
& Auclair, 1973). D'autre part, recemment, nous avons montre (Messier
&
Auclair, 1974) que
la
cytochalasine
B,
que Ton sait etre
un
inhibiteur
de la
1
Adresse de
Vauteur:
Departement d'Anatomie, Faculte
de
Medecine, Universite
de
Montreal,
C.P. 6128, Montreal, P.Q. Canada.

340 P-E. MESSIER ET C. AUCLAIR
neurulation (Karfunkel, 1972) s'avere aussi etre un puissant inhibiteur de la
migration nucleaire intercinetique. La suggestion que les microtubules sont lies
a la migration nucleaire intercinetique et les donnees qui indiquent que ces
organites interviennent dans d'autres deplacements de structures (Watterson,
1965;
Dahlstrom, 1968; Holmes & Choppin, 1968; Schliwa & Bereiter-Han,
1974) imposent que soit poussee plus loin l'etude des effets de la cytochalasine B
et que soit apportee une attention particuliere a la possibilite de son action sur
les microtubules. A cette fin, nous avons utilise la cytochalasine B dans des
conditions qui bloquent la migration nucleaire intercinetique et avons tache
de repondre aux questions suivantes: (1) la cytochalasine B est-elle une drogue
stabilisatrice, protege-t-elle les microtubules contre les effets degradants du
froid, (2) la drogue empeche-t-elle la repolymerisation des microtubules deja
degrades par le froid, (3) Faction d'un agent stabilisateur ou protecteur des
microtubules (i.e. qui empeche leur degradation a 2 °C) peut-elle faire echec a
l'actioninhibitrice
de
la cytochalasine
B
sur la migration nucleaire intercinetique
?
MATERIEL ET METHODES
Tous les embryons de poulet, Gallus domesticus, ont ete incubes in ovo a
38 °C jusqu'aux stades 1 a 7 paires de somites; stades 7 a 9 selon la table de
Hamburger & Hamilton
(1951).
Ensuite, tous furent explantes sur des milieux de
culture prepares selon la methode de Spratt (1950) de facon a ce que leur feuillet
ectodermique repose sur le milieu. Des embryons servant de temoins ont ete
incubes in vitro a 38 °C pour une duree maximale de 6 h. D'autres subirent les
traitements suivants.
Traitements
(1) Apres
1
h d'incubation a 38 °C (recuperation apres l'explanation) 25
embryons, explantes sur des milieux normaux, ont ete portes dans une chambre
refrigeree a 2 °C et maintenus au froid pendant 3 h. Leur fixation a eu lieu a
cette temperature avec des produits froids.
(2) Dix embryons, explantes sur des milieux contenant
5
/tg/ml de cytochala-
sine B, ont ete incubes pendant 2 h a 38 °C pour permettre a la drogue de bien
diffuser dans les specimens. Us furent ensuite portes a 2 °C pendant 3 h et fixes
a cette temperature.
(3) Seize embryons ont ete places sur des milieux contenant 5/tg/ml de
cytochalasine B et incubes 2 h a 38 °C. Par la suite, ils furent portes a 2 °C
pendant 3 h et finalement reportes a 38 °C pour
1
h.
(4) Plus de 35 embryons ont ete explantes sur des milieux enrichis de
N6,O2-
dibutyryle adenosine 3',5' cyclique monophosphate (db-cAMP) aux concentra-
tions de 0-01, 0-1, 0-5, 1, 2, 10, 25 mM et
1
M. TOUS furent incubes a 38 °C pour
une duree allant de 4 a 6 h.
(5) Quarante-six embryons ont ete explantes sur des milieux de culture

Neurulation et migration nucleaire chez le poulet 341
contenant du db-cAMP a des concentrations variant de 0,1 a 25 mM et furent
incubes
1
h a 38 °C. Par la suite, ils ont ete portes dans une chambre refrigeree
a 2 °C, maintenus au froid pendant 3 h et fixes a cette temperature. Nous avons
realise ici qu'une concentration de 0,5
HIM
en db-cAMP suffisait a proteger les
microtubules des effets nocifs du froid. Cette concentration est done la seule
qui fut utilisee par la suite.
(6) Finalement, 23 embryons ont ete explantes sur des milieux contenant a
la fois de la cytochalasine B (5 /*g/ml) et du db-cAMP (0,5 mM) et ils furent
incubes a 38 °C pendant 3 h.
Suite aux differents traitements, les embryons ont ete fixes au glutaraldehyde
1,25 % dans un tampon phosphate pendant 60 min et surfixes pendant
1
h au
tetroxyde d'osmium
1
% dans le meme tampon. Une fois la deshydratation dans
les alcools completee, les specimens ont ete enrobes dans l'Epon. Les coupes
fines ont ete confectionnees a l'Ultrotome LKB et colorees dans une solution
aqueuse d'acetate d'uranyle 1 % pendant 20 min puis au citrate de plomb. Les
tissus ont ete examines avec un microscope electronique Siemens 1A et un
appareil Philips 200. Pour la microscopie photonique, des sections d'un /im
d'epaisseur ont ete confectionnees et colorees au bleu de toluidine
1
% en
solution aqueuse.
RESULTATS
Le present travail confirme nos resultats publies recemment (Messier &
Auclair, 1974) a l'effet que la cytochalasine
B
inhibe la neurulation chezl'embryon
de poulet et qu'elle bloque la migration nucleaire intercinetique dans les cellules
de 1'epithelium neural. Cet arret du deplacement des noyaux, leur accumulation
desordonnee dans l'epaisseur du feuillet neuro-epithelial et le largage de nom-
breuses cellules dans la neurocoele provoquent des changements d'importance
variable dans Failure generale du neuroepithelium (Fig. 3B).
Exposition a
2
°C
Nous avons deja decrit les effets de l'exposition d'embryons a
2 °C
(Auclair
& Messier, 1974). Nous ne rappelons ici que ce qui a trait au present titre a
savoir qu'apres 3 h d'exposition a cette basse temperature (1) les cellules de
1'epithelium neural des embryons sont depourvues de microtubules (Fig.
1
A)
et (2) ces cellules, qui normalement sont de forme asymetrique, prennent, dans
ces conditions, une forme arrondie. Lors de ce traitement, la forme generale du
tube neural comme elle apparait sur des sections transversales en fin de traite-
ment, est fort variable. Chez certains embryons les perturbations physiologiques
causees par le froid et l'arrondissement provoque des cellules laissent le tube
neural inchange alors que chez d'autres, on observe une deterioration plus ou
moins poussee de Failure generale du neuroepithelium.

P-E. MESSIER ET C. AUCLAIR
FIGURE 1
(A) Portions des cellules provenant d'un embryon expose a 2°C pendant 3 h. On y
remarque que les microtubuies ne sont plus visibles dans le cytoplasme. x 60000.
(B) Portion de deux cellules provenant d'un embryon d'abord place sur un milieu
contenant de la cytochalasine
B (5
/^g/ml) et incube
2
h a
38 °C
et ensuite porte a 2°C
pendant
3
h et fixe a cette temperature. On y remarque que la cytochalasine n'a pas
empeche la degradation des microtubuies. x 43
000.

Neurulation et migration nucleaire chez le poulet 343
Exposition a 2 °C sur milieux contenant de la cytochalasine B
Nous avons voulu savoir si la cytochalasine pouvait stabiliser, proteger les
microtubules contre la degradation qui s'effectue lorsque les embryons sont
portes au froid. A cette fin, des embryons ont ete places sur des milieux con-
tenant de la cytochalasine et incubes pendant 2 h a 38 °C. Par la suite, les
specimens furent portes a 2 °C pendant 3 h et fixes a cette temperature. Dans
ces conditions on assiste, tout comme si la cytochalasine etait absente des
milieux, a la disparition des microtubules (Fig. 1B). Apres cetraitement, Failure
generale de l'epithelium neural affiche des modifications qui sont en tout point
comparables a celles observees apres une simple exposition a 2 °C.
Exposition a 2°C et report a 38 °C sur milieux contenant de la cytochalasine B
Pour voir si la cytochalasine pouvait empecher le retour des microtubules
depolymerises par les basses temperatures, des embryons ont ete places sur des
milieux contenant de la cytochalasine, incubes 2 h a 38 °C, portes a 2 °C
pendant 3 h et ramenes ensuite a 38 °C pour
1
h. Dans les cellules du tube neural
de ces embryons, on a toujours releve la presence de microtubules normalement
constitues (Fig.
2
A).
II en decoule que la drogue n'empeche pas la repoly-
merisation des microtubules qui ont ete degrades lors de l'exposition au froid.
Ce traitement perturbe l'aspect general de l'epithelium. En effet, tout comme si la
cytochalasine B avait ete utilisee seule et a la meme concentration, l'induction
du largage des cellules dans la neurocoele et l'arret des mouvements nucleaires
contribuent a deteriorer, mais d'une facon erratique, l'image habituelle de
l'epithelium neural.
Incubation sur milieux riches en db-cAMP
Aux concentrations les plus faibles (0,01 a 0,5 mM) le db-cAMP n'a pas
montre d'effet detectable sur le rythme de la croissance des jeunes embryons
mis en experience. La morphologie generale des embryons etait comparable a
celle des temoins (Fig. 2B) et les caracteres histologiques de leur tube neural
etaient identiques a ceux releves chez
les
specimens normaux. L'activite mitotique
a semble normale et la migration nucleaire intercinetique n'a pas ete affectee
comme en temoignaient les noyaux en division qui n'etaient observes qu'a
l'apex des cellules. Par contre, a la concentration de 25 mM, le db-cAMP a
retarde la segmentation du mesoderme en somites. En effet, dans ces conditions,
on ne comptait plus que deux nouvelles paires de somites acquises en 4h
d'incubation alors que chez les temoins, mis en experience au meme moment,
on comptait regulierement quatre nouvelles paires de somites apres le meme
temps d'incubation. Macroscopiquement ces specimens affichaient des defauts
de neurogenese et de somitogenese (Fig. 2C). Chez ces embryons traites a la
plus forte concentration, on a toujours eu l'impression d'observer plus de
22 EMB 34
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%