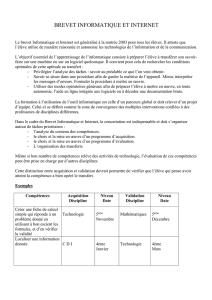
Protection_des _medicaments_fr

UNION EUROPEENNE – PROTECTION DES MEDICAMENTS – Développements
récents de la jurisprudence de la Cour de Justice (décembre 2013)
Note d’information du cabinet Simont Braun, avocats à Bruxelles (www.simontbraun.eu).
A. Peut-on obtenir plusieurs certificats complémentaires de protection de
médicaments à partir d’un seul brevet ? La Cour de justice se prononce.
Entre le dépôt d’une demande de brevet pour un nouveau médicament et
l’autorisation de mettre celui-ci sur le marché, il peut s’écouler une période assez longue.
Ceci réduit de facto la protection effective conférée par le brevet. Le législateur européen
a donc prévu un mécanisme de prolongation de la durée de protection, appelé le
certificat complémentaire de protection (ci-après, CCP).
Celui-ci ne vaut toutefois que pour le produit visé par le brevet, à savoir le principe actif
ou la composition de principes actifs d’un médicament, et à condition que le médicament
soit couvert par une autorisation de mise sur le marché (ci-après, AMM). En effet, cette
extension de la protection ne peut s’étendre à des éléments non brevetés, et doit rester
limitée à des applications médicamenteuses (puisque c’est le temps mis à délivrer une
AMM qui justifie cette prolongation). Le législateur européen a estimé que titulaire d’un
brevet et d’un tel certificat, devait pouvoir bénéficier au total de quinze années
d’exclusivité au maximum à partir de la première AMM de son médicament (Règlement
469/2009 concernant les CCP, neuvième considérant).
L’article 3 du Règlement 469/2009 du 6 mai 2009 précise les conditions à remplir afin
d’obtenir un tel certificat. Ces conditions sont les suivantes :
« a) le produit est protégé par un brevet de base en vigueur; b) le produit, en tant que
médicament, a obtenu une autorisation de mise sur le marché en cours de validité […];
c) le produit n’a pas déjà fait l’objet d’un certificat; d) l’autorisation mentionnée au point b)
est la première autorisation de mise sur le marché du produit, en tant que médicament ».
Dans la pratique, de délicates question d’interprétation de ce texte se posent
fréquemment et alimentent un important contentieux devant la Cour européenne de
justice, qui est chargée d’interpréter ces dispositions. Dans ce contexte, la Cour
européenne de justice a rendu le 12 décembre 2013 deux arrêts concernant la
délivrance de différents certificats sur la base d’un même brevet.
Dans la première affaire (C-443/12 Actavis Group c. Sanofi), le brevet couvrait
une famille de composés à laquelle appartient un principe actif hypertenseur, l’irbésartan.
Le brevet visait également des compositions pharmaceutiques contenant l’irbésartan en

2
association avec un ou plusieurs autres composés, quant à eux non inventifs, et non
nommément désignés dans le brevet.
Le titulaire du brevet, Sanofi, avait obtenu deux CCP distincts. Le premier portait sur un
médicament contenant l’irbésartan seul. L’autre portait sur un médicament combinant
l’irbésartan et un diurétique ; toutefois, cette combinaison n’avait pas d’effet
thérapeutique nouveau par rapport aux effets obtenus au moyen d’une administration
séparée des deux principes actifs (l’irbésartan et le diurétique). En vue d’introduire sur le
marché une version générique de ce deuxième médicament, un concurrent, Actavis,
contesta dès lors la validité de ce second CCP devant les tribunaux anglais.
Actavis arguait que ce second CCP n’était pas valable notamment parce que le produit
protégé par le brevet, à savoir l’irbésartan, avait déjà fait l’objet d’un premier CCP délivré
le 8 février 1999.
Interrogée sur ce point par la High Court of Justice, la Cour de Justice de l’Union
européenne a été sensible à l’argumentation d’Actavis. Lorsque, sur le fondement d’un
brevet protégeant un principe actif novateur et d’une AMM d’un médicament contenant
celui-ci en tant que principe actif unique, le titulaire de ce brevet a déjà obtenu, pour ce
principe actif, un CCP lui permettant de s’opposer à l’utilisation dudit principe actif seul
ou en combinaison avec d’autres principes actifs, l’article 3, c) du Règlement 469/2009
s’oppose à ce que, sur le fondement du même brevet, mais d’une AMM ultérieure d’un
médicament différent contenant le ledit principe actif en composition avec un autre
principe actif qui n’est pas, en tant que tel, protégé par le brevet, le titulaire du brevet
obtienne un second CCP portant sur cette composition de principes actifs.
Par conséquent, en pratique, le titulaire d’un brevet ne peut pas obtenir un CCP distinct à
chaque fois qu’il met sur le marché un médicament contenant le principe actif protégé
par son brevet en combinaison avec un autre principe actif non protégé par ledit brevet,
et ce même si le brevet revendique également les compositions associant ce principe
actif à d’autres substances. En effet, quelle que soit la portée large d’un tel brevet, au
regard de telles combinaisons, le titulaire a déjà bénéficié pour ce médicament de l’octroi
du premier CCP.
En revanche, dans la deuxième affaire (C-484/12 – Georgetown University c.
Octrooicentrum Nederland), la demande de brevet européen intitulé « vaccin contre le
papillomavirus », revendiquait différents sous-types de protéines. Parmi les
revendications de ce brevet figurait un vaccin comprenant au moins une protéine de
papillomavirus humain parmi deux sous-types de protéines (HPV-16 ou HPV-18), ainsi
que ces deux sous-types de protéines ensemble (HPV-16 et HPV-18). Sur la base de ce
brevet et de différentes AMM pour différents médicaments composés de plusieurs de ces
sous-types de protéines différentes, Georgetown University a introduit huit demandes de
CCP en lien avec son brevet. Deux d’entre elles ont été acceptées, cinq sont encore en
attente, et l’une d’elles a été rejetée.

3
Georgetown University a contesté ce refus devant le tribunal de La Haye, et ce dernier a
demandé à la Cour de Justice si, lorsqu’un brevet de base en vigueur couvre plusieurs
produits, un certificat pouvait être délivré au titulaire dudit brevet pour chaque produit
protégé.
Plus précisément : si sur le fondement d’un brevet de base et de l’AMM d’un médicament
consistant en une combinaison de plusieurs principes actifs, le titulaire du brevet a
obtenu un CCP couvrant cette combinaison de principes actifs, l’article 3 c) du
Règlement 469/2009 sur les CCP s’oppose-t-il à ce que ce titulaire obtienne également
un CCP pour l’un de ces principes actifs, qui, pris individuellement, est également
protégé en tant que tel par le brevet ?
La Cour de justice y a répondu par la négative : si, sur le fondement d’un brevet de base
et de l’AMM d’un médicament consistant en une composition de plusieurs principes
actifs, le titulaire de celui-ci a déjà obtenu un CCP pour cette composition de principes
actifs protégée par le brevet, le règlement ne s’oppose pas à ce que ce titulaire obtienne
également un certificat complémentaire de protection pour l’un de ces principes actifs,
qui, pris individuellement, est également protégé en tant que tel par ledit brevet.
En pratique, lorsqu’un brevet protège plusieurs produits distincts, il peut en principe
donner lieu à autant de CCP couvrant chacun de ces produits distincts, pour autant
toutefois que (i) chacun de ceux-ci, pris individuellement, soit à la fois protégé en tant
que tel par le brevet et contenu dans un médicament disposant d’une AMM, et (ii) que ce
produit n’ait pas déjà, en tant que tel, fait l’objet d’un CCP antérieur.
En conclusion, si un brevet protège un seul produit au sens de l’article 1er du
Règlement 469/2009 sur les CCP, un seul CCP pourra être délivré sur la base de ce
brevet. En revanche, si le brevet protège des produits distincts, le titulaire du brevet
pourra obtenir plusieurs CCP sur la base de ce seul brevet, à condition que chaque
produit pour lequel un CCP est demandé soit protégé en tant que tel par le brevet et visé
par une AMM distincte.
En revanche, quant à savoir quels sont les éléments précis permettant d’affirmer qu’un
produit est protégé en tant que tel par le brevet, la question reste délicate bien que la
Cour ait encore rendu un arrêt à ce sujet le 12 décembre 2013 également.
B. Quand un produit peut-il être considéré comme couvert par le brevet pour
donner lieu à un certificat complémentaire de protection ? Une question
qui reste délicate.
Le CCP ne couvre que le « produit » protégé par le brevet, à savoir le principe
actif ou la combinaison de principes actifs d’un médicament, principe ou combinaison qui
est protégé en tant que tel par le brevet.

4
La notion de produit n’est cependant pas toujours aisée à définir et fait régulièrement
l’objet de questions préjudicielles devant la Cour de justice de l’Union européenne. La
Cour s’est une nouvelle fois prononcée à ce sujet dans un arrêt du 12 décembre 2013
(C-493/12, Eli Lilly and Company Ltd. C. Human Genome Sciences Inc.).
Cette affaire concernait un brevet de la société HGS portant sur une nouvelle
protéine, la neutrokine alpha. Le brevet revendique notamment cette protéine, mais aussi
des anticorps qui se lient spécifiquement à cette protéine.
Eli Lilly, un concurrent de HGS, souhaitait commercialiser une composition
pharmaceutique contenant comme principe actif un anticorps (LY2127399) qui se lie
spécifiquement à la neutrokine alpha, protégée par le brevet de HGS. Eli Lilly a dès lors
contesté la validité de tout CCP ayant pour base légale le brevet de HGS et qui serait
fondé sur une AMM d’un médicament contenant le LY2127399.
Eli Lilly a fait valoir que cet anticorps LY2127399 n’était pas couvert par un «brevet de
base» au sens de l’article 3 du règlement n° 469/2009 sur les CCP, dans la mesure où,
selon elle, la revendication concernée du brevet de HGS est rédigée de manière trop
large pour que ledit anticorps puisse être considéré comme étant mentionné dans le
libellé des revendications dudit brevet.
En effet, selon Eli Lilly, pour pouvoir servir de base à la délivrance d’un CCP, le brevet
de HGS aurait dû contenir une définition structurelle de principes actifs et les
revendications auraient dû présenter un degré significativement plus élevé de
spécificités, par exemple en définissant l’anticorps en fonction de sa séquence d’acides
aminés.
Dans ces conditions, la High Court of Justice a interrogé la Cour notamment quant aux
critères permettant de déterminer si un produit est protégé par un brevet de base en
vigueur au sens du règlement, et quant à la manière dont les anticorps doivent être
définis dans les revendications du brevet pour être protégés en tant que tels par ledit
brevet.
La Cour avait déjà auparavant souligné le rôle essentiel des revendications du brevet
aux fins de déterminer si un produit était protégé par un brevet de base au sens du
règlement (voy. CJUE, 24 novembre 2011, C-322/10, Medeva, point 25).
Dans cette affaire-ci, la Cour a précisé que, pour pouvoir considérer qu’un principe actif
est «protégé par un brevet de base en vigueur», il n’est pas nécessaire que le principe
actif soit mentionné dans les revendications de ce brevet au moyen d’une formule
structurelle, ainsi que le soutenait Eli Lilly.
Un CCP peut ainsi être délivré pour un principe actif couvert par une formule
fonctionnelle figurant dans les revendications d’un brevet, à la condition toutefois que,
sur la base de telles revendications, interprétées notamment à la lumière de la
description de l’invention, il soit possible de conclure que ces revendications visaient,

5
implicitement mais nécessairement, le principe actif en cause, et ce de manière
spécifique.
Le critère retenu par la Cour de justice en l’espèce afin de déterminer si un
produit peut être protégé par un CCP, est donc le fait que les revendications du brevet
visent, implicitement mais nécessairement, le principe actif en cause.
Ce critère risque de mener à des difficultés d’interprétation, et les applications concrètes
de cet arrêt semblent incertaines. En effet, la jurisprudence de la Cour de Justice
concernant la notion de « produit » au sens du règlement 469/2009 sur les CCP ne
permet malheureusement pas encore d’appliquer cette notion de façon précise et non
équivoque.
F. De Visscher, E. De Gryse et A. Delheid. Mars 2014
1
/
5
100%