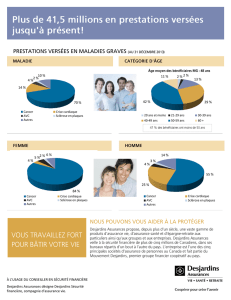
Tériflunomide réduit significativement le taux de récidive

1 / 2
Communiqué de presse sanofi-aventis
Sanofi-aventis www.sanofi-aventis.com
Relations Presse : Tél. : 01 53 77 44 50 - e-mail : [email protected]
Relations Investisseurs : Tél. : 0 1 53 77 45 45 - e-mail : IR@sanofi-aventis.com
Tériflunomide réduit significativement le taux
de récidive annuel avec une bonne tolérance
chez les patients atteints de sclérose en plaques
- Présentation des premiers résultats de l’étude de phase III TEMSO
au prochain congrès de l’ECTRIMS en Octobre 2010 -
Paris, France - Le 30 Août 2010 – Sanofi-aventis (EURONEXT : SAN et NYSE : SNY) annonce
aujourd’hui que tériflunomide réduit significativement le taux de récidive annuel à 2 ans par rapport au
placebo, chez les patients atteints de sclérose en plaques (SEP) récurrente, atteignant ainsi le critère
d’évaluation principal de l’étude de phase III TEMSO. Tériflunomide est un médicament en cours de
développement administré une fois par jour par voie orale. Les deux doses de tériflunomide (7 mg et
14 mg) testées dans l’étude ont été bien tolérées. Le nombre de patients à avoir signalé un effet
indésirable survenu pendant le traitement ou un effet indésirable ayant entraîné un arrêt du traitement
était comparable pour les deux doses de tériflunomide à ce qui a été observé sous placebo.
Les effets sur les autres critères cliniques et l’imagerie par résonance magnétique confirment le critère
d’évaluation principal de l’étude. Le profil de tolérance est quant à lui en ligne avec celui observé dans
les précédentes études cliniques.
L’étude TEMSO est le premier essai d’un vaste programme de développement clinique de phase III de
tériflunomide en monothérapie. Les résultats de l’étude TEMSO seront communiqués lors de la
présentation orale prévue le 15 octobre 2010, à partir de 9h15 CET, lors du 26e congrès annuel de
l’ECTRIMS (European Committee for Treatment and Research in Multiple Sclerosis) à Göteborg, en
Suède. Les résultats de l’étude TEMSO sont sous embargo jusqu’à cette date.
A propos de tériflunomide
Tériflunomide est un nouveau traitement de fond de la sclérose en plaques récurrente, administré par voie
orale. Il inhibe la synthèse de novo des pyrimidines et réduit ainsi la prolifération des lymphocytes T et B sans
cytotoxicité. Tériflunomide fait actuellement l’objet d’un vaste programme de développement clinique en
monothérapie. Les résultats d’une première étude de phase II évaluant la tolérance et l’efficacité de
tériflunomide en monothérapie dans la sclérose en plaques ont été publiés dans le journal Neurology en
2006. Outre l’étude TEMSO, deux autres études de phase III, l’étude TOWER et l’étude TENERE, sont en
cours dans la sclérose en plaques récurrente. Un essai de phase III, l’étude TOPIC, est également en cours
dans le stade précoce de sclérose en plaques appelé aussi syndrome cliniquement isolé (SCI). Tériflunomide
a également été évalué en complément d’un traitement par interféron 1-bêta (INF-β) ou par acétate de
glatiramère dans le cadre de deux études de phase II. Les résultats de ces études ont été présentés plus tôt
cette année, respectivement lors du congrès de l’ACTRIMS (American Committee for Treatment and
Research in Multiple Sclerosis) et du congrès de l’ANN (American Academy of Neurology). L’étude de
phase II avec tériflunomide (7 mg et 14 mg) en complément de l’INF-β montre une amélioration des résultats
cliniques avec un profil de tolérance observé chez les patients traités par cette association comparable à celui
des patients ayant reçu l’IFN-β et un placebo. Dans l’autre étude de phase II, tériflunomide en complément de
l’acétate de glatiramère (AG) s’est montré bien toléré, comparé au traitement par AG et placebo. Néanmoins,
bien que le nombre et le volume des lésions mises en évidence par l’IRM cérébrale pondérée en T1 après

2 / 2
injection de gadolinium tendent à diminuer dans le bras tériflunomide/AG, comparativement au bras
placebo/AG, cet effet relatif ne semble pas reposer sur des données aussi solides que celles observées pour
le tériflunomide en complément de l’IFN-β.
A propos de l’étude TEMSO
L’étude TEMSO était un essai international randomisé, réalisé en double aveugle contre placebo, d’une durée
de 2 ans. Les 1088 patients inclus dans cette étude étaient atteints de sclérose en plaques récurrente et âgés
de 18 à 55 ans, avec un score inférieur ou égal à 5,5 sur l’échelle EDSS (Expanded Disability Status Scale) et
avaient présenté au minimum une poussée au cours de l’année précédant l’inclusion ou deux poussées au
cours des deux années précédentes. Les patients étaient randomisés entre différents groupes : placebo,
tériflunomide 7 mg ou tériflunomide 14 mg, à raison d’une administration quotidienne. Le critère d’évaluation
principal était le taux annuel de récidives défini comme le nombre de récidives confirmées par année-patient.
Le principal critère d’évaluation secondaire était le délai de progression du handicap mesuré sur l’échelle
EDSS. La tolérance et l’innocuité étaient évaluées à partir des effets indésirables survenus sous traitement,
des examens cliniques, des signes vitaux ainsi que des examens biologiques.
A propos de la sclérose en plaques
La sclérose en plaques (SEP) est une maladie chronique, imprévisible et progressivement handicapante. Le
diagnostic de la SEP est classiquement posé chez des sujets jeunes qui ont alors devant eux un avenir
chargé d’incertitudes avec la perspective d’une santé déclinant avec le temps. Dans le monde, plus de deux
millions de personnes souffrent de SEP. Cette maladie est due à une lésion de la myéline (gaine protectrice
qui entoure les fibres nerveuses), qui se traduit par une dégradation des messages entre le cerveau et
d’autres régions du corps. La SEP se manifeste de façon très variable avec des symptômes qui dépendent
des zones du système nerveux central qui sont touchées. Il n’existe pas de tableau clinique bien défini de la
SEP et chaque malade présente un ensemble de symptômes, de nature, de gravité et de durée variables, y
compris chez une même personne. La prise en charge de la SEP est complexe. Pour pouvoir retarder
l’évolution de la maladie ou du moins la ralentir, il est recommandé d’intervenir à un stade précoce du
processus pathologique de la maladie. La prise en charge est pluridisciplinaire et fait appel à divers
professionnels de santé mais aussi à un accompagnement social. A ce jour, il n’existe hélas pas de traitement
curatif connu de la sclérose en plaques. Même si plusieurs traitements sont utilisés dans la prise en charge
de la SEP, il est indispensable de pouvoir disposer de nouveaux traitements oraux avec un rapport
bénéfice/risque acceptable.
A propos de sanofi-aventis
Sanofi-aventis est un leader mondial de l’industrie pharmaceutique qui recherche, développe et diffuse des
solutions thérapeutiques pour améliorer la vie de chacun. Le Groupe est coté en bourse à Paris (EURONEXT
PARIS : SAN) et à New York (NYSE : SNY). Pour plus d’informations, visitez les sites : www.sanofi-aventis.us
ou www.sanofi-aventis.com
Déclarations prospectives
Ce communiqué contient des déclarations prospectives (au sens du U.S. Private Securities Litigation Reform Act of 1995). Ces
déclarations ne constituent pas des faits historiques. Ces déclarations comprennent des projections et des estimations ainsi que
les hypothèses sur lesquelles celles-ci reposent, des déclarations portant sur des projets, des objectifs, des intentions et des
attentes concernant des résultats financiers, des événements, des opérations, des services futurs, le développement de produits
et leur potentiel ou les performances futures. Ces déclarations prospectives peuvent souvent être identifiées par les mots «
s'attendre à », « anticiper », « croire », « avoir l’intention de », « estimer » ou « planifier », ainsi que par d’autres termes
similaires. Bien que la direction de sanofi-aventis estime que ces déclarations prospectives sont raisonnables, les investisseurs
sont alertés sur le fait que ces déclarations prospectives sont soumises à de nombreux risques et incertitudes, difficilement
prévisibles et généralement en dehors du contrôle de sanofi-aventis, qui peuvent impliquer que les résultats et événements
effectifs réalisés diffèrent significativement de ceux qui sont exprimés, induits ou prévus dans les informations et déclarations
prospectives. Ces risques et incertitudes comprennent notamment les incertitudes inhérentes à la recherche et développement,
les futures données cliniques et analyses, y compris postérieures à la mise sur le marché, les décisions des autorités
réglementaires, telles que la FDA ou l’EMA, d’approbation ou non, et à quelle date, de la demande de dépôt d’un médicament,
d’un procédé ou d’un produit biologique pour l’un de ces produits candidats, ainsi que leurs décisions relatives à l’étiquetage et
d’autres facteurs qui peuvent affecter la disponibilité ou le potentiel commercial de ces produits candidats, l’absence de garantie
que les produits candidats s’ils sont approuvés seront un succès commercial, l’approbation future et le succès commercial
d’alternatives thérapeutiques, la capacité du Groupe à saisir des opportunités de croissance externe ainsi que ceux qui sont
développés ou identifiés dans les documents publics déposés par sanofi-aventis auprès de l'AMF et de la SEC, y compris ceux
énumérés dans les rubriques « Facteurs de risque » et « Déclarations prospectives » du document de référence 2009 de sanofi-
aventis ainsi que dans les rubriques « Risk Factors » et « Cautionary Statement Concerning Forward-Looking Statements » du
rapport annuel 2009 sur Form 20-F de sanofi-aventis, qui a été déposé auprès de la SEC. Sanofi-aventis ne prend aucun
engagement de mettre à jour les informations et déclarations prospectives sous réserve de la réglementation applicable
notamment les articles 223-1 et suivants du règlement général de l’autorité des marchés financiers.
Contact media :
Philippe BARQUET
Tél. : +33 (0)6.70.48.61.28 - E-mail : philippe.barquet@sanofi-aventis.com
1
/
2
100%