Exercices de révision

1
EXERCICES DE RÉVISION (A)
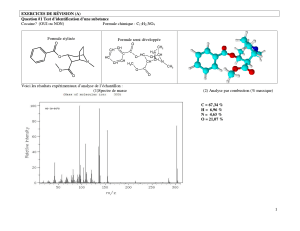
Question #1 Test d’identification d’une substance
Cocaine? (OUI ou NON) Formule chimique : C
17
H
21
NO
4
Formule stylisée
N
O
O
O
O
Formule semi développée
N
CH
CH
CH
3
CH
2
CH
CH
2
C
O
O
CH
3
O
C
C
O
CH
CH
CH
CH CH CH
CH
2
Voici les résultats expérimentaux d’analyse de l’échantillon :
(1)Spectre de masse (2) Analyse par combustion (% massique)
C = 67,34 %
H = 6,96 %
N = 4,63 %
O = 21,07 %

2
Réponse : Question #1 Test d’identification d’une substance => COCAINE
Atomes
%massique
massemolaireatome
= Nbr moles/ 0,3305 moles FORMULE
EMPIRIQUE
C 67,34 g / 12,01g/mole 5,607 moles 16.96
H 6,96 g / 1,01 g/mole 6,891 moles 20,89
N 4,63 g/ 14,01 g/mole 0,3305 moles 1,00
O 21,07 g/ 16,00 g/mole 1,317 moles 4,00
Formule empirique = C
17
H
21
NO
4
= moléculaire
exp
303,35
1
303
empirique
M
M
= =
Bonne possibilité que ce soit de la cocaine (Pas sûr à 100%) Deux informations (Spectre de masse et
composition) confirment cette hypothèse.
Question #2 Analyse par combustion
En présence d’oxygène, la combustion d’un échantillon de 0,0989g d’un alcool donne 0,2160 g de CO
2
et
0,1194g de H
2
O. Calculer la composition en pourcentage massique et déterminer la formule empirique de cet
alcool.
Réponse #2
Déterminer la masse de chaque atome dans l’échantillon
2
2
12, 01
216 58, 94
44, 01
C O
m asse C
m asse C m asse C O m g de C
M
= • = • =
2
2
2 2, 01
119, 4 13, 32
18, 02
H O
m asse H
m asse H m asse H O m g de H
M
= • = • =
Composition (% massique de chaque atome)
58,94
% 100 100 59,60%
98,9
échantillon
masseC
C C
m
= • = • =
13,32
% 100 100 13,47%
98,9
échantillon
masse H
Hm
= • = • =
%O = 100 -%C -%H = 100- 59,60 – 13,47 = 26,93 %
Composition
%C = 59,60 %
%H = 13,47 %
%O = 26,93 %
Détermination de la formule empirique / moléculaire

3
59,60 4,963 2,95
1,68
12,01
g C moles moles
gmole
= =
13,47 13,337 7,98
1,68
1,01
g H moles moles
gmole
= =
26,93 1,68 1
1,68
16,00
g O moles moles
gmole
= =
Formule empirique=> C
3
H
8
O
Question #3
A) 0,860 g d'un composé organique contenant du C, de l'H et de l'O est complètement brûlé en présence d'oxygène.
1,64 g de CO
2
et 1,01 g de H
2
O sont produits. Déterminer la formule empirique.
Réponse
2
2
2
2
2
12,01
1,64 0,4475
44,01
2,02
1,01 0,1132
18,02
0,860 0,4475 0,1132 0,2993
C
C CO
CO
H
H H O
H O
O éch C H
M
m m g gC
M
M
m m g gH
M
m m m m g
= • = • =
= • = • =
= − − = − − =
0,4475 0,03726
12,01
0,1132 0,1121
1,01
0,2993 0,01871
16,00
C
C
H
H
O
O
mgC molesC
g
Mmole
m gH molesH
g
Mmole
mgO molesO
g
Mmole
= =
= =
= =
Division par le nombre de moles le plus petit soit 0,01871
0,03726
1,99 2
0,01871
0,1121
5,99 6
0,01871
0,01871
1,00 1
0,01871
molesC moles
molesH moles
molesO moles
= =
= =
= =
FORMULE EMPIRIQUE => C
2
H
6
O

4
Question #4
Soit un échantillon de 0,597 g recueilli dans un récipient de 100 mL à 95,0
o
C et à 1000 mmHg de pression.
Quelle est sa masse molaire?
Réponse :
1000 101,325 133,32
760
kPa
mmHg
P kPa kPa
mmHg
= • =
et T
C
=95+273,15=368,15K
mRT
PV
M
=
8,314
0,597 368,15
137,06
133,32 0,1
kPa L
g K
mRT g
K mole
M
mole
PV kPa L
•
• •
•
= = =
•

5
EXERCICES DE RÉVISION-(B) -SR
(Configuration électronique et propriétés périodiques) CORRIGÉ
Question #1
Définir les valeurs possibles (Nombre quantique) pour 3d (Valeurs décrivant la fonction d’onde des électrons).
Valeurs permises
n 3
l 2
m -2,-1,0,1,2
Combien y a-t-il de cases quantiques associées au niveau énergétique 3d :__5 cases
Combien d’électrons peuvent être décrits par 3d :__10 e
-
Question #2
Compléter.
forme Nbr d’e
-
maximum
l = 0 s 2
l = 1 p 6
l= 2 d 10
l = 3 f 14
Question #3
Combien est-il possible de mettre d’électrons par période?
Période Nbr d’e
-
maximum
1
ère
2
2
e
8
3
e
8
4
e
18
5
e
18
6
e
32
7
e
32
Question #4
Donner la configuration électronique des deux atomes suivants :
a) Sn (Étain) (50 e
-
) [Kr] 4d
10
5s
2
5p
2
b) Md (Mendélévium) (101 e
-
) [Rn] 5f
13
7s
2
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%