Syndromes myélodysplasiques - La Société de leucémie et

Syndromes
myélodysplasiques
LEUCÉMIE LYMPHOME MYÉLOME

PS22 50M 3/08
LEUCÉMIE LYMP HOM E MYÉLOME

page 1
Introduction 2
Sang et moelle osseuse normaux 3
Syndromes myélodysplasiques 5
Incidence 6
Causes et facteurs de risque 7
Signes et symptômes 7
Diagnostic 8
Classifications des SMD et index pronostique international 9
Traitement 12
Études de recherche et essais cliniques 18
Effets sociaux et émotionnels 21
Glossaire 24
Ressources 41
Table des matières
LEUCÉMIE LYMP HOM E MYÉLOME

page 2
La présente brochure contient des renseignements à l’intention des
patients et de leur famille sur les syndromes myélodysplasiques (SMD).
Environ 6 000 personnes au Canada souffrent de myélodysplasie et près
de 500 nouveaux cas sont diagnostiqués chaque année (source : Aplastic
Anaemia and Myelodysplasia Association of Canada).
Le terme syndrome myélodysplasique, ou SMD, est utilisé depuis la fin des
années 1970 pour désigner un groupe de maladies du sang et de la moelle
osseuse dont le degré de gravité, les besoins en matière de traitement et
l’espérance de vie qui y sont associés varient.
La présente brochure commence par une brève description générale du
sang et de la moelle osseuse normaux, suivie d’une description détaillée du
SMD et de son traitement. Elle contient un glossaire afin d’aider le lecteur à
comprendre les termes médicaux. Certains des termes médicaux employés
peuvent être des synonymes d’autres mots ou phrases utilisés par les
professionnels de la santé. Par exemple, le SMD est connu sous le nom
de leucémie couvante, de préleucémie ou d’oligoleucémie. Consultez votre
médecin si vous avez des questions sur la façon dont les termes utilisés ici
s’appliquent à vous. Nous espérons que ces renseignements vous seront
utiles et nous vous invitons à nous faire parvenir vos commentaires sur la
brochure.
La présente publication vise à fournir des renseignements exacts qui font autorité sur le sujet. Elle est distribuée dans
l’intérêt public par la Société de leucémie et lymphome du Canada (SLLC). Soulignons toutefois que la SLLC n’offre pas
de services médicaux ni d’autres services professionnels..
Introduction
LEUCÉMIE LYMP HOM E MYÉLOME

page 3
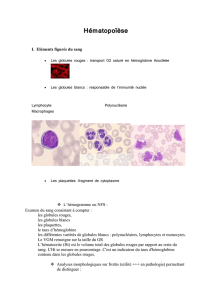
Un des rôles essentiels de la moelle osseuse est de produire les globules rouges, les
globules blancs et les plaquettes. Chaque jour, la moelle osseuse libère plusieurs millions
de ces cellules dans la circulation sanguine afin de remplacer les cellules âgées qui sont
éliminées du sang. Les maladies du sang et de la moelle osseuse comme les SMD
entraînent une baisse du nombre de globules rouges, de globules blancs et de plaquettes.
Le sang est composé de plasma et de cellules en suspension dans le plasma. Le
plasma est en grande partie formé d’eau, dans laquelle de nombreuses substances
chimiques sont dissoutes. Ces substances sont, entre autres :
• des protéines comme l’albumine, des anticorps, y compris ceux produits par
l’organisme après la vaccination (comme les anticorps contre le poliovirus), et des
facteurs de coagulation;
• des hormones, telles que les hormones thyroïdiennes;
• des minéraux comme le fer, le calcium, le magnésium, le sodium et le potassium;
• des vitamines comme le folate et la vitamine B12.
Les cellules en suspension dans le plasma sont les globules rouges, les plaquettes
et les globules blancs (neutrophiles, éosinophiles, basophiles, monocytes et
lymphocytes).
• Les globules rouges constituent entre 40 et 45 p. 100 du volume sanguin. Ils
sont remplis d’hémoglobine, une protéine qui capte l’oxygène dans les poumons
et l’amène aux cellules de tout l’organisme.
• Les plaquettes sont de petits fragments cellulaires qui ont le dixième de la taille
d’un globule rouge et qui contribuent à arrêter le saignement au site d’une
blessure dans l’organisme. Par exemple, si une personne se coupe, les vaisseaux
qui transportent le sang se déchirent. Les plaquettes adhèrent à la surface déchirée
du vaisseau, s’agrègent et bouchent le site de saignement. Par la suite, un caillot
se forme. La paroi vasculaire peut alors guérir au site où se trouve le caillot et
retrouver son état normal.
• Les neutrophiles (aussi appelés leucocytes polymorphonucléaires, PMN ou
polys) et les monocytes sont des globules blancs. On les appelle phagocytes
(ou cellules qui mangent) parce qu’ils peuvent ingérer des bactéries ou des
champignons microscopiques et les tuer. Contrairement aux globules rouges et
aux plaquettes, les globules blancs quittent la circulation sanguine et pénètrent
dans les tissus, où ils peuvent ingérer les microorganismes envahissants et aider à
combattre les infections. Les éosinophiles et les basophiles sont deux autres types
de globules blancs qui réagissent aux allergènes.
• La plupart des lymphocytes, un autre type de globules blancs, se trouvent dans
les ganglions lymphatiques, la rate et les canaux lymphatiques, mais certains
d’entre eux pénètrent dans la circulation sanguine. Il existe trois grands types
de lymphocytes : les lymphocytes T, les lymphocytes B et les cellules tueuses
naturelles (natural killer ou NK). Ces cellules sont des parties importantes du
système immunitaire.
Sang et moelle osseuse normaux
LEUCÉMIE LYMP HOM E MYÉLOME
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
1
/
44
100%