1. Observation microscopique. 2. Type respiratoire. 2.1. Oxydase

1. Observation microscopique.
-- Je dispose de cultures pures sur GN en pente.
- Prélever un peu de culture sur la pente.
- Etaler dans une goutte d’eau sur la lame.
- Sécher et fixer.
- Effectuer une coloration de Gram.
- Observer au microscope.
2. Type respiratoire.
-- Tous les métabolismes cellulaires ont besoin d’une molécule capable de
capter les électrons libérés aux cours des réactions (cours de terminale). On
l’appelle l’accepteur final. Il en existe plusieurs types :
- O2. C’est l’accepteur final de tous les eucaryotes et d’un grand nombre de
bactéries. Le métabolisme est appelé respiration aérobie. Les microorganismes
sont qualifiés d’aérobies.
-----> Certains microorganisme ne peuvent se développer qu’en présence d’une
faible concentration d’O2. On les appelle des micro-aérobies. Les fortes
concentrations sont toxiques.
- autres accepteurs. Les bactéries sont adaptées à leur milieu et à la nature des
accepteurs présents. Le métabolisme est appelé respiration anaérobie. Les
microorganismes sont qualifiés d’anaérobies.
NO3-
NO2-
N2
SO42-
SO32-
S2- (H2S)
CO2 + 4.H2
CH4 + 2.H2O
- molécules produites par le métabolisme. Dans ce cas, le substrat n’est pas
dégradé entièrement. On parle de fermentation. Celle-ci ne nécessite pas d’O2 est
anaérobie.
-----> Il existe trois types d’organismes anaérobies :
- les microorganismes possédant des voies métaboliques aérobie et anaérobie. Ce
sont les aéro-anérobies.
- les microorganismes indifférents à l’O2. Ce sont les anaérobies aéro-tolérants.
-----> en pratique on a du mal à différencier ces deux types que l’on regroupe
sous le terme aéro-anérobie.
- les microorganismes pour qui l’O2 est toxique et qui ne se développent qu’en son
absence. Ce sont les anaérobies stricts.
2.1. Oxydase / catalase.
2.1.1. Oxydase.
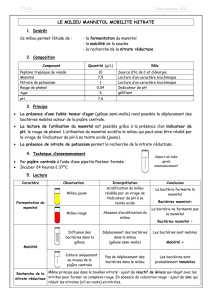
Les bactéries qui possèdent un métabolisme respiratoire, contiennent une
enzyme particulière, la cytochrome c oxydases. On met cette enzyme en évidence
par l’utilisation d’un réactif coloré, le N, N, N ', N' tétraméthyl- p-
phénylènediamine (TMPD) ou N, N de p la phénylènediamine (DMPD) qui devient
bleu lorsqu’il est oxydé par le cytochrome.
DMPD
- On prélève une colonie pure avec la pointe d’une pipette Pasteur ou d’un fil
platine.
- On l’écrase sur un disque de papier imprégné de réactif.
- On observe la coloration au bout d’une minute.
2.1.2. Catalase.
La catalase catalyse la transformation du peroxyde d'hydrogène en eau et
dioxygène: 2.H2O2 O2 + 2.H2O
- Sur une lame de verre propre, on dépose une goutte de H2O2,

- On la met en contact avec une colonie isolée, prélevée directement avec une
pipette pasteur boutonnée ou une anse plastique à usage unique.
-----> le platine de l’oese réagit avec l’eau oxygénée et donne de faux-positifs.
-----> Si des bulles se forment, la bactérie possède la catalase.
-----> Si rien n'est observable, la bactérie ne possède pas l'enzyme.
-----> Il est déconseillé de faire ce test à partir d'un bouillon de culture
ensemencé, car le résultat est moins net.
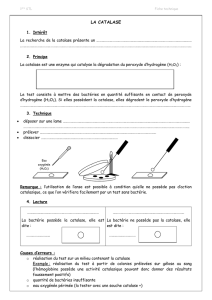
-- La recherche de la catalase n’est pas systématique :
- Du fait de la production de dioxygène par la catalase, elle est absente chez les
bactéries anaérobies strictes.
- La plupart des bactéries à Gram négatif possèdent une catalase (catalase +).
La recherche de la catalase sur ce type de bactéries ne présente donc aucun
intérêt,
-- On réserve ce test aux bactéries Gram positif. Il permet de différencier :
- les bactéries des genres Staphylococcus et Micrococcus (catalase +)
- des bactéries des genres Enterococcus, Streptococcus (catalase -)
2.2. VF.
2.2.1. Caractéristiques du milieu.
-- Le bouillon Viande-Foie permet de déterminer le comportement de la
bactérie vis à vis de l’O2.
-- Par quel principe ?
-- Le secret est dans la forme du
tube, long et étroit. La surface du milieu
est très faible et limite les échanges
gazeux. Ainsi l’O2 pénètre uniquement
dans le haut de la gélose. Tout le bas en
est dépourvu.
-- Et alors ?
- Les bactéries qui se
développent dans la partie
supérieure sont dépendantes de
l’O2, ce sont des aérobies stricts.
- celles qui se développent
uniquement dans la partie
inférieure sont tuées par l’O2, ce
sont des anaérobies stricts.
- Celles qui se développent sur
toute la hauteur sont des aéro-
anaérobies facultatives.
- Enfin, celles qui forment des
colonies à un centimètre de la
surface sont des micro-aérobies.
La présence de bulles
indique la production de gaz.

2.2.2. Mode d’utilisation.
- Régénération :
Le tube est placé au bain-marie 20 minutes, puis
conservé à 45°C (surfusion)
-----> la régénération permet d’éliminer les gaz
dissous dans le milieu.
Ensemencement :
- on prélève une colonie au bout d’une pipette
bouchée
- on la pique jusqu’à un centimètre du fond
- on le remonte en décrivant une spirale.
Incubation :
Le tube est placé à l’étuve bouchon non bloqué.
g.L-1
base viande-foie
30
Glucose
2
Agar
6
pH
7,4
2.3. Tryticase -Soja.
-- C’est un milieu adapté aux souches exigeantes.
g.L-1
Hydrolysat trypsique de caséine
15
peptone de soja
5
Chlorure de sodium
5
Agar
15
pH
7,3
Ensemencement :
On effectue une simple strie.
-----> Un quart de boîte suffit pour ensemencer une souche : on peut donc
ensemencer les 4 souches sur une seule boîte. En pratique on ensemence
deux boîtes identiques.
Incubation :
Une boîte est incubée en aérobiose
Une boîte est incubée en anaérobiose. Elle est placée dans une boîte
hermétique où l’on allume une bougie. La flamme consomme tout l’O2 présent.
Lecture :
Si la souche se développe sans O2, elle est anaérobie.

3. Métabolisme glucidique.
-- Le métabolisme glucidique relâche des acides dans le milieu. Ceux-ci sont
mis en évidence grâce à des indicateurs de pH. Le principe est simple, si au cours
de l’incubation, le milieu change de couleur, c’est qu’il s’acidifie. Donc, la souche
consomme le sucre disponible dans le milieu. L’interprétation dépend de
l’environnement (aérobiose ou anaérobiose).
3.1. Voie d’attaque du glucose.
-- On utilise le milieu de Hugh et Leifson. Il contient du bleu de bromothymol
qui permet la mise en évidence du métabolisme glucidique. Ce test obéit au même
principe que le VF. Un tube long et fin limite les échanges gazeux et crée un
gradient d’O2. Si le glucose est consommé en aérobiose, il s’agit d’une respiration,
s’il l’est en anaérobiose, c’est une fermentation.
n grammes par litre d'eau distillée
Extrait de levures
1
Peptone pancréatique de caséine
2
NaCl
5
K2HPO4
0
,3
Agar
3
Bleu de bromothymol (solution aqueuse à
0,2g %)
1
5mL
Eau distillée (qsp)
1
L
3.1.1. Mode d’utilisation.
Régénération :
Le tube est placé au bain-marie 20 minutes, puis
conservé à 45°C (surfusion)
-----> la régénération permet d’éliminer les gaz
dissous dans le milieu.
- Ensemencement :
- on prélève une colonie au bout d’une pipette
bouchée ou d’un fil droit.
- on la pique jusqu’à un centimètre du fond
- on le remonte en décrivant une spirale.
- Incubation :
Le tube est placé à l’étuve bouchon non serré.
3.1.2. Lecture.
-- Le bleu de bromothymol réagit
en fonction du pH. La coloration jaune
indique la présence de métabolisme
glucidique.
-- Il existe trois cas principaux :
- la souche métabolise le glucide uniquement en présence d’O2. Elle est aérobie.
- la souche métabolise le glucide uniquement en absence d’O2. Elle est anaérobie.
- le métabolisme de la souche est indifférent à l’O2, elle est aéro-anaérobie
facultative.
-----> Si la souche n’utilise pas le glucide elle laisse le tube entièrement vert.
-----> Si la souche utilise préférentiellement les peptones, le tube tourne au
bleu (alcalinisation du milieu).

3.2. Utilisation du lactose.
-- Le milieu de Kligler-Hajna est un milieu de culture permettant la recherche
simultanée de :
- L'utilisation du lactose
- La fermentation du glucose
- La production d'H2S
- La production de gaz
- La -galactosidase pour les bactéries
lactose - (test ONPG).
C’est une demi-pente qui
présente :
- une pente
- un culot
3.2.1. Ensemencement.
-- On pique dans le culot avec un fil droit et on le retire en faisant une strie sur
la pente.
3.2.2. Lecture.
Métabolisme glucidique.
Le rouge de phénol indique la présence d’un métabolisme glucidique
(glucose et/ou lactose)
Les bactéries consomment le lactose grâce à une enzyme, la
galactosidase.
- Dans un premier temps, les bactéries glucose + consomment le glucose et
acidifient le milieu. Pente te culot vire au jaune-oranger.
- A cause de sa faible concentration, le glucose est rapidement (une ou deux
heures) épuisé.
Si la bactérie est lactose+ : le métabolisme glucidique continue et le milieu
reste jaune.
-----> pente jaune = lactose +
Si la bactérie est lactose- : le métabolisme des peptones alcalinise le milieu.
Sur la pente l’élimination du CO2 par échange gazeux accélère le processus.
HCO3- -------> H2CO3 ------> CO2 + H2O
Tandis qu’il reste lent dans le culot.
-----> pente rouge = lactose -
Dans le cas des bactéries lactose-, on confirme ce caractère par le test de
l’ONPG. On dépose une colonie sur un disque imprégné d’ONPG. Si la bactérie
possède la galactosidase, le disque devient noir.
Production de gaz.
On détermine également la présence de gaz par apparition des bulles ou
d’un décollement de la gélose.
Production de H2S.
La production de sulfure d’hydrogène est mise en évidence grâce à la
formation d’un précipité noir.
Le sulfure d'hydrogène réagit avec les ions fer III (Fe3+) du citrate de fer pour
former un précipité de sulfure de fer noir. Ainsi :
- Bactéries H2S + : précipité noir ;
- Bactéries H2S - : pas de précipité noir.
g.L-1
Peptone
15
Extrait de viande
3
Extrait de levure
3
Peptone pepsique de viande
5
Glucose
1
Lactose
10
Rouge de phénol
25 mg
Chlorure de sodium
5
Sulfate ferreux
0,2
Thiosulfate de sodium
0,3
Agar
11
 6
6
 7
7
 8
8
1
/
8
100%