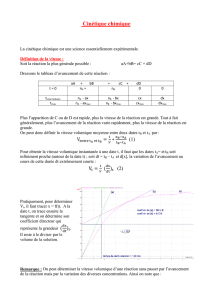
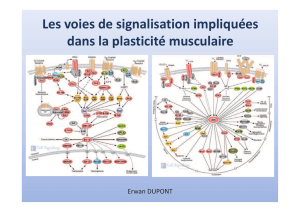
AKT ERK

Interactions neurone-glie dans la chorée
de Huntington
Etude génétique chez la drosophile
Jean-Charles Liévens
Equipe Catherine Faivre-Sarrailh
NICN - Institut Jean Roche
Marseille

1872 : George Huntington
maladie familiale
1996 : Premier modèle transgénique murin – Souris R6 (G.P. Bates)
1692 : Procès des sorcières de Salem
Chorée de Huntington
1993 : Huntington’s Disease Collaborative Research Group
> 35 CAG exon 1 du gène huntingtine
> 35 résidus glutamine = polyQ
1998 : Premier modèle drosophile – (G. Jackson)

- dysfonctionnement neuronal précoce
- perte tardive et sélective des neurones
du striatum et cortex cérébral
Chorée de Huntington
patient
normal
- 6 000 patients en France
- SCA 1, 2, 3, 6, 7, 17 / DRPLA / SBMA
- déficits moteurs, troubles cognitifs
- décès : 15-20 années
- début : 40-55 ans mais lié au nombre de répétitions CAG

répétition de glutamines
NH2 COOH
NH2 COOH
6-35
polyQ
> 36 polyQ
NH2
> 36 polyQ Fragment NH2-terminal accumulation et toxicité
caspases
Huntingtine humaine ≈3144 aa (349 kDa), protéine cytoplasmique et nucléaire
Protéine neuronale et gliale
aa 500-600
caspases
Chorée de Huntington
II- Forme pathogène
I- Forme native

Transgène dans tout le tissu cérébral
sous le contrôle du promoteur de htt
4 6 8 10 12 14 16
Semaines
Dysfonctionnement neuronal
Déficits moteurs et cognitifs
Dégénérescence neuronale
Mortalité
Transgène ≈160 CAG
(polyQ) 2 kb
Promoteur htt Huntingtine Exon 1
Lignée murine R6/2
Inclusions intranucléaires
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
1
/
51
100%