La maladie de Chagas : une parasitose latino- américaine

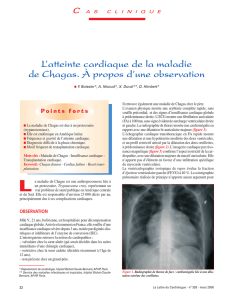
Figure 1. Triatoma infestans, principal vecteur de la
maladie de Chagas (Association française des ensei-
gnants de parasitologie et mycologie) [© ANOFEL].
172 | La Lettre de l’Infectiologue • Tome XXVIII - no 5 - septembre-octobre 2013
MISE AU POINT
La maladie de Chagas :
une parasitose latino-
américaine émergente
en dehors de ses zones
d’endémie
Chagas’ disease: a Latin American parasitosis emerging
outside its endemic zones
M. Develoux*, G. Le Loup**, G. Pialoux**
* Service de parasitologie, hôpital
Saint-Antoine, Paris.
** Service des maladies infectieuses
et tropicales, hôpital Tenon, Paris.
L
es premières observations de maladie de Chagas
chez des migrants sud-américains récemment
arrivés en France ont été publiées en 2008. Dans
cette population, la majorité des cas est au stade
chronique indéterminé asymptomatique. Le défi
a été d’obtenir rapidement des sérologies fiables,
le diagnostic à ce stade ne pouvant être qu’indi-
rect, puis d’obtenir et de manier l’une ou l’autre
des 2 molécules disponibles, dont les effets indési-
rables sont fréquents. On estime qu’il y a plusieurs
centaines de personnes infectées en France et que
seule une infime minorité a pu, jusqu’à aujourd’hui,
bénéficier d’un dépistage et d’un traitement.
La maladie de Chagas :
rappels parasitologiques
et épidémiologiques
La maladie de Chagas, ou trypanosomose américaine,
est due à un protozoaire flagellé sanguicole, Trypa-
nosoma cruzi (1). Elle a été décrite par Carlos Chagas,
scientifique brésilien, en 1909. Les véritables impor-
tance et diffusion de cette infection n’ont été réalisées
que tardivement. Il existe des souches différentes de
T. cruzi, dont la sensibilité aux molécules disponibles
est variable. Le parasite est transmis par de grosses
punaises hématophages, les réduves (figure 1). Seules
quelques espèces sont des vecteurs compétents, dont
la principale est Triatoma infestans, espèce domes-
tique rencontrée dans le cône sud du continent améri-
cain. Les espèces domestiques infestent les maisons
et leurs annexes. On les trouve dans les interstices des
murs en torchis et les toits en chaume des habitations
rustiques des populations rurales les plus démunies.
La trypano somose américaine est avant tout une
maladie de la pauvreté ; l’amélioration du niveau de
vie et de l’habitat participe à la lutte contre celle-ci.
Il existe un important réservoir animal comprenant
des espèces domestiques et surtout sauvages, ce qui
ne permet pas d’envisager leur éradication.
La contamination se fait par l’intermédiaire des fèces
d’un réduve infecté contenant les formes méta-
LI 5 sept-oct 2013.indd 172 29/10/13 10:39

Figure 2. Forme trypomastigote de Trypanosoma cruzi
dans un frottis sanguin.
La Lettre de l’Infectiologue • Tome XXVIII - no 5 - septembre-octobre 2013 | 173
Points forts
»
La maladie de Chagas, ou trypanosomose américaine, est une zoonose parasitaire due à un protozoaire
flagellé :
Trypanosoma cruzi
.
»
Elle est transmise par les triatomes, insectes hématophages. La transmission peut être également
verticale (transfusions et transplantation), congénitale ou orale.
»Avec la migration de populations d’Amérique latine vers les pays du nord (États-Unis, Canada, Europe de
l’Ouest), la maladie de Chagas est devenue émergente en dehors de ses zones d’endémie. Les États-Unis et
l’Espagne sont les pays les plus concernés par ce nouveau problème de santé publique. D’autres pays euro-
péens sont aussi concernés, comme la France, qui, de plus, a un département, la Guyane, où la transmission
vectorielle et non vectorielle existe. Les différents modes de transmission en dehors de la zone endémique
et les principales manifestations cliniques devraient être portés à la connaissance des praticiens français.
Mots-clés
Maladie de Chagas
Migrants
Transfusion
Transmission
maternofœtale
Dépistage
Highlights
»
Chagas’ disease or American
trypanosomiasis is a zoonotic
parasitosis due to
Trypanosoma
cruzi,
a flagellated protozoan.
»
It is transmited by haemo-
tophagous triatomine bugs;
transmission can also be
vertical (blood and transplan-
tation), congenital and oral.
»
Chagas’ disease became
emergent outside its endemic
zones with the migration of
populations from Latin America
to northern countries. The
United States of America and
Spain are the most affected by
this new public health problem.
Other European countries like
France are also concerned.
France furthermore has an
overseas department, Guiana,
where vectorial and non vecto-
rial transmission exists. The
different risk of transmission
outside the endemic zone and
the main clinical manifestations
should be spread to the French
practitioners.
Keywords
Chagas’ disease
Immigrants
Transfusion
Maternal-fetal transmission
Screening
cycliques du parasite. Elles sont émises de façon
réflexe lors de la piqûre ; la pénétration des parasites
au niveau de la peau ou des muqueuses est favorisée
par un prurit au point de piqûre, ou par le contact
des doigts au niveau de la conjonctive. Les formes
trypomastigotes (figure 2) pénètrent les cellules
proches du site d’inoculation et s’y transforment
en formes amastigotes non mobiles. Celles-ci se
multiplient par division binaire, se différenciant à
nouveau en formes trypomastigotes qui, par voie
sanguine, vont pénétrer les nouveaux sites d’infec-
tion, en particulier le tissu myocardique, le système
réticulo-endothélial et les plexus du système nerveux
autonome. La maladie va se dérouler en 3 phases :
➤phase aiguë, correspondant à la pénétration du
parasite ;
➤phase indéterminée asymptomatique, qui peut
durer toute la vie ;
➤
phase déterminée symptomatique, qui ne
concerne que 30 % des patients environ, après
10 à 20 ans d’évolution. Il s’agit avant tout d’une
maladie cardiaque, plus accessoirement digestive,
cette dernière forme n’étant observée que dans les
pays du cône sud de l’Amérique latine.
Il existe des modes de transmission non vectoriels,
ce qui fait l’une des originalités de cette parasi-
tose. Ces modes de transmission sont exclusifs en
dehors des zones d’endémie. Parmi les parasites
susceptibles d’être transmis par transfusion, c’est
avec T. cruzi que le risque est le plus élevé, de 10 à
20 %. L’infection peut être également contractée
par transplantation d’organe ou de cellules. La
transmission congénitale concerne entre 1 et plus
de 10 % des femmes enceintes infectées, suivant
les séries. De nombreux facteurs interviennent pour
expliquer ces différences. Les cas de contamination
orale se sont multipliés ces dernières années. Ils ont
été attribués à la consommation de jus de fruits
ou d’aliments souillés par des triatomes infectés
ou par leurs déjections (2).
La maladie de Chagas sévit du sud des États-Unis, où
les cas autochtones sont exceptionnels, jusqu’aux
pays du cône sud (Brésil, Bolivie, Argentine, Para-
guay), qui représentent le principal foyer. Dans les
années 1980, on estimait le nombre de personnes
infectées à 17,4 millions. Ce nombre a diminué de
moitié en 30 ans (1).
Physiopathologie
La physiopathologie est imparfaitement connue.
L’avancée récente est d’avoir démontré que les lésions
cardiaques chroniques sont dues à la persistance du
parasite dans le tissu myocardique (figure 3, p. 175).
Cela a modifié l’approche thérapeutique des formes
chroniques. D’autres phénomènes interviennent,
comme des altérations microvasculaires et une déner-
vation du système autonome. Le rôle de l’auto-immu-
nité est plus complexe et fait l’objet de controverses.
Clinique
La phase qui suit la pénétration des parasites est
le plus souvent asymptomatique. Lorsqu’ils sont
présents, les signes cliniques apparaissent 1 à
2 semaines après, plus tard s’il s’agit d’une conta-
mination transfusionnelle. Ils sont généralement
discrets : fièvre et syndrome grippal… Le signe de
Romaña, œdème bipalpébral unilatéral avec conjonc-
tivite et adénopathies satellites, est très évocateur.
Le chagome est une lésion cutanée de type furon-
culeux. Les formes graves d’invasion sont rares et
peuvent mettre en jeu le pronostic vital.
Après cette phase aiguë, qui dure de 4 à 8 semaines,
les sujets infectés entrent dans la forme chronique
indéterminée, avec disparition de la parasitémie et
apparition d’anticorps. Cette phase restera asymp-
LI 5 sept-oct 2013.indd 173 29/10/13 10:39

174 | La Lettre de l’Infectiologue • Tome XXVIII - no 5 - septembre-octobre 2013
La maladie de Chagas :
uneparasitose latino-américaine émergente en dehors de ses zones d’endémie
MISE AU POINT
tomatique pour la majorité d’entre eux. Seuls 30 à
40 % vont présenter une forme déterminée appa-
raissant après plusieurs années ou décennies. C’est
généralement dans la tranche d’âge de 30 à 40 ans
que surviennent les symptômes.
La cardiopathie chagasique est la complication la
plus fréquente (1). Elle se manifeste surtout par des
troubles du rythme : bradycardies, tachyarythmies.
L’insuffisance cardiaque est une manifestation plus
tardive. Un anévrisme apical du ventricule gauche
est pathognomonique. Les troubles du rythme et
l’anévrisme apical en font une cardiopathie très
emboligène.
La deuxième complication en termes d’importance,
qui peut être associée à la précédente, est l’atteinte
digestive. Le dysfonctionnement gastro-intestinal
résultant d’une destruction des neurones du système
nerveux entérique va aboutir à la formation de méga-
organes : méga-œsophage et mégacôlon. L’atteinte
neurologique primaire se traduit par une polynévrite
sensitivomotrice.
L’immunosuppression modifie l’histoire naturelle de
l’infection. Lorsqu’elle est marquée, on peut observer
une réactivation de la maladie (3). L’aspect clinique
varie suivant la nature de celle-ci. Lorsqu’il s’agit
d’une infection à VIH, le tableau est celui d’une encé-
phalite, qu’il faudra distinguer d’une toxoplasmose
cérébrale. Chez le sujet transplanté, la réactivation
associe fièvre, myocardite et signes cutanés. Il est
donc important de prévenir la réactivation par un
dépistage précoce de la maladie chez les patients
à risque.
Chez la femme enceinte, en cas de transmission verti-
cale, il existe un risque de retard de croissance, de
mort in utero ou de prématurité, mais ce risque est
faible (4). L’infection du nouveau-né, lorsqu’elle est
cliniquement parlante, peut s’exprimer par divers
tableaux : méningo-encéphalite, myocardite, hépa-
tosplénomégalie, détresse respiratoire. La mortalité
n’est pas négligeable et des issues fatales ont déjà
été signalées en Europe. Dans la majorité des cas,
l’infection est inapparente à la naissance ou oligo-
symptomatique.
Diagnostic biologique
La recherche du parasite dans le sang est l’examen de
choix dans les formes aiguës, les infections néona-
tales et les réactivations. La PCR est performante
dans le diagnostic précoce de l’infection congéni-
tale, parallèlement aux méthodes parasitologiques
directes dans les premiers mois. Durant la phase
chronique, où la parasitémie est difficilement
détectable, ce sont les méthodes sérologiques indi-
rectes qui vont permettre d’établir le diagnostic. On
préconise la pratique de 2 méthodes différentes, les
plus utilisées étant la méthode ELISA et l’immuno-
fluorescence. La PCR, au stade chronique, est moins
sensible, mais elle peut être intéressante lorsque
le résultat sérologique est indéterminé ou pour la
surveillance après traitement. La positivité de la PCR
indiquerait un échec du traitement.
Traitement
Les indications thérapeutiques du traitement anti-
parasitaire ont été modifiées ces dernières années (5).
Ce traitement était réservé jusqu’ici aux formes
aiguës ou de réactivation et aux formes chroniques
indéterminées de l’enfant et de l’adolescent. Les indi-
cations ont été élargies aux formes indéterminées de
l’adulte mais également aux formes comportant des
atteintes cardiaques et digestives. L’intérêt d’un trai-
tement antiparasitaire à ce stade fait encore l’objet
de controverses. Il repose sur 2 molécules anciennes,
le benznidazole (laboratoire brésilien Lafepe) et le
nifurtimox (distribué par l’OMS). Le benznidazole
est présenté sous forme de comprimés à 100 mg,
la dose recommandée étant de 10 mg/ kg/j pendant
60 jours. Des problèmes d’approvisionnement sont
apparus récemment, après la reprise de son indus-
trialisation par le laboratoire Lafepe. Pour répondre
aux besoins nationaux et internationaux, l’Argentine,
en 2012, a commencé à produire le benznidazole
(Abarax®) grâce à un consortium public-privé. Le
nifurtimox, sous forme de comprimés à 120 mg,
est diffusé par l’OMS, la dose est de 8 à 10 mg/kg/j
pendant 60 jours. Il n’existait pas de forme pédia-
trique, alors que ce sont les enfants, et surtout les
nouveau-nés contaminés par voie transversale, qui
doivent être traités en priorité. C’est en effet chez
les enfants que l’on obtient les meilleurs résultats
parasitologiques et que l’on observe le moins d’effets
indésirables, cela d’autant plus qu’ils sont jeunes.
Depuis peu, on dispose de comprimés de benznida-
zole dosés à 12,5 mg, et un dosage adapté à l’enfant
de nifurtimox (30 mg) devrait être disponible sous
peu. Les 2 molécules sont contre-indiquées chez la
femme enceinte. Le principal effet indésirable du
benznidazole est une dermatite d’hypersensibilité
qui s’observe vers le dixième jour du traitement.
Une intolérance digestive concerne environ 5 %
des patients. Les polynévrites sont tardives, dose-
dépendantes, nécessitant l’arrêt du traitement. La
LI 5 sept-oct 2013.indd 174 29/10/13 10:39

Figure 3. Formes amastigotes de T. cruzi dans du tissu myocardique (Dr Huerre, institut
Pasteur).
La Lettre de l’Infectiologue • Tome XXVIII - no 5 - septembre-octobre 2013 | 175
MISE AU POINT
possibilité d’aplasies, également dose-dépendantes,
impose une surveillance de la numération pendant
le traitement. Les effets indésirables du nifurtimox
sont encore plus fréquents, d’ordre digestif ou neuro-
logique. Il est donc urgent de disposer de nouvelles
molécules. Certaines en sont déjà au stade II d’étude,
comme le posaconazole et le E1224, un précurseur
du ravuconazole.
Modifications épidémiologiques
de la maladie de Chagas
Les modifications épidémiologiques de cette para-
sitose ces 20 dernières années ont été nombreuses.
Elles témoignent des progrès de la lutte mais aussi
de l’apparition de nouvelles donnes qui posent de
nouveaux défis.
Grâce à la lutte contre les vecteurs, essentiellement
T. infestans, dans le cône sud du continent américain,
le nombre de personnes infectées a baissé dans des
proportions notables. Il était estimé à 7,7 millions
en 2005. Les pays où l’on observe les prévalences
les plus importantes actuellement sont la Bolivie
(6,8 %), l’Argentine (4,1 %), le Salvador (3,4 %),
le Honduras (3,1 %) et le Paraguay (2,5 %) [1]. La
transmission par T. infestans a pu être éliminée dans
certains pays comme l’Uruguay, le Brésil et le Chili.
Le dépistage et l’exclusion des donneurs de sang
infectés dans tous les pays endémiques ont fait que
ce type de transmission est devenu exceptionnel
en Amérique latine. Ces mesures ont entraîné une
baisse de l’incidence, qui est passée de 700 000 cas
par an en 1990 à 41 200 par an en 2006. En ce qui
concerne la mortalité, elle est passée de 50 000 par
an à 12 500 (1). Des problèmes ont émergé avec
l’apparition de résistances du vecteur aux insecti-
cides dans les régions semi-désertiques du Chaco
en Argentine. Un autre phénomène a été noté :
la domestication d’espèces semi-domestiques et
sauvages de triatomes.
Avec les migrations de populations rurales, on a
observé une urbanisation de la maladie en Amérique
latine. Des cas de transmission congénitale ont été
rapportés dans de grandes métropoles comme
Buenos Aires, où il n’y a pas de transmission vecto-
rielle. De même, on a noté dans cette même ville une
augmentation des cas de cardiopathie chagasique.
La parasitose s’est développée en Amazonie ces
dernières années, où sont apparues des épidémies
consécutives à une transmission par voie orale (2).
Ce type de transmission a été observé en Guyane (6).
Mais le fait majeur a été la migration de popula-
tions autochtones hors d’Amérique latine, diffusant
la maladie loin de sa zone endémique. Ce sont les
États-Unis et, dans une moindre mesure, le Canada
qui ont été les premiers confrontés au problème.
Plus de 300 000 sujets chagasiques vivent aux États-
Unis. La maladie a émergé également sur d’autres
continents : Australie, Japon et surtout Europe (7).
En 2009, 4 290 cas y ont été diagnostiqués, alors
que le nombre d’infectés est évalué entre 68 000
et 122 000. C’est l’Espagne qui est la première
concernée, mais l’arrivée récente de migrants en
provenance des pays andins concerne aussi l’Italie,
la Suisse et la France. Plusieurs cas de transmission
congénitale de la maladie de Chagas et quelques
observations de transmission par voie sanguine ont
été rapportés en Espagne (8, 9), mais également
dans d’autres pays européens. Des réactivations chez
des transplantés originaires de zones endémiques,
parfois mortelles (10), ont été rapportées. À notre
connaissance, il n’y a pas eu de cas de transmission
congénitale ou sanguine, ou de réactivation signalés
en France.
À l’occasion du diagnostic des premiers cas de maladie
de Chagas en France métropolitaine au début du
e
siècle, de nombreux problèmes se sont posés aux
praticiens confrontés à cette parasitose. La maladie
de Chagas est peu ou pas enseignée dans le cursus
médical, elle est donc mal connue. Quel bilan indis-
pensable fallait-il faire devant ces patients dont
la majorité était au stade chronique indéterminé
asymptomatique ? Comment obtenir un diagnostic
biologique fiable qui ne pouvait être qu’indirect ?
Ce dernier défi a concerné les parasitologues et les
LI 5 sept-oct 2013.indd 175 29/10/13 10:39

176 | La Lettre de l’Infectiologue • Tome XXVIII - no 5 - septembre-octobre 2013
La maladie de Chagas :
uneparasitose latino-américaine émergente en dehors de ses zones d’endémie
MISE AU POINT
spécialistes de la transfusion, qui ne maîtrisaient pas,
à l’époque, le diagnostic sérologique de cette infec-
tion. Qui fallait-il traiter ? Comment se procurer les
2 seules molécules disponibles et comment les manier
étant donné le risque élevé d’effets indésirables ?
Une expérience de dépistage ciblé de la maladie
de Chagas a eu lieu en Île-de-France (11). Deux
cent cinquante-quatre personnes, en majorité des
adultes boliviens recrutés par une association de
migrants, ont bénéficié d’un dépistage. La séropré-
valence globale était de 23,6 % ; 87,4 % des sujets
positifs étaient boliviens. Parmi eux, respectivement
23,6 % et 22 % présentaient des signes fonctionnels
cardiaques et digestifs. Ces chiffres sont similaires
à ceux retrouvés dans d’autres enquêtes en Europe.
Cette étude a révélé les difficultés à aborder cette
population de migrants des pays andins consti-
tuée presque exclusivement de sujets en situa-
tion irrégulière, ne parlant pas français. En France
métropolitaine, les groupes à risque sont les sujets
originaires d’Amérique latine (migrants, enfants
adoptés), les enfants nés de mère sud-américaine,
les expatriés et les touristes ayant séjourné en zone
endémique. En ce qui concerne ce dernier groupe,
le risque de contracter la maladie de Chagas est
minime et ne concerne pas le tourisme traditionnel.
Les chiffres ne peuvent être qu’approximatifs,
mais sur 157 000 sujets vivant en France qui ont
pu être exposés, on estime qu’il y a entre 825 et
2 619 personnes infectées, dont 63 à 555 pourront
présenter une cardiopathie chagasique (12).
L’originalité de la France est d’être le seul pays
européen ayant un département situé en zone
endémique, la Guyane. La maladie de Chagas y
était considérée comme exceptionnelle mais, ces
dernières années, le nombre de cas diagnostiqués
est en très nette augmentation : 192 cas de 2000 à
2009 (12). Le risque transfusionnel dans ce dépar-
tement a conduit à stopper les dons de sang en avril
2005, obligeant à importer les produits sanguins de
métropole. Le dépistage chez les donneurs de sang
en France métropolitaine a été mis en place en 2007.
C’est le deuxième pays européen, après l’Espagne, à
pratiquer un dépistage ciblé des donneurs de sang.
Sur la période allant du 1
er
mai au 31 décembre 2008,
4 637 479 dons ont été collectés. Sur les 163 740 qui
ont été testés (3,5 %), 5 donneurs séropositifs ont
été trouvés (13). Tous étaient des sujets originaires
de zone endémique. Ce dépistage est coûteux et
pourrait éventuellement concerner des populations
plus ciblées.
Le dépistage des jeunes femmes à risque, latino-
américaines ou originaires de cette partie du monde,
pour prévenir une transmission congénitale, n’est
pas systématique en France. Le plus indiqué serait
d’effectuer une sérologie chez celles désirant une
grossesse, afin de les traiter avant. Le dépistage
des femmes enceintes, qui ne peuvent être traitées
pendant leur grossesse, permettrait de détecter une
éventuelle transmission dès la naissance et de traiter
les nouveau-nés, chez qui le traitement est efficace
et bien toléré.
La maladie de Chagas en France métropolitaine est
devenue une réalité. De nombreux praticiens peuvent
y être confrontés : infectiologues, internistes, cardio-
logues, gastroentérologues, pédiatres, gynécolo-
gues-obstétriciens, hématologues, généralistes. Si
le dépistage des donneurs de sang et des donneurs
d’organes est en place, celui des femmes risquant de
transmettre la maladie pendant leur grossesse n’est
pas encore systématique. Des observations récentes
de contamination transfusionnelle, de réactivation
chez des immunodéprimés et de formes congénitales
dont l’issue a été parfois fatale ont été rapportées
dans des pays voisins. Elles illustrent bien la néces-
sité de faire connaître les populations à risque et les
modes de transmission de cette nouvelle infection
d’importation. ■
1. Rassi Jr A, Rassi A, Marin-Neto JA. Chagas disease. Lancet
2010;375(9723):1388-1402.
2. Shikanai-Yasuda M A, Carvalho NB. Oral transmission of
Chagas disease. Clin Infect Dis 2012;54(6):845-52.
3. Pinazo MJ, Espinosa G, Cortes-Lletget C et al. Immuno-
suppresion and Chagas disease : a management challenge.
PLoS Negl Trop Dis 2013;7(1):e1965.
4. Brutus L, Santalla JL, Salas NA, Schneider D, Chippaux JP.
Le dépistage de l’infection congénitale par Trypanosoma
cruzi en France métropolitaine. Bull Soc Pathol Exot 2009;
102:300-9.
5. Le Loup G, Pialoux G, Lescure FX. Update in treat-
ment of Chagas disease. Curr Opin Infect Dis 2011;24(5):
428-34.
6. Basurko C, Aznar C, Blanchet D et al. Toxi-infection à
l’origine d’une épidémie familiale de la maladie de Chagas
en Guyane française. Bull Soc Path Exot 2006;99:307.
7. Basile L, Jansa JM, Carlier Y et al. Chagas disease in Euro-
pean countries: the challenge of a surveillance system. Euro
Surveill 2011;16(37):pii=19968.
8. Murcia L, Carrilero B, Munoz-Davila MJ, Thomas MC,
López MC, Segovia M. Risk factors and primary prevention
of congenital Chagas disease in a nonendemic country. Clin
Infect Dis 2013;56(4):496-502.
9. Flores-Chávez M, Fernández B, Puente S et al. Trans-
fusional Chagas disease: parasitological and serological
monitoring of an infected recipient and blood donor. Clin
Infect Dis 2008;46(5):e44-7.
10. Kocher C, Segerer S, Schleich A et al. Skin lesions,
malaise, and heart failure in a renal transplant recipient.
Transpl Infect Dis 2012;14(4):391-7.
11. Lescure FX, Paris L, Elghouzzi MH et al. Expérience de
dépistage ciblé de la maladie de Chagas en Île-de-France.
Bull Soc Pathol Exot 2009;102:295-9.
12. Dejour-Salamanca D, Blanchet D, Aznar C, La Ruche G,
Jeannel D, Gastellu Etchegorry M. La maladie de Chagas
(ou trypanosomose américaine) en France. Med Mal Infect
2012;42(8):344-8.
13. Assal A, Corbi C. Maladie de Chagas et transfu-
sion sanguine : un problème parasitaire émergent dans
les pays non endémiques. Transfus Clin Biol 2011;18:
286-91.
Références bibliographiques
L’auteur déclare ne pas avoir
de liens d’intérêts.
LI 5 sept-oct 2013.indd 176 29/10/13 10:39
1
/
5
100%