Les manipulations thermiques pendant l`embryogenèse affectent la

Sixièmes Journées de la Recherche Avicole, St Malo, 30 et 31 Mars 2005 67
LES MANIPULATIONS THERMIQUES PENDANT
L’EMBRYOGENESE AFFECTENT LA TEMPERATURE CORPORELLE ET LA
CROISSANCE DU POUSSIN
Collin Anne1, Shinder David2, Mercerand Frédéric1, Tesseraud Sophie1, Picard Michel1,
Yahav Shlomo2
1 Station de Recherches Avicoles, Institut National de la Recherche Agronomique, 37380
Nouzilly, France; 2Institute of Animal Science, ARO, The Volcani Center, P.O. Box 6, Bet
Dagan 50250, Israel.
Les manipulations thermiques pendant l’embryogenèse affectent la température corporelle et la
croissance du poussin
La sélection génétique des poulets de chair a favorisé leur croissance musculaire au détriment de leurs capacités
de thermorégulation. Nos études visent à évaluer les périodes sensibles de l’embryogenèse pendant lesquelles les
seuils de thermotolérance des poussins peuvent être manipulés. Deux expériences sont conduites pour déterminer
l’effet de manipulations thermiques de l’embryon sur le poids vif (PV), la température corporelle (Tc) et les axes
thyroïdien et corticotrope du poussin, à l’éclosion (j0) et lors d’un coup de chaleur à 3 jours (j3). Les oeufs
témoins sont incubés à 37,8oC pendant 21 jours. Dans l’expérience 1, les oeufs traités sont exposés, pendant
l’embryogenèse précoce (EP) de E8 à E10 ou pendant l’embryogenèse tardive (ET) de E16 à E18, 3h par jour à
39,5 (EP1 et ET1) ou 41,0oC (EP2 et ET2). Dans l’expérience 2, les oeufs traités sont soumis à 39,5°C pendant 3
(D1), 6 (D2), 12 (D3) ou 24 (D4) h/jour de E16 à E18. Dans les deux expériences, les traitements n’affectent pas
le PV à l’éclosion. Dans l’expérience 1, l’éclosabilité la plus élevée est enregistrée dans le groupe ET1, tandis
que les poussins EP1 et ET1 présentent les Tc les plus faibles à j0. Pendant le coup de chaleur, une hyperthermie
significative et des concentrations plasmatiques en triiodothyronine et corticostérone plus élevées sont décelées
chez les témoins, suggérant une stimulation de la production de chaleur et un stress accrus. Dans l’expérience 2,
les groupes D3 et D4 présentent un taux d’éclosion supérieur à celui du groupe D1. Tous les traitements
diminuent significativement Tc par rapport aux témoins à j0 et lors du coup de chaleur à j3. Dix-huit heures après
le coup de chaleur, les poussins D1 maintiennent une Tc plus faible que celle des D2, D3 et D4, mais avec un PV
plus élevé chez les poussins D2 et D3 que chez les témoins et D1. Le traitement ET1/D1 (3h/jour, 39,5°C, E16-
E18) semble donc favoriser la thermotolérance du poussin, alors que les traitements D2 et D3 (6 à 12h/j, 39,5°C,
E16-E18) paraissent stimuler la croissance initiale. Des recherches complémentaires sont nécessaires pour
évaluer ces réponses à plus long terme.
Thermal manipulations during embryogenesis affect body temperature and growth in broiler chicks
Genetic selection has favoured muscular growth of meat-type broiler chickens with adverse effects on their
ability to cope with environmental conditions. Present studies aimed at evaluating the possibility to manipulate
incubation conditions to improve thermotolerance acquisition. Two experiments were conducted to elucidate the
effects of thermal manipulations during embryogenesis on body weight (PV), body temperature (Tc), plasma
thyroid hormones and corticosterone concentrations of chicks at hatch (j0) and during a heat challenge at 3 days
of age (j3). Control embryos were incubated at 37.8oC during 21 days. In experiment 1, treated embryos were
exposed, during early embryogenesis (EP) from E8 to E10, or during late embryogenesis (ET) from E16 to E18,
to 3 h/d of exposure at 39.5 (EP1 and ET1) or 41.0oC (EP2 and ET2). In experiment 2, treated embryos were
submitted to 3 (D1), 6 (D2), 12 (D3) or 24 (D4) hours/day at 39.5°C from E16 to E18. In both experiments,
treatments did not affect PV at hatch. In experiment 1, the best hatchability was recorded in group ET1, whereas
chicks from groups EP1 and ET1 presented the lowest Tc at day 0. During the heat challenge, significant
hyperthermia associated with the highest triiodothyronine and corticosterone concentrations were recorded in the
control group, suggesting a higher stimulation of heat production and stress response than in the treated groups.
In experiment 2, D3 and D4 groups had higher hatchability than D1 group. All treatments significantly decreased
Tc as compared to controls at day 0 and during the heat challenge at day 3. Eighteen hours after the heat
challenge, D1 chicks maintained a lower Tc than D2, D3 and D4 chicks, but then D2 and D3 chicks were heavier
than control and D1 chicks. Treatment ET1/D1 (3h/day, 39.5°C, E16-E18) seemed to favour thermotolerance in
chicks, whereas treatments D2 and D3 (6 to 12h/day, 39.5°C, E16-E18) appeared to better initiate growth.
Additional research is necessary to evaluate these responses on a longer term.

Sixièmes Journées de la Recherche Avicole, St Malo, 30 et 31 Mars 2005
68
INTRODUCTION
Durant les cinquante dernières années, la sélection
génétique des poulets de chair a principalement
favorisé leur croissance musculaire. Cette sélection
n’a pas permis d’augmenter en proportion leurs
viscères (cœur, appareil respiratoire ; Havenstein et
al., 2003), réduisant les capacités des poulets de chair
à résister à des conditions environnementales
extrêmes telles que les coups de chaleur. Ces
évènements climatiques sont responsables d’une
diminution de la consommation d’aliment et des
performances de croissance, accompagnée de taux de
mortalités accrus causant des pertes économiques
importantes pour la production avicole. Ceci a relancé
l’intérêt des scientifiques pour les manipulations
thermiques du poussin ou de l’embryon dans le but
d’améliorer l’acquisition de la thermotolérance du
poulet de chair (De Basilio et al., 2001; Yahav et al.,
2004). Des manipulations thermiques pendant les
premiers jours post-éclosion, pendant lesquels la
régulation de la température corporelle et les
mécanismes de rétrocontrôles hormonaux sont encore
immatures (Dunnington et Siegel, 1984), provoquent
des changements dans les seuils de réponses
thermorégulatrices (Yahav, 2000). Il se pourrait
également que des manipulations thermiques pendant
l’incubation des œufs provoquent une altération
efficace des seuils de réponses thermorégulatrices de
l’embryon et du jeune poussin, en fonction de la
période et de l’intensité de la manipulation.
Ainsi, plusieurs études ont montré que l’exposition
d’embryons de poulets ou canards à des températures
élevées ou basses pendant l’incubation améliorait leur
capacité d’adaptation respectivement à des
environnements chaud ou froid post-éclosion (Minne
et Decuypere, 1984; Janke et al., 2002). Les
manipulations thermiques pendant l’embryogenèse
nécessitent un réglage précis en période, intensité et
durée d’exposition à la température expérimentale. Le
choix de la période doit être relié au développement et
à l’activation des axes hypothalamus–hypophyse-
thyroïde (Thommes, 1987) et hypothalamus–
hypophyse-surrénales (Wise et Frye, 1975) dans le but
de changer les seuils de réponses en termes de
production de chaleur et de stress. Récemment, Yahav
et al. (2004) ont démontré qu’une manipulation
thermique modérée des jours 16 à 18 de l’incubation
avait un effet positif sur la thermorégulation des
poussins en diminuant la température interne et les
taux plasmatiques d’hormones thyroïdiennes, connues
pour stimuler la production de chaleur. Epple et al.
(1997) suggèrent également que l’embryon de poulet
est sensible au stress, c’est pourquoi l’augmentation
de la température d’incubation pendant la première
période d’incubation puis à partir du jour 15, lors de
l’activation de l’axe corticotrope (Wise and Frye,
1975), peut affecter la réponse du poussin éclos en
terme de stress, avec des conséquences sur la
thermorégulation.
Enfin, la durée des manipulations thermiques durant
l’embryogenèse doit être finement évaluée. Une
augmentation courte de la température d’incubation
active les mécanismes de perte de chaleur des
embryons (Holland et al., 1997), tandis qu’une
exposition à plus long terme affecte la morphologie
embryonnaire, augmente l’incidence des
malformations et décroît l’éclosabilité (Janke et al.,
2002). Cependant, ces études ont été menées dans des
conditions expérimentales différentes, et l’évaluation
de la durée de manipulations thermiques dépend des
conditions précises d’incubation mises en œuvre.
Cette étude vise à évaluer les périodes sensibles de
l’embryogenèse pendant lesquelles les seuils de
thermotolérance des poussins peuvent être manipulés.
Deux expériences sont conduites pour déterminer
l’effet de l’intensité et de la durée de manipulations
thermiques de l’embryon sur le poids vif (PV), la
température corporelle (Tc) et les axes thyroïdien et
corticotrope des poussins à l’éclosion (j0) et lors d’un
coup de chaleur à 3 jours d’âge (j3).
1. MATERIELS ET METHODES
1.1. Procédure expérimentale
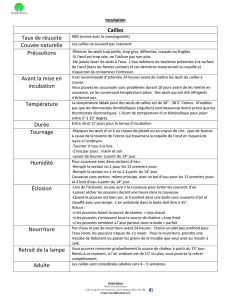
Expérience 1. Mille oeufs fertiles Ross PM3
provenant d’un seul troupeau reproducteur (44
semaines d’âge) sont mis en incubation. Les œufs sont
statistiquement divisés en 5 traitements (JMP®
statistics; SAS Institute, 2000): témoins, maintenus
continuellement à 37,8°C et 56% d’humidité relative
(HR), EP1 – 3 h/j à 39,5oC et 65% HR pendant
l’embryogenèse précoce (jours E8 à E10
d’incubation) ; EP2 – 3 h/j à 41,0oC et 65% HR
pendant la même période; ET1– 3 h/j à 39,5oC et 65%
HR pendant l’embryogenèse tardive (ET; E16 à E18);
ET2 – 3 h/j à 41,0oC et 65% HR pendant la même
période. Les œufs sont incubés dans un incubateur
semi-commercial (La-Nationale, type B 36I, Bretagne
France). Les œufs traités sont transférés dans deux
incubateurs expérimentaux (SMA Coudelou type 540
E) pendant 3 heures (12:00-15:00) durant les périodes
EP et ET, l’un maintenu à 39,5°C et 65% HR, et
l’autre à 41°C et 65% HR, puis sont replacés dans
l’incubateur semi-commercial. Dans chaque
incubateur, les oeufs sont inclinés de 270° toutes les
heures. A sept jours d’incubation, les œufs infertiles et
les embryons morts sont élimés après mirage. Le
19ème jour d’incubation, les oeufs sont transférés dans
un éclosoir maintenu à 37,8°C et 56% HR.
Expérience 2. Mille oeufs fertiles Ross PM3
provenant d’un seul troupeau reproducteur (40
semaines d’age) sont utilisés. Les conditions
d’incubations sont les mêmes que pour l’expérience 1
excepté en ce qui concerne les traitements, tous

Sixièmes Journées de la Recherche Avicole, St Malo, 30 et 31 Mars 2005 69
réalisés pendant la période embryonnaire tardive (E16
à E18 ; 39,5oC et 65% HR) : D1 – 3 h/j; D2 – 6 h/j;
D3– 12 h/j; D4 – 24 h/j.
Dans les deux expériences, l’éclosion est suivie heure
par heure avec comptage des poussins éclos. Après
séchage du duvet (environ 2h après l’éclosion), les
poussins sont extraits de l’éclosoir pour, dans l’ordre,
prise de température corporelle et pesée. La
température corporelle est mesurée à l’aide d’un
thermomètre digital DM 852 (précision de 0,1°C;
distribué par Ellab A/S, France), et d’une sonde pour
souris insérée dans le colon distal des poussins à une
longueur constante.
A la fin de l’éclosion, les poussins de chaque
traitement sont séparés en deux sous-groupes mis en
expérience dans deux chambres climatiques: poussins
« exposés » ou « non exposés ». Les poussins des
deux chambres sont alors élevés en conditions
régulières (32±1°C). A l’âge de 3 jours, les poussins
“exposés” subissent un coup de chaleur de 41oC
pendant 6 heures, alors que les poussins « non
exposés» sont maintenus à 32°C. Pendant la dernière
heure d’exposition au coup de chaleur, la température
corporelle de 20 poussins/traitement est mesurée dans
les deux chambres. Dans l’expérience 1, des
échantillons de sang sont également prélevés sur ces
animaux au niveau de la veine jugulaire.
Dix-huit heures après le coup de chaleur, le poids vif
et la température corporelle de tous les poussins
« exposés » et les « non exposés » sont mesurés dans
les deux expériences.
1.2. Analyses sanguines
Un dosage radio-immunologique est réalisé sur les
échantillons de plasma pour doser la triiodothyronine
T3 (kits Coat-A-Count T3, Canin, Diagnostic Products
Corporation). La concentration plasmatique en
corticostérone est mesurée au moyen d’un kit de
dosage radio-immunologique ImmuChemTM double
anticorps (ICN Biomedical, Inc., Diagnostics
Division).
1.3. Analyses statistiques
Les données sont analysées statistiquement au moyen
d’une analyse de variance (ANOVA) suivie d’un test
de comparaison de moyennes de Tukey–Kramer-HSD
(JMP® software ; SAS institute, 2000). L’éclosabilité
est analysée grâce au test du Chi2. Les moyennes sont
considérées comme significativement différentes
lorsque P < 0.05.
Tableau 1 - Eclosabilité et température corporelle (Tc) des poussins à j0. Dans l’expérience 1, les embryons
traités sont soumis, respectivement des jours E8 à E10 (EP) ou E16 à E18 (ET) d’incubation, à 3 h/j d’exposition
à 39,5°C (EP1 et ET1) ou 41°C (EP2 et ET2). Dans l’expérience 2, les embryons traités sont soumis à 3 h/j (D1),
6 h/j (D2), 12 h/j (D3) ou 24 h/j (D4) d’exposition à 39,5°C des jours E16 à E18.
Expérience 1 Témoins EP1 EP2 ET1 ET2
SEM
Eclosabilité (%) 92,5b 89,9b 89,7b 97,9a 92,5b ---
Tc (oC) 38,12ab 37,75b 37,97ab 37,72b 38,23a 0,09
Expérience 2 Témoins D1 D2 D3 D4
SEM
Eclosabilité (%) 87,8ab 82,7b 87,8ab 91,4a 91,0a ---
Tc (oC) 36,86a 36,34b 36,40b 36,43b 36,46b 0,13
En lignes, les variables désignées par des lettres différentes diffèrent significativement (P<0,05).
2. RESULTATS
2.1. Eclosion
Les manipulations thermiques de l’embryogenèse
précoce ou tardive n’affectent pas dans nos
conditions la cinétique du pic d’éclosion, qui est
enregistré entre 20 et 24 heures après l’éclosion des
premiers œufs. Cependant, dans les deux
expériences, l’éclosabilité moyenne est
significativement affectée par les traitements
(Tableau 1). Dans l’expérience 1, l’éclosabilité est
plus élevée dans le groupe ET1 que dans les autres
groupes, alors que dans l’expérience 2,
l’éclosabilité est plus élevée pour les groupes D3 et
D4 que pour le groupe D1.
Le poids vif des poussins à l’éclosion ne diffère pas
entre traitements dans les 2 expériences. Dans
l’expérience 1, les poussins EP1 et ET1 présentent
les Tc les plus faibles à j0. Dans la seconde
expérience, tous les poussins traités présentent des
Tc plus faibles que celle des témoins.
2.2 Coup de chaleur
Expérience 1. A 3 jours, le coup de chaleur de 6
heures a pour conséquence une élévation de la
température corporelle chez tous les poussins
traités plus faible que chez les poussins témoins
(Tableau 2). Les concentrations plasmatiques en T3
tendent à être plus faible chez les poussins traités
que chez les poussins témoins (P = 0,074). Les
concentrations plasmatiques en corticostérone sont
significativement inférieures dans le groupe ET1
que dans les groupes témoin et ET2. A l’âge de 4
jours, 18 heures après le coup de chaleur, les
poussins ET1 présentent une Tc plus faible que
celle des poussins témoins et EP2. Aucune
différence de poids vif n’est alors enregistrée entre
les groupes de poussins ayant subi le coup de
chaleur (données non présentées).
Expérience 2. Pendant le coup de chaleur, les 4
groupes de poussins traités présentent des
températures corporelles significativement

Sixièmes Journées de la Recherche Avicole, St Malo, 30 et 31 Mars 2005
70
inférieures à celle des poussins témoins (Tableau
3). Dix-huit heures après le coup de chaleur, les
poussins traités D1 ont une Tc significativement
inférieure à celle des poussins D2, D3 et D4. Le
poids vif des poussins n’ayant pas subi le coup de
chaleur (« non-exposés ») reste non différent entre
traitements (données non présentées), alors qu’il
existe des différences significatives entre les PV
des animaux « exposés » au coup de chaleur : les
poussins traités D2 et D3 présentent des poids vifs
supérieurs à ceux des poussins témoins et D1 (P <
0.05).
Tableau 2 - Température corporelle (Tc), concentrations plasmatiques en triiodothyronine (T3) et corticostérone
(cort) des poussins exposés à un coup de chaleur à l’âge de 3 jours, et Tc des poussins 18 h après le coup de
chaleur (Tc 18h) (expérience 1).
Traitements
Variables Témoins EP1 EP2 ET1 ET2
SEM
Tc (oC) 44,04a 42,78b 43,01b 42,66b 42,96b 0,20
T3 (ng/ml) 1,94 1,25 1,32 1,19 1,37 0,19
Cort (ng/ml) 34,31a 23,79ab 23,80ab 18,59b 35,67a 3,66
Tc 18h (°C) 40,58a 40,39ab 40,56a 40,14b 40,31ab 0,11
En lignes, les variables désignées par des lettres différentes diffèrent significativement (P<0,05).
3. DISCUSSION
Les manipulations thermiques réalisées au cours de
l’embryogenèse, dans le but d’améliorer
l’acquisition de la thermotolérance du poulet, sont
fondées sur l’hypothèse que les seuils de régulation
des axes hypothalamus–hypophyse-thyroïde et
hypothalamus–hypophyse–surrénales peuvent être
altérés durablement lorsque ces axes sont encore en
cours de développement. Selon le modèle de
Gluckman (1985), le contrôle endocrinien entre les
systèmes nerveux central et périphérique est affecté
par la sécrétion pulsatile d’hormones
hypothalamiques pendant l’embryogenèse, qui vont
agir sur l’hypophyse pour stimuler la sécrétion des
hormones périphériques associées. Ces hormones
sont impliquées dans les rétrocontrôles négatifs sur
l’hypothalamus, établissant ainsi des « seuils » de
régulation des organes en développement.
Les périodes de manipulations thermiques E8 à
E10 et E16 à E18 ont été choisies en fonction du
développement et du fonctionnement des axes
thyroïdien et corticotrope. La phase embryonnaire
E8 à E10 correspond à une période où la glande
thyroïde est capable de synthétiser des
iodothyronines (E8-E9) et de sécréter la thyroxine,
et l’hypophyse la TSH (E10). L’axe hypothalamus-
hypophyse-thyroïde est relié entre les jours E10 et
E11 (Thommes et al., 1984). Un traitement
thermique antérieur ou concomitant à cette période
est susceptible d’affecter le seuil de déclenchement
des réponses en terme de production de chaleur. En
outre, les taux plasmatiques d’hormones
thyroïdiennes augmentent pendant l’embryogenèse
tardive, jouant un rôle majeur dans la maturation
finale des tissus et l’intégration des fonctions
physiologiques conduisant à l’éclosion.
Dans nos conditions, les manipulations thermiques
à 39,5°C, quelles que soient l’expérience et la
période d’application considérées, diminuent la
température corporelle des poussins à la naissance.
Le coup de chaleur induit une hyperthermie chez
les poussins témoins des deux études par rapport
aux poussins traités, ce qui coïncide pour
l’expérience 1 avec une moindre réduction des taux
plasmatiques de T3 chez les témoins. En effet, les
poussins EP1, EP2, ET1 et ET2 présentent des Tc
significativement inférieures, associées à des taux
plasmatiques en T3 légèrement plus faibles que
ceux des témoins (P = 0.074) après 6 heures de
coup de chaleur. La baisse des taux plasmatique de
T3 pourrait entraîner une moindre augmentation de
la production de chaleur et donc de la température
corporelle des poussins traités, puisque cette
hormone est un des régulateurs majeurs de la
thermogenèse chez l’oiseau (Decuypere et al.,
1981). Dix-huit heures après le coup de chaleur, les
poussins ET1 sont les seuls à garder une
température corporelle inférieure à celle des
témoins. Ces résultats vont dans le sens d’une
meilleure acquisition de la thermotolérance chez
tous les poussins traités, particulièrement chez les
ET1 de l’expérience 1.
Les manipulations thermiques appliquées pendant
l’embryogenèse tardive coïncident en outre avec la
période d’activation de l’axe corticotrope et
pourraient avoir une influence sur la réponse du
poussin au coup de chaleur en termes de stress.
Ainsi, les résultats de l’expérience 1 font état d’une
forte élévation des taux plasmatiques en
corticostérone chez les témoins et les poussins ET2
en comparaison avec les taux enregistrés chez les
ET1, les poussins ayant subi des manipulations
pendant l’embryogenèse précoce présentant des
valeurs intermédiaires. Ces résultats suggèrent
qu’un conditionnement à 39,5°C pendant
l’embryogenèse tardive peut limiter le stress lié au
coup de chaleur à 3 jours.
Enfin, la durée des manipulations thermiques de
l’embryon est susceptible de jouer un rôle majeur
dans l’équilibre entre performances d’éclosion et de
croissance, et acquisition de la thermotolérance.
Pour pouvoir être appliquées, ces manipulations
doivent être modérées et ne pas occasionner

Sixièmes Journées de la Recherche Avicole, St Malo, 30 et 31 Mars 2005 71
d’effets défavorables sur l’éclosabilité et la
croissance (Yahav et al., 2004). Alors que l’étude
de Lay et Wilson (2002) ne montre pas d’effet de
l’élévation de température d’incubation à 40,6°C
(24h) au jour E16 sur l’éclosabilité, les
manipulations à 39,5oC entre E16 et E18 ont des
effets contrastés selon l’expérience considérée.
Dans l’expérience 1, l’éclosabilité la meilleure est
enregistrée pour le groupe ET1, alors que ce groupe
(D1) a la moins bonne éclosabilité dans
l’expérience 2. D’une expérience à l’autre, dans des
conditions expérimentales similaires (excepté le
troupeau de reproductrices et leur âge), il peut donc
exister une grande variation de résultats. Ceci
impose de mesurer le critère d’éclosabilité sur de
plus grands effectifs dans des incubateurs
commerciaux. Dans les deux expériences, aucun
effet des traitements sur le poids vif n’est noté à
l’éclosion. En revanche, il semble que les
traitements thermiques D2 et D3 couplés à un coup
de chaleur (2ème conditionnement postnatal) à j3
favorisent la croissance du poussin. La raison de
cette meilleure initiation de la croissance pourrait
être une croissance compensatrice dans les groupes
D2 et D3 à l’issue du coup de chaleur. D’une part
les manipulations thermiques entre E16 et E18
surviennent pendant le développement des
myoblastes fœtaux et la période principale de
développement des cellules satellites musculaires
(Stockdale, 1992), qui contribuent à la taille finale
du muscle et à sa capacité d’hypertrophie. D’autre
part, le coup de chaleur est appliqué à 3 jours
d’âge, ce qui correspond à la période optimale pour
les conditionnements thermiques postnatals ayant
une incidence sur la thermorégulation et
l’accélération de la croissance du poussin (Yahav et
Plavnik, 1999). On peut donc supposer que dans la
2ème expérience, la combinaison des deux
traitements pendant l’embryogenèse tardive (6 à
12h/j) et la période postnatale pourrait avoir un
effet bénéfique sur la croissance du poussin.
CONCLUSION
Les manipulations thermiques ET1/D1 de 3h/jour à
39,5°C pendant E16-E18 semblent donc favoriser la
thermotolérance du poussin, alors que les
traitements D2 et D3 (6 à 12h/j, 39,5°C, E16-E18)
paraissent stimuler la croissance initiale. Des
recherches complémentaires sont nécessaires pour
évaluer ces réponses à plus long terme.
REMERCIEMENTS
Merci à M. Tanzi et J.-M. Brigant pour leur aide
technique au couvoir et sur l’élevage, et à M.
Quentin pour son aide dans le suivi de l’éclosion.
Tableau 3 - Température corporelle des poussins exposés à un coup de chaleur à 3 jours (Tc), poids vif (PV 18h)
et température corporelle (Tc 18h) 18 h après le coup de chaleur sur les même animaux (expérience 2).
Traitements
Témoins D1 D2 D3 D4
SEM
Tc (°C) 42,60a 41,89b 42,01b 41,83b 41,93b 0,09
Tc 18h (oC) 40,89ab 40,73b 40,98a 41,00a 41,03a 0,05
PV 18h (g) 87,2b 87,8b 93,9a 93,7a 89,2ab 1,9
En lignes, les variables désignées par des lettres différentes diffèrent significativement (P<0,05).
REFERENCES BIBLIOGRAPHIQUES
De Basilio, V., M. Picard, 2002. Inra Pa 15(4):235-245.
Decuypere, E. , S.C. Hermans, H. Michels, E.R. Kühn, J. Verheyen, 1981. Adv Physiol Sci 33:291-298.
Dunnington, E.A., P. B. Siegel, 1984. Poult. Sci. 63: 1303-1106.
Epple, A., B. Gower, M.T. Busch, T. Gill, L. Milakofsky, R. Piechotta, B. Nibbio, T. Hare, M.H. Stetson, 1997.
Am. Zool. 37:536-545.
Gluckman, P.D., 1985. In: C.T. Jones And P.W. Nathanielsz (Ed.) The Physiological Development Of The Fetus
And Newborn. Pp. 103-111. Academic Press, London.
Havenstein, G. B., P. R. Ferket, M. A. Qureshi, 2003. Poult. Sci. 82:1509-1518.
Holland, S., M. Nichelmann, J. Höchel, 1997. Verh. Dtsch. Zool. Ges. 90:105.
Janke, O., B. Tzschentke, J. Höchel, M. Nichelmann, 2002. Comp. Biochem. Physiol. 131a:741-750.
Lay, D. C., M. E. Wilson, 2002. J. Anim. Sci. 80:1954-1961.
Minne, B., E. Decuypere, 1984. Arch. Exper. Vet. Med. 38:374-383.
Stockdale, F. E., 1992. Dev. Biol. 154:284-298.
Thommes, R. C., 1987. J. Exp. Zool. Suppl. 1:273-279.
Thommes, R.C., N.B. Clark, L.L.S. Mok, S. Malone, 1984. Gen. Comp. Endocrinol. 54: 324-327.
Wise, P. M., B.E. Frye, 1975. J. Exp. Zool. 185:277-292.
Yahav, S., 2000. Poult. Avian Biol. Rev. 11:81-95.
Yahav, S., I. Plavnik., 1999. Br. Poult. Sci. 40 :120-126.
Yahav, S., R. Sasson Rath, D. Shinder, 2004. J. Therm. Biol. Sous Presse.
1
/
5
100%