Fonction hématopoïétique du placenta

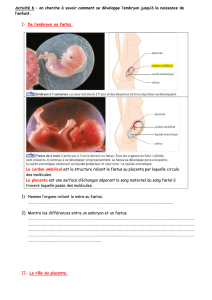
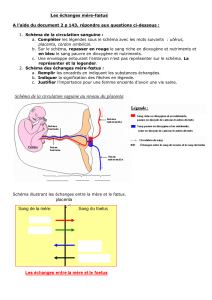
Revue
Fonction hématopoïétique du placenta
Hematopoietic role of the placenta
Françoise Dieterlen-
Lièvre
1,2
Catherine Corbel
3
Josselyne Salaün
1,2
1
Laboratoire d’embryologie cellulaire
et moléculaire du CNRS et du Collège
de France, Nogent-sur-Marne
2
adresse actuelle : CNRS, UPR 2197,
Bâtiment 32-33, avenue de la Terrasse,
91498 Gif-sur-Yvette
3
Institut Cochin,
département d’hématologie,
INSERM U567, CNRS UMR 8104,
Université Paris Descartes,
Faculté de Médecine René Descartes,
UM3, 123, boulevard de Port-Royal
75014 Paris
Résumé.Pendant l’ontogenèse, la production des cellules sanguines est assurée
successivement par plusieurs organes. Chez les mammifères, le foie fœtal joue un
rôle majeur, étant le siège de la multiplication de cellules souches hématopoïéti-
ques (CSH) et de la différenciation de toutes les lignées sanguines à l’exception des
lymphocytes T. Cependant le foie ne produit pas de CSH. Ces dernières, qui le
colonisent, sont considérées comme originaires de la région périaortique. Un autre
organe clé, dont le rôle était méconnu jusqu’à présent, est le placenta, dans lequel
l’hématopoïèse, également très active, est caractérisée par une richesse particu-
lière en CSH et en progéniteurs très immatures. Il était important de savoir si cette
hématopoïèse se fait aux dépens de CSH intrinsèques ou si le placenta doit,
comme le foie, être colonisé. Nos recherches les plus récentes démontrent que des
progéniteurs clonogéniques in vitro sont présents, avant vascularisation, dans
l’allantoïde qui fusionne ensuite à la plaque chorionique pour constituer le
placenta. Pour savoir si ce nouveau site a un rôle important dans la mise en place
du système hématopoïétique définitif, il reste à établir si, avant toute colonisation,
des cellules de l’allantoïde sont capables de restaurer à long terme des souris
adultes irradiées, c’est-à-dire à montrer si de vraies CSH sont produites dans cette
annexe.
Mots clés : placenta, allantoïde, progéniteur clonogénique, cellule souche
hématopoïétique
Abstract.During ontogeny, blood cells are sequentially produced by several
organs. In mammals, fetal liver has a major role, as it is the site where a population
of extrinsic hematopoietic stem cells (HSC) becomes amplified and differentiates
into all blood cell lineages, T lymphocytes excepted. Another key organ, whose
role has failed to be appreciated, is the placenta, which is much richer in HSC and
early progenitors than the liver. Like the para-aortic region, the placenta produces
intrinsic progenitors since, at stages preceding vascularisation, these can be
obtained from the allantois prior to its fusion to the chorionic plate. To know whether
this site is truly more important than the AGM (Aorta/Gonads/Mesonephros) in
producing HSCs, it is still required to analyze the long term restauration potential of
allantoic cells.
Key words: placenta, allantois, clonogenic progenitor, hematopoietic stem cell
La problématique de
l’hématopoïèse embryon-
naire a été abordée à par-
tir des années 1965-1970,
Lorsque l’hématologie est
devenue fonctionnelle et non plus sim-
plement cytologique. La compréhension
de l’hématopoïèse au cours du dévelop-
pement doit beaucoup à des modèles
non mammaliens (oiseau, amphibiens),
chez lesquels les abords expérimentaux
sont favorables. Le premier organe
hématopoïétique de l’embryon de la
plupart des vertébrés est une annexe, le
sac vitellin. Celui-ci fonctionne plus ou
moins longtemps suivant les classes et
Tirés à part :
F. Dieterlen-Lièvre
Hématologie 2006 ; 12 (4) : 247-51
Hématologie, vol. 12, n° 4, juillet-août 2006
247
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

les espèces et est ensuite, selon les cas, relayé ou accompa-
gné par des organes intraembryonnaires, foie, rate, moelle
osseuse, thymus et, chez les oiseaux, bourse de Fabricius
(figure 1). Mais ces organes, à la différence du sac vitellin, ne
produisent pas de CSH et sont colonisés, à partir d’un stade
précis du développement, par des CSH extrinsèques. Il a
alors paru logique de penser que la production des CSH était
assurée au début du développement et une fois pour toutes
par le sac vitellin [1]. Or la greffe d’un embryon de Caille sur
un sac vitellin de Poulet a par la suite révélé l’existence de
CSH intraembryonnaires [2]. Un site de production de ces
CSH a été circonscrit à la région péri-aortique de l’embryon,
dite P-Sp/AGM (para-aortique splanchnopleure/aorte-
gonades-mesonephros) chez les mammifères. Ce site est,
selon le consensus actuel, responsable de l’émission du lot
complet de CSH à l’origine du système hématopoïétique
définitif. Un schéma théorique s’était donc dégagé de ces
données, selon lequel un compartiment extra-embryonnaire
était dévolu à l’hématopoïèse précoce et un compartiment
intra-embryonnaire à l’hématopoïèse définitive. Ce schéma a
été remis en cause par la découverte que chez l’embryon
d’oiseau une autre annexe, l’allantoïde, produit des CSH
capables de coloniser la moelle osseuse [3]. La dichotomie
des compartiments intra- et extra-embryonnaires n’était donc
pas aussi simple qu’on avait pu le penser.
Le placenta des mammifères, qui est issu de la fusion entre
l’allantoïde et la plaque chorionique (figure 2), pourrait-il
avoir une fonction hématopoïétique ? Dans un premier temps
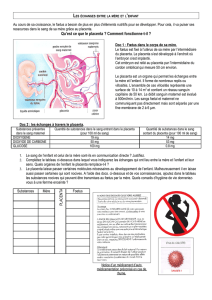
nous avons recherché dans le placenta de souris la présence
de progéniteurs clonogéniques in vitro [4]. À titre de mar-
queur, les fœtus étaient porteurs d’un allèle de la green
fluorescent protein (GFP) exprimé de manière ubiquitaire à la
suite du croisement : femelle wt/wt x mâle wt/GFP+. Seuls
les placentas des fœtus fluorescents en lumière UV, qui ont
reçu l’allèle GFP de leur père, étaient utilisés ; les tissus
d’origine fœtale y sont verts, ceux qui proviennent de la mère
ne le sont pas (figure 3A-C).
Ces placentas prélevés entre 10 et 17 jours (E10-E17) de
gestation ont été dissociés et les cellules ensemencées en
milieu semi-solide en présence d’un cocktail de cytokines. Les
colonies ont été comptabilisées après 14 jours de culture. Les
premiers progéniteurs clonogéniques sont présents au stade
de 18 à 20 somites (E8-8,5). À tous les stades de gestation
jusqu’à E17, les progéniteurs sont abondants, ainsi qu’en
atteste le développement de colonies érythroïdes, myéloïdes
et mixtes (figure 3D). Lorsqu’elles sont repiquées, les cellules
Figure 1. Synopsis du développement hématopoïétique chez la Souris. La région de la splanchnopleure paraaortique /aorte-gonades-
mesonephros (SP-PA/AGM) est bien identifiée comme site de production de progéniteurs et de cellules souches. Il faut lui ajouter le
complexe allantoïde/placenta dont l’importance quantitative et chronologique apparaît beaucoup plus grande. Le foie, la moelle osseuse et
la rate sont, eux, colonisés par des cellules souches extrinsèques. Le thymus n’est pas schématisé sur cette figure.
Hématologie, vol. 12, n° 4, juillet-août 2006
248
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

des colonies mixtes les plus grosses redonnent des colonies
pendant au moins 60 jours de culture, répondant à la défini-
tion des HPP-CFC (high proliferation potential-CFC).
Pour comparaison, les cellules du sac vitellin et du foie
avaient été clonées en parallèle. Le sac vitellin donne très peu
de colonies. La comparaison avec le foie est instructive, car
les proportions des différents progéniteurs ne sont pas du tout
les mêmes entre les deux organes : les progéniteurs immatu-
res sont très représentés dans le placenta, alors que le foie est
beaucoup plus riche en progéniteurs avancés (figure 4).Ces
données suggèrent que le placenta est un organe d’émer-
gence des CSH, alors que le foie est, comme on le sait, un
vigoureux site d’amplification, de diversification et de diffé-
renciation des cellules hématopoïétiques.
Mais le critère d’identification des CSH pluripotentes est celui
de la restauration à long terme de souris irradiées. Différents
marqueurs des cellules fœtales ont été mis en œuvre dans
deux études consacrées à cette question [5-7]. Le calendrier
de production des CSH par le placenta apparaît plus restreint
que celui des progéniteurs. Les premières CSH sont trouvées
un peu plus tard que les progéniteurs (E10,5-11), ce qui
s’explique par le très petit nombre de cellules obtenues de
jeunes embryons, eu égard au nombre de cellules nécessai-
res pour la restauration d’animaux adultes irradiés. Le nom-
bre des CSH placentaires atteint un pic à E13 et ces cellules
ont disparu à E15 (figure 5).
La comparaison avec l’évolution de l’AGM est spectacu-
laire : les CSHs sont présentes au même moment mais elles
sont environ 15 fois plus nombreuses dans le placenta. Ces
données indiquent que le placenta tient une place centrale
dans le développement du système sanguin du fœtus.
Mais les CSH du placenta se déterminent-elles in situ ou
viennent-elles coloniser cet organe ? Elles pourraient en effet
provenir de l’AGM, région dans laquelle leur émergence in
situ est bien établie [8-10]. Il est donc indispensable de tester
l’ébauche avant toute colonisation, c’est-à-dire avant vascula-
risation. Chez l’embryon de souris, le stade auquel la circula-
tion est considérée comme fonctionnelle est celui de 7 paires
de somites, atteint vers 7,5 jours de gestation. À ce stade le
placenta n’est pas encore issu de la fusion de l’allantoïde à la
plaque chorionique (figure 2), l’allantoïde a donc été analy-
sée. Or nous savions que les premiers précurseurs clonogéni-
ques n’apparaissent dans le placenta que vers 18-20 somites
(voir plus haut), largement après vascularisation et possibilité
de colonisation par des CSH extrinsèques. Nous avons donc
mis en œuvre une stratégie qui avait permis de contourner
cette difficulté dans le cas de la P-Sp, c’est-à-dire une période
de culture en trois dimensions (3D), pendant laquelle les
interrelations cellulaires sont maintenues, permettant la déter-
mination des progéniteurs [8]. Effectivement l’allantoïde
avant fusion à la plaque chorionique s’est révélée capable,
après culture en 3D, de donner des colonies [9].
En conclusion le placenta est un organe hématopoïétique
majeur du point de vue quantitatif, il entre en scène au moins
24 heures avant le foie fœtal. Par ailleurs comme l’AGM, il
produit des CSH, mais en beaucoup plus grande abon-
dance. Il faut donc le considérer comme un organe central de
la mise en place de l’hématopoïèse au cours du développe-
ment. Melchers [11] avait détecté la présence de progéni-
teurs lymphoïdes B dans le placenta, mais pensait que ces
cellules étaient dérivées de cellules circulantes issues du sac
vitellin. Cette recherche est restée sans suite jusqu’à ce que
nous la reprenions à la suite de nos expériences sur le modèle
aviaire.
Il est possible, d’après les données quantitatives, qualitatives
et chronologiques exposées ici, que les CSH qui ensemen-
cent le foie fœtal et la moelle osseuse soient en majorité
originaires du placenta. En ce qui concerne le sang du
cordon, il est impossible de conclure en l’état actuel des
CP
AI
Am
Em
CEP
Figure 2. L’embryon de Souris de 8 jours avant la formation du
placenta, dessiné en coupe par Mathias Duval (1892). Le bour-
geon d’allantoïde (Al) émis par la région postérieure de l’embryon
va, en croissant, rencontrer la plaque chorionique (CP) et s’y
fusionner pour donner la partie fœtale du placenta. Am : amnios.
CEP : cone ectoplacentaire. Em : embryon. Modifié d’après R.
Pijnenborg et L. Vercruysse, Placenta, 2006, 27 : 109-118.
Hématologie, vol. 12, n° 4, juillet-août 2006
249
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Placenta Foie
GEMM GEMM
GEMMGEMM
GM
GM
GM
GM
28%
71 % 47,4 %
BFU-E BFU-E
BFU-E BFU-E
E15
E17
52,5%
72%
27,2%
40,9% 58,1%
Figure 4. Les proportions des progéniteurs mis en évidence à partir du placenta et du foie sont différentes : environ 70 % de progéniteurs
sont immatures contre 44 % dans le foie à E15 et E17. D’après les données de [4].
Figure 3. Le placenta des fœtus GFP+/wt issus de mères wt/wt donne des colonies GFP +. Placenta de 15 jours en lumière UV (A) en
lumière photonique (B) et en double exposition (C). Seule la composante fœtale du placenta est fluorescente. Les colonies myéloïdes (D)
obtenues à partir de ces placentas sont fluorescentes, donc d’origine fœtale.
Hématologie, vol. 12, n° 4, juillet-août 2006
250
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

données ; en effet le foie est à la fin de la gestation l’organe
hématopoïétique majeur et nous avons vu qu’il est le siège
d’une amplification énorme des CSH extrinsèques. Le sang
circulant est donc, à ces stades, certainement tributaire
surtout de l’hématopoïèse hépatique.
Ces recherches fondamentales ouvrent-elles des perspectives
thérapeutiques ? Une étude immunocytologique du placenta
humain [12] a montré qu’il est le siège d’une érythropoïèse
primitive. Il sera intéressant d’y rechercher la présence éven-
tuelle de CSH. Quoi qu’il en soit, étant donné l’efficacité
attestée des cellules du sang du cordon et la disponibilité de
ce matériel dont l’obtention ne pose pas de problème éthi-
que, il est improbable que les cellules du placenta représen-
tent une source alternative. Cependant, cerner avec précision
l’émergence de ces cellules et l’évolution de leur potentiel au
cours de la vie fœtale est important pour comprendre la mise
en place de l’hématopoïèse et la genèse des cellules du sang
du cordon qui, elles, constituent un outil thérapeutique pré-
cieux. ■
Remerciements.Sophie Gournet nous a apporté une aide pré-
cieuse pour la préparation des figures.
RÉFÉRENCES
1.Moore MAS, Owen JJT. Stem cell migration in developing
myeloid and lymphoid systems. Lancet 1967 ; 2 : 658-9.
2.Dieterlen-Lièvre F. On the origin of haemopoietic stem cells in
the avian embryo : an experimental approach. J Embryol Exp
Morphol 1975 ; 33 : 607-19.
3.Caprioli A, Jaffredo T, Gautier R, Dubourg C, Dieterlen-
Lièvre F. Blood-borne seeding by hematopoietic and endothelial
precursors from the allantois. Proc Natl Acad Sci USA 1998 ;
95 : 1641-6.
4.Alvarez-Silva M, Belo-Diabangouaya P, Salaun J, Dieterlen-
Lievre F. Mouse placenta is a major hematopoietic organ.
Development 2003 ; 130 : 5437-44.
5.Gekas C, Dieterlen-Lievre F, Orkin SH, Mikkola HK. The pla-
centa is a niche for hematopoietic stem cells. Dev Cell 2005 ;
8 : 365-75.
6.Mikkola HK, Gekas C, Orkin SH, Dieterlen-Lièvre F. Placenta
as a site for hematopoietic stem cell development. Exp Hematol
2005 ; 33 : 1048-54.
7.Ottersbach K, Dzierzak E. The murine placenta contains
hematopoietic stem cells within the vascular labyrinth region.
Dev Cell 2005 ; 8 : 377-87.
8.Cumano A, Dieterlen-Lievre F, Godin I. Lymphoid potential,
probed before circulation in mouse, is restricted to caudal
intraembryonic splanchnopleura. Cell 1996 ; 86 : 907-16.
9.Corbel C, Salaün J, Belo-Diabangouaya P, Dieterlen-Lièvre F.
Hematopoietic potential of the pre-fusion allantois. Dev Biol
2006 ; sous presse.
10.Medvinsky A, Dzierzak E. Definitive hematopoiesis is auto-
nomously initiated by the AGM region. Cell 1996 ; 86 :
897-906.
11.Melchers F. Murine embryonic B lymphocyte development
in the placenta. Nature 1979 ; 277 : 219-21.
12.Challier JC, Galtier M, Cortez A, Bintein T, Rabreau M,
Uzan S. Immunocytological evidence for hematopoiesis in the
early human placenta. Placenta 2005 ; 26 : 282-8.
RU/ee
1000
500
100
50
40
30
20
10
0E9,5 10,5 11,5 12,5 13,5 14,5 15,5 16,5 17,5 18,5
Placenta
Sac vitellin
AGM
Foie fœtal
Sang
Moelle osseuse
Figure 5. Évolution quantitative du contenu en CSH des différents organes hématopoïétiques au cours de la gestation (les CSH sont
évaluées en « unités de reconstitution », RU, par embryon-équivalent, ee). Le placenta produit environ 15 fois plus de CSH
reconstituantes à long terme que l’AGM. D’après [5].
Hématologie, vol. 12, n° 4, juillet-août 2006
251
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.
1
/
5
100%