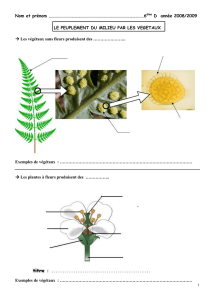
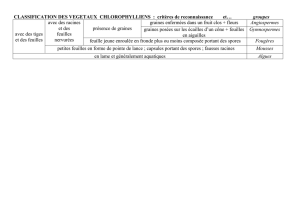
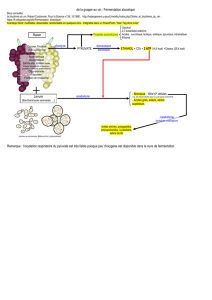
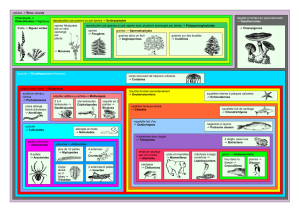
Résumé La capacité des spores de Penicillium roqueforti à utiliser
publicité

Résumé La capacité des spores de Penicillium roquefortià utiliser sélectivement les acides Gras de courtes et moyennes chaînes (C6, C8 et CIO) a été démontrée. En raison de leur toxicite, l'expérience a montré que ces acides gras sont difficilement assimiles au delà 54 ppm par ces spores. Cependant lorsque le substrat est foumi sous forme de sel, les spores sont capables d'utiliser des concentrationsélevées. L'addition dans le milieu des substances activatrices (alanine, ethanol, glucose et hydrolysat de caséine ) a montré que seul l'hydrolysat de caséine stimule l'utilisation du substrat par les spores. Les acides aminés de cet hydrolysat de caséine sont utilisés à des vitesses différentes. Seuls les acides aspartique et glutamique sont immédiatement consommés fournissant de l'énergie aux spores alors que d'autres acides aminés attendent un temps de latence ou sont peu consommés. La fermentation aérobique du substrat dans un milieu organique a permis d'augmenter la quantité de méthylcétones en raison de l'augmentation de la quantité d'oxygène solubilisée. Cette fermentation doit être de courte durée ( 16 à 18h) pour éviter la germination des spores, état physiologique non efficace pour l'utilisation des acides gras. L'expérience dans un milieu organique a été étendue au niveau de l'octane dans une culture fed-batch avec un mélange d'air et de CO, à 5, 15 et 30%. Des grandes concentrations d'acide gras (5 g1100 ml d'octane) ont pu être utilisées par les spores. A 15% de CO,, le système montre une haute stabilité avec un rendement de 64% à 8 h et 1,39 mmolelh de produit formé. Halidi Ben Saida Ali AVANT PROPOS Ce projet a été réalisé sous la supervision du Dr J. Arul, directeur, de A. Boudreau, COdirecteur et de P. Angers, collaborateur. Je veux leur exprimer mes remerciements les plus sincères pour leur support et leur patience. Je tiens à adresser un remerciement particulier à Joseph Arul pour son soutien sur tous les plans. En particulier pour avoir facilité le financement de ces travaux. Un grand merci à Paul Angers pour sa disponibilité sans limite ainsi qu'à S. Davids pour avoir accepté de me prêter certains matériels de laboratoire. Avant de terminer, je tiens à remercier l'équipe technique de Monsieur Arul pour sa contribution. TABLE DES MATlERES Inuoduction générale .............................................................................................................. 1 Avant propos............................................................................................................................... Table de Matières........................................................................................................................ Listes des tableaux et des figures................................................................................................. ii iii Resumt? ..................................................................................................................1 . V Chapitre 1 Les conditions de production des methylcétones............................. 4 Résumé,...................................................................................................................................... 5 1-Introduction 6 1.l.Métaboiiime de la fermentation méthylcétonique.................................................... 8 1.2. Les micro-organismes impliqués.................................................................................. 8 1.3. Les principaux panmètres influençant la fermentation 10 2.Matériel et Méthodes........................................................................................................ 15 2.1.Choix du matenel biologique........................................................................................ 15 2.2.Choiu des conditions expérimentales...................................................................... 16 2.2.1.Etudes sur les conditions de production des méthylcétones (chapitrel) ................ 16 2.2.2. Etude sur l'importance de la fermentûtion dans un milieu à deux phascs ............. 19 2.2.3. Etude de l'effet du CO2 sur la fermentation de 1' acide octanoique ...................... 77 en culture fed-batch dans un milieu octane-eau (chapiue3).......................................... 77 3.Résultats et Discussion ....................................................................................................... 77 3.1.Influence de La concentration en spores ........................................................................ 23 3.2.Nature et composition du milieu de fermentation........................................................ 23 3.2.1.Influence de la nature du substrat ........................................................................... 23 3.2.2. influence de la concentrationen substrat ............................................................... 24 32.3. Effet de l'utilisarion de l'acide occuioique et du sel d'acide pour la production en heptanone......................................................................................................................... 25 3.2.4. Effet de l'utilisation des activateurs et inhibiteun ................................................ 26 3.2.5.Utilisation des acides aminés ..................................................................................30 4.Conclusions .......................................................................................................................... 42 5 Bibliographie ................................................................................................................... 44 ---- . Chapitre 2.Importance de la fermentation des acides gras dans un milieu à deux phases...................................................................................................................... 48 Resumé .................................................................................................................................... 49 1.Introduction ....................................................................................................................50 1.1.Les méthodes de fermentation...................................................................................... 53 1.1.1Fermentation submergée .......................................................................................... 53 1.1.2.Production par spores encapsulées .........................................................................55 1.1.3. Production par spores immobilisées.................................................................. 56 2.Résultats et Discussion .................................................................................................. 57 2.1.Efficacité de la transformation en absence et en présence d'hexane.............................. 57 2.2.Effet de l'hexane sur le rendement en heptanone à différentes températures ................ 58 .2. 3.Effet de l'hexane su: la solubiiisa~onde l'oxygène et sur la vitessse de réaction. 59 2.4. Effet de la durée de fermentation sur la consommation en oxygène et siir le 6! rendement en heptanone ................................................................................................. 2.4.1. Effet de la durée sur la consommation en oxygSne par les spores inertes.............. 61 2.4.2. Effet de la durée sur le rendement en heptanone................................................... 62 2.4.3. Evolution du pH pendant la fermentation .............................................................. 63 2.5.Effet de l'hexane sur le rendement en biomasse et sur la dimunition de la toxicité .......... des acides gras 65 3.Conclusions .......................................................................................................................... 75 4 Bibliographie .................................................................................................................. 76 .................................................................................................................... . Chapitre 3.Effet du dioxyde de carbone sur la fermentation de l'acide .......... octanoique par Penicilliirm roqueforti en culture fed-batch dans un milieu octane-eau .................................................................................. 79 Resumé................................................................................................................................... 80 1.Introduction ................................................................................................................... 80 2.Résultats et Discussion ........................................................................................................ 82 2.1. Influence du CO? sur la production en methylcétones................................................. 82 2.2. Comportement des spores en mode discontinu et en mode Fed-bmch ......................... 84 2.3. Vitesse de production de l'heptanone ........................................................................ 85 3.Conclusions .......................................................................................................................... 90 4.Bibliographie .................................................................................................................... 91 Annexe.Valeurs numériques pour les tableaux et les figures ...................... 92 LISTE DES TABLEAUX ET DES FIGURES Liste des tableaux. CHAPITRE : TABLEAU 1. EFFEï DE LA CONCENTRATION EN SPORES SUR LE RENDEMENT EN HEPTANONELM TABLEAU 2. EFFET (8)DES ACIlVAïEURS SUR LA ïRANSFORMATION DE L'ACIDE GRAS. 35 TABLEAU 3 k ANALYSE DE VARIANCE: EFFET DES DTFFÉRENTS ACIlVAïEURS SUR LA PRODUCnON DE L'HEPTANONE 36 CHAPITRE II TABLEAU 4.EFFET DE L'HEXANE SUR LA BIOSYNTHÈSE DE L'HEPTANONE À DIFF~%NTE-S TEhlPERATLJRES 66 TABLEAU 5. EFFET DE L'HEXANE SUR LE RENDEMENT EN BIOMASSE EN PRESENCE ET EN 67 ABSENCE D'HEXANE CHAPITRE III TABLEAU 6. EFFET DU CO?. SUR LA PRODUCTION DE L'HEPTANONE. 86 TABLEAU 7. EFFET DU TYPE DE FELVENïATION ET DU CO2 SUR LA PRODUCTNfIf EN HEPTANONE 87 Liste des figures CHAPITRE 1 14 FIGURE 1. SCHEMA DE BIOSYNTHESE DE L'HEPTANONE 20 FIGURE 2. SCHÉMA DE L ' I N S T A L M O N DU FERMENIZUR FIGURE 3. EFFET DE LA LONGUEUR DES cHA~NE D'ACIDES GRAS SUR LA CONVERSION EN 37 MÉTHYLCÉTONES CORRESPONDANTES FIGURE 4. EFFET DE LA CONCENTRATION EN ACIDE OCTANOIQUE SUR LE RENDEMENT EN HEPTANONE 38 FIGURE 5. EFFET DE LA CONCENTRATION EN ACIDE OCTANOIQUE FERMENTATION SUR LE RENDEMENT EN HEPTANONE DU TEMPS 39 FIGURE 6. EFFET DE LA CONCENTRATION EN SEL D'ACIDE OCTANO'iQUE SUR LE RENDEMENT EN HEPTANONE 39 FIGURE 7. ACflVATION DE L'OXYYATION DE L'OCTANOATE DE SODIUM PAR DIFFERENTES ACTiVATEURS A DIFFERENTES CONCENTRATION D'ACIDE 40 FIGURE 8. UTILISATION DES ACIDES A M I P I ! PROVEh<ANT DE L'HYDROLYSAT DE DURANT LA FERMENTATION DE L'OCTANOATE DE SODIUM PAR P.ROQUEFORTI. CASEINE 41 CHAPITRE II FIGURE 9A. EVOLUTION DE L'ACIDE XON UTILISÉ DURANT LA FERMENTATION 68 FIGURE 9B.EVOLUTION DE L'ACIDE UTILISÉ DURAhT LA FERMENTATION DANS UN MILIEU AQUEUX ET ORGANIQUE. 68 FIGURE 9C. EVOLUTION DE L'HEPTANONE FORME DURANTLA FERMENTATION DANS UN MILIEU AQUEUX ET ORGANQUE. 69 FIGURE 10. EVOLUTION DE LA CONSOMMATION D'OXYGÈNE EN PRESENCE ET EN ABSENCE D'HEXAh'E 70 FIGURE 11. EVOLUTION DE LA CONSOMMATION D'OXYGÈNE DURANT LA FERIMENTATION EN ABSENCE D'HEXANE 71 FIGURE 12. EVOLUTION DE LA CONSOMMATION D'OXYGÈNE DURANT LA FERMENTAION EN PRESNECE D'HEXANE 71 FIGURE 13. EVOLUTION DE LA CONSOMMATION D ' O X Y G È ~PAR LES SPORES EN ABSENCE DE SUBSTRAT 72 FIGURE 14. EVOLUTION DE LA CONSOMMATION D'OXYGÈNE ET DU PH AU COURS DE LA 73 FERMENTATION DE L'OCTANOATE DE SODIUM RGURE 15. EVOLUTION DE LA CONSOMMATION DE L'OCATANOATE DE SODIUM. DU PRODUIT ET 73 DE LA BIOMASSE. AU COURS DE LA FERMENTATION FIGURE 16. EVOLUTION DU PH PENDANT LA FERMENTATION DE L'OCATANOATE DE SODIUM.74 CHAPITRE III FIGURE 17. EFFET DE LA CONCENTRATION DU DIOXYDE DE CARBONE SUR LA PRODUCTION DE L'HEPTANONE EN MODE FED-BATCH 88 FIGURE 18. EFFET DE LA CONCENTARTION DU DIOXYDE DE CARBONE AQUEUX SUR LA V m S S E 89 DE PRODUCTION DE L'HEPTPNONE AU COURS DE LA FERMEh'TATION lntroductiori générale Les acides gras saturés provenant de différentes sources en particulier du gras animal fon: l'objet d'une attention particulière pour la population. Les consommateurssont de plus en plus informés des cor,séquences souvent négatives que le gras saturé cause à leur santé, par exemple, I'augnentation du taux de cholestérol. Une des solutions pour valoriser ces matières premières conceme leur transformation en méthylcétones, principaux actifs des saveurs du fromage. En effet, la matière grasse joue un rôle important sur les qualités de saveur et d'arôme des fromages. C'est ainsi que la lipolyse constitue l'un des phénomènes majeurs de l'affinage et les acides qui en résultent contribuent directement à la formation de la saveur typique de certains fromages . Une fraction de ces acides est ensuite métabolisée par les micro-organismes. Certains de ces composés formés peuvent participer à la détermination des caractères organoleptiques des pâtes. Parmi les composés carbonylés, ce sont surtout les méthylcétones qui ont été mis en évidence: l'acétone, la 2-pentanone, la Pheptanone et la 2-nonanone dans le Roquefort et la 2-butanone dans le Bleu danois (Adda et Dumont,1974). Ces auteurs ont mis en évidence la formation d'alcools secondaires (Bpentanol, 2heptanol et Pnonanol ), mais il semble que ceux-ci n'apparaissent que lorsque le fromage contient une forte quantité de méthylcétones. Cependant dans une étude, Kinderlerer(l987) a montré que la formation d'alcools secondaires est liée à la limitation d'oxygène présent dans le milieu. Dans le développement de la saveur et de l'arôme des fromages de type bleu, le rôle des composés carbonylés et, notamment des méthylcétones, est bien connu. Leur présence parmi lesquelles dominent la Pheptanone apparaît indispensable au développement des caractères organoleptiquestypiques du fromage. La fabrication de certaines soupes, salades, sauces et desserts nécessite l'utilisation de ces composés présentant le goût de fromage. Ainsi la qualité de certains aliments devient dépendante de la présence de ces arômes. Cette flaveur est principalement obtenue par addition de méthylcétones telles que la 2-heptanone ou la 2undécanone. Ces composés sont obtenus par synthèse chimique en partant d'un alcène terminal. Celui-ci subit une réaction d'hydratation en présence d'acide puis une oxydation de l'alcool secondaire obtenu avec des métaux. En raison du rejet croissant du consommateur vis à vis des composés de synthèse chimiques ajoutés aux aliments, les industries alimentaires s'intéressent de plus en plus aux saveurs d'origine biologique appelées naturelles ou biologiques. C'est pour cela que les compagnies cherchent de plus en plus à maîtriser les procédés biotechnologiques . Ces demiers trouvent dans les arômes des produits à valeur ajoutée suffisante pour permettr: leur développement. Certains de ces arômes sont obtenus par fermentation d'acide gras. Ce processus met en jeu des spores dont l'activité peut être affectée par des conditions environnementales (nature et concentration de substrat, pH, température,etc). Le procédé est ainsi limité par la concentration du substrat en raison de sa toxicité à un certain niveau, par sa faible solubilité dans le milieu aqueux et par la durée de fermentation. Les coûts qui en résultent constituent l'élément principal qui déterminera l'avenir commercial de ce procédé. En effet, les techniques actuelles de fermentation utilisent des durées longues (quelques jours, voire des semaines) incompatibles avec des exigences industrielles et économiques. La raison est liée à la nature du substrat utilisé. L'utilisation des triglycérides demande une lipolyse préalable pour libérer les acides gras précurseurs des méthylcétones. Or cette réaction est trop lente. De plus, ces triglycérides sont des composés beaucoup moins hydrosolubles que les acides gras eux mêmes. D'où le problème lié à la disponibilité du substrat aux spores. Enfin, l'utilisation directe des acides gras comme source de carbone pour la production des méthylcétones permet certes d'éviter I'étape de la lipolyse et de raccourcir la durée de fermentation mais ne résout pas le problème de la solubilité (0,66g1100g d'eau pour l'acide octanoïque) ni celui lié à la toxicité. Cette inhibition est fonction du pH du milieu , de la longueur de la chaîne et de la souche utilisée. Cette inhibition a pour résultat la non consommation de l'oxygène, la non oxydation du NADH au niveau de la chaîne respiratoire et la croissance du micro-organisme. Une amélioration d'ensemble des performances de l'étape de fermentation puis de la séparation apparaît susceptible de contribuer à la commercialisation. En fait, les problèmes posés sont celui de l'identification des paramètres qui penettent de contrôler la performance du micro-organisme, et celui de la sélectivité du substrat pour améliorer la productivité. La performance passe par le choix et la sélection des souches de moisissures capables d'effectuer la fermentation, ainsi que par la maîtrise de l'état physiologique. L'évaluation de la performance du système de fermentation doit prendre en compte les critères de concentration en acides, de productivité, de rendement et de sélectivité. II est à noter que le rendement en méthylcétones est relié à la sélectivité mais aussi à l'état physiologique de la moisissure. Ces performances dépendent, d'une part, du choix de la moisissure et, d'autre part, du mode de conduite de la fermentation. La sélection de souches productrices ne fait pas l'objet de ce travail bien que son choix est déteninant sur les performances. Le travail de recherche sur la fermentation des acides gras à courtes et moyennes chaînes en présence des spores de Penicilliurnroquefortise divise en trois parties : 1.Les conditions de production des methyicétones 2.lmportance de la fermentation des acides gras dans un milieu à deux phases. 3.Effet du dioxyde de carbone sur la fermentation de l'acide octanoïque en culture Fed-batch dans un milieu octane-eau. CHAPITRE 1 Les conditions de production des methylcétones. Résumé L'évaluation des conditions de production des méthylcétones a été faite en présence de spores de Penicillium roqueforti et d'acides gras (caproique, caprylique et caprique). L'analyse de la quantité de méthylcétones produites a montré que l'acide caprylique était mieux utilisée que les autres substrats. Le reste du travail a donc été poursuivi avec l'acide caprylique. D'autres facteurs tels que la concentration en spores ont été examinés. A une concentration inférieure à 106 spores ImL, il y a une très faible production en méthylcétones. La concentration maximale en acide caprylique que les spores sont capables de métaboliser est de 54 ppm. Au delà de cette concentration, une répression catabolique se manifeste en raison de la toxicité des acides. Mais lorsque le substrat est foumi sous forme de sel, ce dernier peut être métabolisé à des concentrations supérieures. La toxicité semble annulée. L'étude a aussi examiné la possibilité de stimuler le métabolisme des spores en leur foumissant des substances dites activatrices (éthanol. glucose, alanine, hydrolysat de caséine). Celles-ci fournissent de l'énergie aux spores et leur permettent d'effectuer la dégradation de l'acide caprylique en heptanone. Les résultats ont montré que lorsque les spores sont jeunes (7 jours), l'effet stimulateur de ces activateurs ne s'est pas manifesté. Parmi les substances testées, seul l'hydrolysat de caséine permettait aux spores de mieux utiliser le substrat et de fournir un rendement plus élevé par rapport au témoin. L'analyse cinétique de l'assimilation des acides aminés provenant de l'hydrolysat de caséine a montré que les acides aspartique et glutamique sont irnmédiatement consommés par les spores. Les acides aminés constituant ce mélange ont donc été assimilés à différentes vitesses avec une prépondérance pour l'acide glutamique et l'acide aspartique. D'autres comme la tyrosine, la phenylananine attendent un temps de latence avant d'être consommés alors que l'alanine et l'histidine sont peu consommés. 1- Introduction La production microbienne des arômes a été beauccup étudiée durant ces demières années et certains procédés ont été exploités commercialement. Cependant dans le cas des flaveurs comme les méthylcétones, le manque d'information sur le métaboliàme du micro-organisme et le phénomène lié à la toxicité du substrat constituent les deux principeles barrières à la production industrielle. Alors qu'une parfaite connaissance de la biochimie et de la physiologie du micro-organisme sembie être la première chose à connaitre, seule une enzyme de cet organisme, la p-décarboxylase, a été étudiée dans la dégradation du précurseur direct ( Hwang et KinseIla,1975). Ainsi I'exploitation des voies microbiennes pour la production des flaveurs naturelles s'est avérée faisable techniquement et économiquement dans certains cas. La production des y-lactones est un exemple. Le prix a diminué de 20,000s US!Kg en 1980 à 1200SUSIKg en 1995 à cause de la production microbienne(Fer0n et a1.,1996). La production des méthylcétones par dégradation des acides gras s'avère importante en raison de la forte multiplicité des produits alimentaires tels que les salades, les soupes, les biscuits et les gâteaux dans lesquels l'addition des arômes au goût de fromage semble stimulante ( Hwang et Kinsella,1976). Dans le fromage bleu, les caractéristiques aromatiques sont principalement attribués aux composés carbonylés parmi lesquels les méthylcétones (Dartey et Kinsella,l971). Ces dernières sont formées sous l'action de P.roqueforti et de certaines autres moisissures à partir des acides gras (C6-Cl$). L'oxydation des acides gras libres par les spores a été étudiée depuis longtemps par Lawrence(l966) et par Dartey et Kinsella (1973). Les acides gras se sont révélés des composés toxiques à P. roquefcrti, le degré de toxicité étant dépendant de la longueur de chaîne, de la concentration et du pH (Lawrence et Hawke,1968). Et il a été suggéré que l'oxydation des acides gras est un mécanisme de détoxification employé par la moisissure. Des concentrations de 32,5 mmoVL pour l'acide hexanoique, de 20,O mmol /L pour l'acide octanoique, de 10,O mmoVL pour I'acide décanoïque, et de 15,3 mmoVL pour I'acide dodécanoïque sont inhibitrices à P. crustosum (Hatton et Kinderlerer,l991) tandis qu'une concentration de 10 mM pour l'acide octanoïque est inhibitrice à P. roqueforti (Creuly et a1.,1992). Les acides gras sont des agents antimicrobiens qui empëchent leur croissance en inhibant le transport de certaines molécules comme les acides aminés dans les cellules. Cet effet inhibiteur augmente lorsque le pH est abaissé à partir de la neutralité, indiquant que le phénomène résulte des acides non dissociés (Freese et al. ,1973). La vitesse de stimulation de l'acide octanoïque par les acides aminés et les sucres chez les spores a été examinée par Lawrence et Bailey (1970). L'effet stimulateur de ces composés est interprété comme des métabolites qui agissent au niveau du cycle de I'acide citrique via I'acétylcoA. Cette conclusion est appuyée par le fait que I'ATP exogène augmente la vitesse d'oxydation de I'acide octanoïque. D'autre part, l'effet stimulateur de ces activateurs se manifeste efficacement chez les spores âgées (Larroche et al. ,1988) Dans cette étude, nous avons considéré la faisabilité d'utiliser des spores comme biocatalyseurs pour la production des méthylcétones. Nous avons choisi trois acides gras tels que I'acide caproïque, caprylique et caprique qui sont des courtes et moyennes chaînes. Le reste du travail a Été poursuivi avec I'acide caproïque , bien présent dans le gras laitier et la principale source de flaveurs provenant des acides gras. L'autre raison est liée au souci d'éliminer les effets d'interactions avec les autres acides et de contrôler un paramètre à la fois. Nous avons étudié les effets de différents facteurs tels que l'âge et la concentration des spores ainsi que l'effet de I'acide libre et sous forme de sel sur la productivité en méthylcétones. Enfin, nous avons étudié l'influence de certains composés tels que l'alanine, le glucose, l'éthanol et I'hydrolysat de caséine sur l'oxydation de I'acide octanoïque. Ce sont des activateurs qui fournissent de l'énergie ou agissent comme source de nutriments pour les spores de P. roqueforti. Ils influencent ainsi la perméabiiité du substrat ou activent les enzymes nécessaires a la synthèse des méthylcétones. Basé sur cette étude, une méthode de production des méthylcétones en utilisant un solvant organique a été investiguée. 1.1.Métabolisme de la fermentation méthylcétonique Les acides gras des courtes et moyennes chaînes sont oxydés par les spores ou le mycélium de P. roqueforti (Dartey et Kinsella ,1973 ; Kinsella et Hwang , 1976b ; Larroche et a1.,1988 ; Creuly et a1 .,1992) en methylcétones selon une une p- oxydation incomplète (voir schéma l ) . Les facteurs qui vont influer sur le métabolisme sont d'ordre environnemental et intrinsèque. Les facteurs intrinsèques incluent les enzymes des cellules, en particulier la P-décarboxylase, et la perméabilité. L'incapacité des cellules à oxyder le substrat peut être due soit à l'incapacité du substrat à pénétrer la membrane ou à celle des enzymes à accomplir i'oxydation. Ces paramètres agissent sur la vitesse de réaction au cours de laquelle une partie de l'acide gras est convertie en acétylcoA et entre dans le cycle de Krebs. Celui-ci requiert la prosence de molécules d'oxygène. La consommation de celle-ci est beaucoup active durant la croissance du micro-organisme et faible lorsque les spores sont inertes. Les facteurs externes qui influencent les réactions à I'intérieur des spores sont le pH, la température, la pression de l'oxygène, le dioxyde de carbone et les nutriments. Ces éléments sont l'objet de cette étude. 1.2. Les micro-organismes impliqués. De nombreuses moisissures sont capables de produire des méthylcétones à partir de la dégradation des acides gras libres ou des triglycérides. Certaines d'entre elles sont plus performantes que d'autres, entre espèces et à l'intérieur d'une espèce. Et il existe des différences marquées existant entre les souches au niveau des concentrations, de la productivité et de la sélectivité. Pour l'application semi-industrielle, le micro-organisme le plus intéressant, du moins le plus utilisé est Penicillium roqueforti. Cependant, d'autres moisissures produisant des méthylcétones ont été utilisées. Dans une étude menée sur 32 souches sélectionnées, Yagi(1990b) a montré l'existence de deux catégories de souches. Les unes capables d'accumuler des méthylcétones à partir des triglycérides naturels provenant d'huile de palme (Fusarium et Trichoderma) et les autres actives sur un triglycéride synthétique de tricaprine (Aspergillus, Cladosporium et Penicillium). De même, Taylor (1995), après avoir travaillé sur huit cultures de Penicillium roqueforti, a confirmé les résultats de Yagi sur la performance supérieure de Penicillium decumbens I F 0 7091. D'autres souches de moisissures telles que Monascus purpureus ( Kranz et al., 1992), Penicillium caseicolum (Lamberet et al., 1982) sont capables d'une telle action. II existe aussi un type de détérioration appelée rancidité cétonique (une production " spontanée " de méthylcétones) présente dans certaines huiles telles que l'huile de noix de coco (Coco nucifera L .), l'huile de palme, le gras laitier tous riches en acides hexanoïque, octanoïque, décanoïque, dodécanoïque . La formation de ces produits est liée à la présence de moisissures xérophyliques (Euroticum amtelodami, E.chevaleri, E. herbariorum et P. citrinum). Kinderler et Kellard(1984) ont étudié ces moisissures dans des conditions de basse activité d'eau (Aw=0,76) et de basse tension d'oxygène. Dans ces conditions, ce sont la Pheptanone et le 2heptanol qui sont les produits majoritaires parmi la Ppentanone, la Bnonanone et la 2-undécanone, excepté pour le cas de E. herbariorum qui produit 'a Phexanone, le 2-hexanol, le 2-octanol et le Boctanol. Les résultats ont montré aussi que certaines moisissures peuvent croître sur l'huile de noix de coco dans les conditions similaires sans causer une rancidité cétonique. II est ressorti de cetre étude que la formation des méthylcétones dépend de la présence de courtes chaînes d'acides gras dans le milieu ( certaines huiles comme l'arachide en sont dépourvu), d'une basse pression partielle en oxygène et d'une basse activité de l'eau. II existe également à l'intérieur d'une espèce compétente, certaines souches incapables de produire des méthylcétones. C'est le cas de Aspergillus ruber. La fermentation sur de l'huile de noix de coco pendant trois jours, a montré que seule la souche 298309 de A. ruber était capable de produire des méthylcétones (majoritairement de I'heptanone) alors que la souche 298306 en était incapable (Kinderlerer,l987). La capacité pour certaines moisissures à synthétiser les méthylcétones à partir des courtes chaînes peut être liée à la présence d'une thiokinase qui existe dans certaines moisissures et qui est spécifique pour les chaînes de 4 à 12 carbones (Gurr,1980). 1.3.Principaux paramètres influençant la fermentation. La fermentation de l'acide octanoïque par P. roqueforti est influencée par certains paramètres dont les principaux sont l'état physiologique, la composition du milieu et la nature du substrat. Etat physiologique. L'état physiologique se manifeste de deux façons : d'une part l'âge des spores au moment de la récolte (avant fermentation) et d'autre part l'état de développement physiologique instantané durant la fermentation. Les spores âgées voient leur capacité à oxyder l'acide octanoïque diminuer en raison de l'augmentation de l'épaisseur de la paroi sporale qui résulte en une diminution de la perméabilité au substrat (Kinsella et Hwang.1976b). La performance des spores est liée au stade de développement physiologique dans lequel se trouve la moisissure. Fan et al. (1976) ont observé à différentes concentrations d'acide octanoïque le niveau de méthylcétones formées à différents stades de développement des spores inertes, 24h, 32h, etc. Le résultat de cette étude a montré que ce sont les spores inertes qui étaient le plus capables de produire des méthylcétones. Cette capacité diminuait à partir de 24h. Cette diminution est attribuable à une plus complète oxydation de l'acide octanoique par la haute activité métabolique des spores germées. En outre, l'augmentation de la concentration en acide octanoïque a révélé que les spores inertes résistent mieux à son inhibition que les spores germées. Des observations ultrastructurales au microscope ont montré des changements de l'épaisseur de la paroi. Les spores germées présentent des parois plus perméables aux acides gras. Composition du milieu. La nature du milieu est un facteur important puisqu'il exerce une influence sur l'activité et la performance des biocatalyseurs. Lawrence (1967) a récolté des spores et les a suspendu dans du tampon phosphate pH 6.5. il a constaté que ce lavage a diminué la capacité des spores à oxyder des triglycérides . L'activité est fortement augmentée lorsque le milieu est modifié par addition de casaminoacides et d'acides aminés spécifiques. L'activité d'oxydation a été accompagnée par une augmentation de l'oxygène consommée. Ces effets activateurs de ces substances ont été confirmés plus tard par Larroche (1988). L'auteur a utilisé des spores lavées et stockées à -12 OC pendant 12 à 67 jours. A cette température, les spores ont manifesté une diminution de leur activité catalytique. Cette dernière est restaurée lorsque le milieu est additionné de glucose ou d'éthanol. L'effet de ces substances activatrices est dépendant de la souche et de l'âge des spores. L'importance de l'oxydation des acides gras en méthylcétones dépend de l'âge des spores (Larroche,l988) alors que l'étape hydrolytique préalable des triglycérides reste elle indépendante de cet état physiologique (Lawrence,l966). La fermentation est généralement conduite dans un milieu simple. Cependant, certains auteurs (Yagi et a1.,1990a) ont utilisé un milieu riche en solutions minérales et en vitamines en présence de Penicillium décumbens pour produire des méthylcétones à partir de l'huile de palme. Mais l'étude ne permettait pas d'apprécier l'efficacité l e ce milieu par rapport à un milieu simple. Le mycélium et les spores sont tous deux capables de synthétiser les méthylcétones mais les spores jouent un rôle prédominant à la fin de la période de maturation du fromage (Kinsella et Hwang ,1976b).Les spores présentent en plus certains avantages liés à la facilité de stockage. En effet, lors de la biotransformation, les spores résistent mieux au potentiel toxique des acides gras que le mycélium (Fan et a1.,1976 ) et possèdent une activité de bioconversion trois à dix fois plus élevée que celle du mycélium en terme de matière sèche (Maheva et a1 .,1984). La récupération des produits qui en sont issus est plus aisée contrairement à l'utilisation du mycélium en raison de sa prolifération dans le milieu de fermentation (Moskowitz ,1979 ). Les spores peuvent étre utilisées à I'é;at libre ou immobilisées (Larroche et a1.,1989 ) ou encapsulées (Pannel et Olson ,1991). La qualité des spores est fonction de l'âge (Lawrence ,1966 ), des conditions de stockage (Larroche et a1 .,1988 ) de culture, (Larroche et a1 .,1989 ; Gervais et al., 1988), ou de traitements ultérieurs tels que l'hydratation et la congélation (larroche et al., 1994). Le pH du milieu influe sur le métabolisme des acides gras, et donc sur la quantité de méthylcétones formées. Déjà, Lawrence (1968) en utilisant du mycélium a étudié différentes valeurs de pH en relation avec la consommation de l'oxygène. II a trouvé que la valeur pH à laquelle l'oxjrgène consommé est maximale, augmente avec la concentration du substrat. Ces pH optima sont de 5 0 , respectivement 1, 3 5 5 et 6,5 pour et 25 pmoles. II est possible également de changer les préférences de P. roquefortipour différents précurseurs en baissant la valeur du pH. C'est ainsi qu'à pH 6,8, la quantité de méthylcétones augmente de 2-butanone à 2octanone . Alors que le phénomène inverse est observé à pH 2,5 (Lawrence,l968). L'enzyme responsable de la synthèse des méthylcétones, la p-décarboxylase a été étudiée par Hwang et a1.,1976, en utilisant un extrait cellulaire de mycélium. En présence de 2 mM d'acide laurique, ils ont trouvé que le pH optimum pour la conversion en Pundécanone était 6,s-7. Ce dernier correspond également au pH optimum de l'enzyme observé pour la production des méthylcétones à partir de i'acide laurique par les spores en germination de P.roqueforti (Kinsella et Hwang,1976a). La productivité est donc fortement dépendante de l'âge des spores (Lawrence,l966 ) et du pH du milieu. Avec P.roqueforti, le pH optimal pour la production des méthylcétones se situe entre 5 et 7(Kinsella et Hwang,1976b). Des pH plus bas sont défavorables et la concentration de l'acide dans le milieu s'est avéré être un important paramètre de la fermentation. Nature du substrat L'importance de la nature et de la taille de I'acide gras se manifeste en particulier au niveau de la sélectivité. Celle-ci change en fonction de la souche et de l'espèce de moisissure. L'acide hexanoïque est le substrat préféré par Monascus purpureus à des concentrations de 1,O et 1 3 mM (Kranz et a1.,1992). Au contraire, en présence de P. roqueforti, l'acide octanoique est le plus utilisé alors que l'acide hexanoique l'est moins (Lawrence,l968). Mais lorsque ce même substrat est présenté en mélange avec d'autres acides gras, il y a un changement de préférence. En oütre, lorsque I'acide décanoique (1 mM) est en présence de différentes concentrations d'acide octanoique, il y a formation exclusive de 2-nonanone. II a été suggéré une inhibition de I'acide octanoique lors de la synthèse de 2-nonanone suivant la concentration de I'acide octanoïque. La forte réactivité pour l'acide octanoique a aussi été démontrée avec P.caseicolum où la 2-heptanone est également le principal produit de la fermentation lorsque les acide octanoïque et décanoïque ont été ajoutés séparément aux cultures (Lamberet,l982). Cette réactivité est fonction du poids moléculaire. La vitesse de conversion diminue avec l'augmentation du poids moléculaire (Kinderlerer,l987). Cependant l'utilisation de P.decumbens IF07091 par Yagi (1990a) avec 1% d'huile de palme et à pH 8,2 a montré que c'est l'acide laurique qui présentait le meilleur taux de conversion avec un rendement de 46,4% après 7 jours de culture. CH -(C&)a-COSCOA+ H FAD 2l mm Hexanoyl coA + CHI- (C&)a-CH=CH-COScOA I 1 - AcetylcoA CHI (C&)a -CHOH-CH-COSCOA CHI- (C&)a-CO-CE-COScOA CoAsH+ CH- (CIE)4 -CO-CB-COOH I . . a . . - f 2AcethylcoA Cycle de Krebs + -----.---.-------.---.-..--..... --------.-----------* 1 Figure 1. Biosynthèse de I'hepanone à partir de 0 2 l'acide octanoïque selca (Larroche, 1994; Kinsella, 1976; Knight, 1966) 2. Matériel et Méthodes 2.1.Choix du matériel bioloaiaue. L'étude a porté sur des souches de Pénid!!um roqueforti fournies sous forme lyohilisée par l'institut Rosell de Montréal (QC, Csnada). Les essais ont été réalisés sur les spores. 1-1)Préparation du milieu de culture. Les spores sont cultivées sur Potato-Dextrose-Agar (PDA) en présence de 203.94 g de glycéro1~1000g d'eau pour obtenir un meilleur milieu de sporulation ( Gervais et al., 1988) et de maintenir l'activité des cellules lors de leur stockage. L'activité de l'eau (Aw=0,96) est contrôlée par un appareil Novasina (NovasinaAG CH.8050 ZüricNSuisse). Le milieu est stérilisé à 121°C, 20 min et 5 mL du milieu est versé dans chaque boite de pétri. 1-2)Culture de spores. Des essais préliminaires ont montré que le meilleur mélange pour obtenir une meilleure sporulation était de 0.3 g de poudre de spores avec 70 mL d'eau stérile. lnocculation de 4 à 5 mL du mélange dans chaque boîte de pétri. Après incubation de 7 jours à température ambiante, les souches peuvent être stockées au réfrigérateur à 4°C ou utilisées immédiatement. 1-3)Numérotation des spores 20 ml de solution Tween 80 à 1% sont ajoutés dans chaque boîte pour enlever les spores. Après agitation modérée pour disperser les spores, ces derniers sont récupérés à l'aide d'une anse de platine dans les conditions stériles. Les spores retenues sur le filtre sont lavées 2 fois avec de l'eau distillée. La suspension est ajustée à 10' spores/ml à l'aide d'un hématocymètre. 2.2.Choix des conditions exr~érimentales 2.2.1 .Études sur les conditions de production des méthylcétones (chapitrel) L'étude des conditions de fermentation a été réalisée dans des vials en verre de 10 ml dans un agitateur thermostate (Lab-Line Orbit Environ-Shaker, Melrose Park, USA). Cette étude permet de sélectionner les conditions optimales d'utilisation de substrat, de durée et de milieu réactionnel pour la fermentation. Les acides gras utilisés (acides hexanoïque, octanoïque et décanoïque) ont été obtenus d'Aldrich (Milwauke, WI,USA) et les concentrations initiales ont été de 32 à 108 ppm. Le milieu réactionnel a été modifié ou non par addition de substances énergétiques telles que le glucose à 1 mg/mL, alanine à 0,5 mg/mL et éthanol à 2 pVmL (Larroche et a1.,1988) et de I'hydrolysat de caséine à 0,lglmL (king et Clegg.1980). De l'acide malonique à 0,001 g/L (inhibiteur de la succinate déshydrogenase) a été utilisé pour vérifier l'hypothèse du fonctionnement du cycle de Krebs durant la fermentation. Le milieu a été additionné avec du tampon phosphate à pH 7. Toute fois dans les conditions où l'acide octanoïque est fourni sous ia forme de sel, des études préliminaires ont mcntré dans ce cas que le tampon phosphate peut ne pas être utilisé. Les paramètres choisis ont été une température de 28 OC (Yagi et a1.,1990a), la durée variant de 0.5 à 48 h. Après un minimum de trois expériences préliminaires, la durée de la fermentation a été fixée de 1 à 16 h. Bioréacteur Le bioréacteur est un via1 en verre de 10 mL. II est fermé par un bouchon en raison de la volatilité des méthylcétones et des acides gras. Oxvdation des acides en méthvlcétones. La capacité relative des spores à utiliser les acides gras est comparé en utilisant des spores de même âge. Une quantité de 0,25 mL de chaque acide a été ajouté avec une suspension donnée de spores. Le volume réactionnel a été ajusté à 8 mL. A différents intervalles de temps, les échantillons sont enlevés de l'incubateur pour la détermination des méthylcétones. Cette méthode a permis de sélectionner les acides gras qui sont mieux utilisés par les spores. Le protocole est poursuivi pour sélectionner la meilleure concentration d'acide gras, parmi celles qui ont été utilisées ( 32 à 108 ppm). Détermination des méthvlcétones. -Extraction des méthylcétones et des acides gras libres. Le milieu de fermentation a été acidifié avec de l'acide chlorhydrique afin d'extraire les acides gras n'ayant pas réagi. Une quantité de standard interne (20 p l ) de méthylcétones (200 PL d'acide haptanoïque,2-octanone et Poctanol 1100 ml d'hexane) a été ajoutée. Après avoir vortexé l'échantillon, les acides gras libres ainsi que les méthylcétones ont été extraits avec 5 mL d'hexane en trois étapes . Puis le milieu a été séché avec du sulfate de sodium anhydre et filtré avant analyse. Quantification des méthylcétones et des acides gras libres. L'extrait placé dans des vials a été utilisé pour l'identification en présence de solutions standards externes de mélange d'acides gras (butanoïque, hexanoique, heptanoïque, octanoïque, décanoïque et undécanoïque ), d'alcools (Bpropanol, 2butanol, 2-pentanol, 2-heptanol, Poctanol, 2-nonanol et Bundecanol ) et de méthylcétones et (2-butanone, Pheptanone, Bnonanone, 2-octanone 2- undécanone). Dosage des methylcétones. Les méthylcétones provenant de la phase organique ont été dosées par chromatographie en phase gazeuse. L'appzeil est un chromatographe 5890A Hewlett Packard (Palo Alko CA, USA) muni d'un détecteur à ionisation de flamme et équipée d'une colonne FFAP (acide nitrotéréphtalique) d'une longueur de 25m, d'un diamètre inteme de 0,20 mm et d'une épaisseur de film de 0,33 ym. Les températures de l'injecteur, du détecteur et du four ont été de 240 OC. La pression du gaz vecteur, l'hydrogene, est de 55 KPa (8psi) , les débit de l'air et de l'hydrogene (pour la flamme ) étaient respectivement de 400 et de 40mVmin. Le programme de température utilisé était le suivant: température initiale ,32 OC, durée 4min; taux de chauffe : 4min. 60 "C/min; température finale 220°C; durée finale, 25min. L'acide heptanoique, la 2-octanone et le 2-octanol ont été utilisés comme standards interne pcr: évaluer respectivement l'acide octanoique utilisé et non transformé, le 2-heptanone et le Pheptanol. Les temps de rétention des échantillons ont été comparés avec ceux des standards. Analyse statistique Le logiciel statistique - statistical Analysis system 11 (SAS institute, Inc) était utilisé pour l'analyse des effets des différents activateurs sur la production des méthylcétones par les spores. Pour chaque activateur utilisé (glucose, alanine, éthanol, hydrolysat de caséine), 3 répétitions ont été effectuées. Afin d'éliminer toute source de variation autre que les effets à étudier, l'expérience est réalisée au même moment avec les mêmes spores. Pour chaque composé, l'ensemble des données était au préalable soumise à une analyse de variance afin de déterminer s'il existe des différences significatives entre les traitements. C'est ainsi que le mode PROC.GLM de SAS a été utilisé. Par la suite, des comparaisons simples entre activateurs ont été effectuées par l'analyse des contrastes . Les test de différences significatives sont évalués. Dosage des acides aminés On a mesuré l'utilisation des acides aminés libres de I'hydrolysat de caséine par la chromatographie gazeuse après dérivation par du MTBSTFA (Méthylterbutyl si/yItrifluoroacetamide). La méthode d'analyse des acides aminés consistait à transformer ces derniers en molécules volatiles pour l'analyse en phase gazeuse. Un mélange d'acides aminés AA-S-18 (obtenu de Sigma, St louis, MO, USA) à 2.5 ymoledmL dissous dans 0.1 N HCI a été utilisé pour préparer une courbe standard en présence d'un standard inteme (Norleucine). Le tout est évaporé sous vide. Le mélange évaporé a été mélangé avec 1 mL de DMF (Dimethyl Formamide) et 200 pL de MTBSTFA puis chauffé à 60 "C pendant 1 h. Après refroidissement du mélange, 200 pL de chloroforme ont été additionnés. Les échantillons prélevés à 4, 8, 12 et 16 h de la fermentation ont été utilisés pour analyser la consommation des acides aminés libres provenant de i'hydrolysat de caséine. Après que les échantillons eurent été lyophilisés, la même quantité de standard interne de norleucine a été ajoutée (0.0016g) dans chaque échantillon avec 1mL de DMF et 200 pL de MTBSTFA puis chauffé à 60 "C pendant 1 h. Le tout a été filtré et 200 pL de chloroforme ont été ajoutés avant i'analyse. L'appareil est un chromatographe 5890A Hewlett Packard (Palo Alko, CA, USA) muni d'un détecteur à ionisation de flamme et équipée d'une colonne de 25 m (le revêtement interne est constitué de 95% de méthyl et de 5% de phénylsilicone), de diamètre inteme de 0,25 mm et d'une épaisseur de film de 0,1 pm. L'analyse au GC a été faite à l'aide d'une chambre silylée par deux ou trois injections du témoin de départ. La silylation consiste à injecter automatiquement un derivé silylé dans la chambre du GC. Les conditions d'opération du GC ont été les suivantes: gaz porteur : HZ,50KPa. Split Vent : 50ml. température initiale : 100 "C .Temps initial :2 min, 10°C Imin, Température finale 300 OC, Durée finale :14 min. 2.2.2. Étude sur l'importance de la fermentation dans un milieu à deux phases (chapitre 2). L'étude de la fermentation des acides gras par P. roqueforti a été conduite en présence d'un solvant organique, I'hexane. L'importance de celui-ci a été apprécié en examinant les rendements de transformation en absence et en présence d'hexane. Durant les fermentations, le rôle de i'oxygène a été également étudié. Figure 2. Schéma de l'installation du fermenteur. L'efficacité de I'hexane a été apprécié en comparant les fermentations dans des différentes conditions de température (20 O, 24 "et 28 OC), de durée ( 1 à 16 h). De I'hydrolysat de caséine (0,1 ou 0,049 /ml) a été ajouté au milieu en présence de chloramphénicol. Le bioréacteur utilisé a été soit des vials de 10 ml ou un fermenteur de 1,25L. Outre le matériel précédemment décrit nécessaire pour des expériences préliminaires afin d'apprécier le suivi et le milieu de la fermentation, le système a nécessité en plus un appareillage permettant de mesurer la quantité d'oxygène dissous, le pH ainsi que le soutirage. Nous avons utilisé un fermenteur en Teflon de 1,25 L. II était équipé d'un agitateur magnétique, d'une sonde de température permettant d'assurer la régulation thermique au moyen d'un boîtier électronique; d'une électrode de pH (sonde Cole-Parmer AgIKcl, Chicago, II, USA) qui permet de suivre l'évolution du pH; d'une sonde à oxygène (sonde galvanique. compagnie NSS Brunswick ,NJ, USA) préalablement calibrée et qui permet de suivre en temps réel l'évolution de l'oxygène dissous; et d'un tubulaire latéral en silicone permettant le soutirage du milieu de fermentation. Conduite des fermentations et acquisition des données Le volume réactionnel de la fermentation en discontinu (Fermenteur de1,25 L en Teflon) a été de 500 mL avec 20% d'inoculum et 12% de solvant (hexane). Le milieu a été stérilisé par addition de 0,35 g/L de chloramphénicol . Le chloramphénicol qui n'a pas un effet sur la transformation (Larroche,l988) est utilisé pour prévenir les contaminations bactériennes en particulier pour des durées dépassant 24 heures. La fermentation a été effectuée en discontinu pour une concentration initiale de 54 ppm (0,32 mM), 5mM et 20mM pendant O à 50 h. Des échantillons de 20 mL sont prélevés tous les 4 h pour la détermination du poids sec, des méthylcétones et des acides aminés. Dès que le fermenteur a été ensemencé, une acquisition des données en temps réel est effectué par micro-ordinateur, ce qui a permis un suivi automatique de certains paramètres de la fermentation (pH, oxygène dissous). Analyses. Détermination du poids sec. Après centrifugation, la phase organique a été extraite avec de I'hexane (3 x 2 ml). Après lavage avec de i'eau, le culot a été filtré avec un filtre type DA de 0,65 Pm. Le filtre a été séché à 80 OC sous vide pendant 24 h. II a été ensuite transféré dans un dessiccateur une demi journée avant pesée. Le poids sec des spores est déterminé par la différence avec le poids du filtre. 2.2.3- Etude de l'effet du CO2 sur la fermentation de l'acide octanoïque en culture fed-batch dans un milieu octane-eau (chapitre3) Le mélange de spores et d'hydrolysat de caséine a été incubé dans le fermenteur tandis que le substrat (acide octanoïque) a été dissous dans un erlenmeyer contenant de l'octane (5 g1100 mL d'octane). Le pH a été maintenu constant à 6,s . Le substrat a été alimenté régulièrement selon un débit contrôlé par le programme de l'ordinateur (25 mL tous les 4h) L'essentiel de l'équipement employé a été le même que celui utilisé dans le chapitre 2. Le reste constituait d'un système d'alimentation du substrat par l'intermédiaire d'une électrovanne qui maintient un début régulier grâce à un programme d'ordinateur; d'un tubulaire latérale en silicone permettant le soutirage du milieu de fermentation; d'une sonde à oxygène; et d'une bonbonne de gaz carbonique. Le CO2 était mélangé avec de l'air pour donner des pourcentages de 5, 15, et 30% de CO2. Le tout était assuré par un débitmètre. La régulation du pH a été assurée par l'addition d'un volume de NaOH 2 N par l'intermédiaire d'une électrovanne et d'une pompe à air. L'électrovanne s'ouvrait et injectait une quantité de NaOH pour amener le pH à sa valeur de consigne (6,s). 3. Résultats et Discussion Dans ce chapitre, I'hexane est utilisée durant la fermentation mais son rôle est rapporté au 2m"chapitre. 3.l.lnfluence de la concentration en spores Le rendement en heptanone a été déterminé après 16 h de fermentation en utilisant différentes concentrations d'acide octanoïque. La capacité d'oxydation est reliée à la concentration de spores. Le tableau 1 montre les résultats obtenus dans un milieu où la concentration en spores initiale de 2,4x10i ImL a été diluée pour avoir des concentrations de I O 7 à 10' /mL. Ces résultats montrent que des concentrations inférieures à I O 6 ImL ne sont pas susceptibles d'oxyder I'acide octanoïque du moins durant le temps de l'expérience. Bien que le taux de synthèse de I'heptanone n'est pas linéairement dépendant du contenu en spores du milieu, Larroche et al. (1994) ont montré que les conditions optimales sont celles où le contenu en spores est plus haut que 106/mL.Ce phénomène pourrait être relié au potetitiel de germination (Barrios-Gonzalez et al., 1989). L'auteur a mesuré le pourcentage de germination des spores de Aspergillus niger corrélé avec la concentration des spores après 12 h. Ce pourcentage est maximal lorsque la concentration en spores est égale ou moins que I O 6 ImL. Or lorsque les cellules commencent à germer, la résistance au potentiel toxique des acides gras diminue. 3.2.Nature et composition du milieu de fermentation. 3.2.l.lnfluence de la nature du substrat L'influence de la nature du substrat sur les rendements en méthylcétones a été évaluée pour les acides caproique (C 6), caprylique (C8 ) et caprique (Cl0 ).Les rendements en quantité de méthylcétones produites pour chaque série d'acide montrent que la nature de l'acide gras influe sur le niveau de transformation et de production des composés carbonylés. Les résultats sont exprimés sur la figure 3. Les trois substrats sélectionnés réagissent différemment vis à vis des réactifs ( spores) et de leurs enzymes qui convertissent les acides gras en méthylcétones. Trente huit pour cent de l'acide C l 0 ont été utilisés contre 7% pour le C6 et 2% pour le C8. Les méthylcétones isolées par rapport aux acides transformés sont de 38% pour le C8, moins de 2% pour le C l 0 et nul pour le C 6. L'acide octanoïque est le substrat préféré par les spores de P. roqueforti pour produire les méthylcetones. Ce résultat est conforme à celui de Lawrence et Hwake (1968), Dwivedi et Kinsella ( 1974) et Kinsella et Hwang ( 1976b) . Cette préférence est cependant dépendante de la souche et de la présence ou non d'un mélange d'autres acides gras. Dans une étude récente, Kranz et al. (1992) trouvent que Monascus purpureus métabolise mieux l'acide hexanoique que les autres acides gras lorsque ceux-ci sont fournis individuellement aux spores. En présence de l'acide decanoique, le micro-organisme utilise préférentiellement l'acide octanoïque. II ressort de ces résultats que l'influence de l'acide gras précurseur sur l'activité métabolique est différente suivant que ce dernier est seul ou en mélange. L'inefficacité de l'utilisation de l'acide décanoïque s'explique par sa toxicité en raison de son hydrophobicité beaucoup plus importante (Viegas et al. 1989 ). Cette hydrophobicicité peut s'exercer négativement au niveau des membranes. 3.2.2. Influence de la concentration en substrat L'influence de la concentration en substrat a été appréciée en utilisant des concentrations allant de 10 à 64 ppm pour deux niveaux de concentrations en spores. La figure 4 montre que le rendement optimal est de 40% pour le niveau bas en spores et de 50% pour le niveau haut. La multiplication par 33 de la concentration er. spores permet d'augmenter de 10% le rendement en heptanone. 3.2.3. Effet de l'utilisation de I'acide octanoïque et du sel de son sodium pour la production d'heptanone. Un autre aspect important de la fermentation de I'acide octanoïque conceme les conditions physico-chimiques du substrat favorables au biocatalyseur. Ces conditions sont celles qui contrôlent la pénétration de I'acide octanoïque vers l'intérieur des spores. Le substrat est ajouté au milieu soit sous forme d'acide soit sous forme de son sel de sodium. La figure 5 montre que le rendement demeure presque le mëme dans la plage de concentration étudiée (32 à 81 ppm) lorsque I'acide libre est utilisé comme substrat. Les résultats obtenus ( figure 6) sont comparés à ceux des figure 4 et 5 en ce qui conceme les concentrations en substrat et la nature du substrat (acide libre et sel de sodium) . Ces résultats montrent que le sel d'acide présente un effet favorable à la synthèse des méthylcétones par les spores. La capacité des spores de P.roqueforti à métaboliser I'octanoate de sodium est augmentée comparativement aux acides gras libres (figure 6). Les données montrent que des niveaux de concentration élevés de sel d'acide peuvent être utilisés par les spores. L'incubation des spores avec des concentrations allant de 32 à 81 pprn d'acide libre ne peuvent pas produire des quantités significatives de méthylcétones. Le rendement maximal obtenu dans ces conditions est de 30% lorsque 43 pprn d'acide gras libre ont été incubés. La figure 6 mcntre que les spores peuvent métaboliser des quantités élevées d'octanaoate allant jusqu'à 90 pprn avec des hauts rendements de 72%. Nous remarquons également que des rendements de 90% sont atteints lorsque 49 pprn de sel sont utilisés contre 30% lorsque 43 pprn d'acide libre ont été incubés. De plus, les 30% de rendement sont atteints en 6h lorsque le sel est utilisé alors qu'il faut attendre 16h avec I'acide libre pour obtenir ce même rendement. L'utilisation du sel d'acide octanoique au lieu de l'acide neutre affecte positivement l'activité des spores et permet la production de I'heptanone à des concentrations élevées par rapport à celles observées avec l'acide lui même. II ressort de ces résultats qu'une des conditions essentielles qui favorise la production des methylcetones est celle qui contrôle la vitesse de pénétration du substrat. Les résultats obtenus avec des spores libres (Yagi et a1.,1990a) ou avec des spores immobilisées (larroche et a1.,1989) ont suggéré que la vitesse de la réaction ne dépend pas de la concentration résiduelle du milieu mais limitée par la concentration inteme du substrat etlou par sa vitesse de pénétration dans les spores. Or les acides gras entrent dans les cellules sous forme protonnée (Larroche et al.,1996 ; Hatton et a1.,1991; Freese et aL.1973 ; Harold et a1.,1970). Ils se dissocient dans la cellule , causent une acidification du contenu cellulaire en raison de leur faible pKa (4.8) (Ameborg et a1.,1995) et une inhibition des enzymes respiratoires (Harold et a1 .,1970). En outre, il est connu que les effets inhibiteurs primaires des composés toxiques sur les cellules fongiques se produit après qu'ils ont pénétré dans la cellule. La présence du groupe carboxylique est donc mportante pour l'activité fongicide (Freese et al., 1973), donc responsable de la toxicité. La conclusion qui se dégage de ces résultats est que le contrôle ou la limitation de la diffusion intrasporale est un moyen d'améliorer la productivité. Ce contrôle se fait dans le milieu de fermentation en foumissant le substrat non sous la forme d'acide libre mais sous forme de son sel de sodium. 3.2.4. Effet de l'utilisation des activateurs et des inhibiteurs On définit un activateur comme une substance chimique qui stimule le transport des acides gras à l'intérieur des spores. Elle est également supposée activer le cycle de Krebs en particulier des cellules âgées (Larroche,l988 ) pour fournir l'énergie nécessaire à leurs enzymes qui utilisent l'acide gras en méthylcétones. En tant que source d'énergie, les activateurs influent sur l'activation des spores pour dépasser le stade de la dormance (Lawrence, 1965). Ils induisent des transformations physiologiques pour passer d'une basse à une haute activité métabolique avec une augmentation de la quantité d'oxygène consommée par les spores. L'influence des activateurs sur l'évolution de I'heptanone (tableau 2 et figure 7) a été appréciée sous trois hautes concentrations d'octanoate de sodium pour les spores. L'analyse de variance indique qu'au moins un des activateurs utilisés dans l'expérience de fermentation fait varier le rendement en heptanone à 16 h avec un effet hautement significatif (p>F=0.009). Et 86% des sources de variation durant l'expérience est explicable par les différences entre les différents activateurs. Le coefficient de variation indique que la dispersion des données autour de la moyenne est inférieure à 25% . La figure 5 montre que le rendement pour le témoin passe de 42% à 34% lorsque la concentration en substrat augmente de 54 à 108 ppm. Ceci en raison du fait que les spores ont atteint leur limite du taux de transformation. Alanine Bien que légèrement élevé au départ par rapport au témoin, le rendement avec I'alanine décroit de 45 % à 25% (figure 7). Le niveau d'utilisation du substrat diminue, passant de 64% à 47% lorsque la concentration d'acide augmente de 54 à 108 ppm (tableau 2). L'efficacité (quantité de produit formélquantité de substrat utilisée) diminue également. Ces résultats montrent que i'alanine ne stimule pas la production de i'heptanone soit en raison de sa faible concentration par rapport à celle du substr~:(Lawrence et Bailey,1970), soit en raison de l'âge des spores (Larroche et a1.,1988). En présence de 5 pmolesImL d'acide octanoïque, i'effet activateur de I'alanine se manifestait sur des spores lavés et stockés pour 67 jours à -20 OC dmnant un reridement en méthylcétones de 70% (Larroche et aL.1988). Dans une étude récente. Creuly et al. (1992) examinaient i'effet de I'alanine sur le comportement des spores cultivés sur une variété de sarrasin pendant la fermentation de trois acides gras. En étudiant la vitesse de consommation du substrat, il trouve que I'alanine a une influence négative pour i'acide octanoïque et positive pour les acide hexanoïque et decanoïque. Le résultat obtenu lors de notre expérience le confirme même si la fermentation s'est déroulée dans un autre milieu, c'est à dire en présence d'hexane. L'alanine est aussi connue être une initiatrice de la germination des spores de P.roqueforti (Kinsella et al., 1976b) et contribue ainsi à l'augmentation de la perméabilité membranaire et à l'activité métabolique des spores (Fan et aL.1976). Durant cette période, l'entrée des acides gras est plus importante et leur toxicité pour des spores est augmentée. Glucose Pour ce qui est du glucose, le rendement est un peu élevé au départ (44%) puis diminue au fur et à mesure qu'on augmente la concentration en substrat. L'analyse de variance indique que l'effet du glucose n'est pas significatif (p>F=0.475) (tableau 3). A des concentrations d'acide élevées (72 et 108 ppm), le glucose exerce une influence sur l'utilisation de l'acide sans que toute fois que cela améliore le rendement (tableau 2). Ainsi l'efficacité diminue. II est possible que cette quantité d'acide soit utilisée pour faire de l'énergie ou simplement incorporée dans les membranes (Larroche, 1996). Les spores jeunes ou inertes ne requièrent pas l'effet des agents stimulants tels que le glucose et l'alanine (Larroche et a1.,1988). C'est ainsi que la fermentation de 5 pmolesimL par des spores stockés pour 12 jours à 20 OC donnait un rendement de transformationde 87% à 30 h (Larroche et aL.1988). Alors que le glucose est reporté être l'activateur commun pour les spores de P. roqueforti, il est possible qu'il montre simplement un effet négatif pour la souche utilisée dans l'expérience (Lawrence et Bailey, 1970). ~thanol L'effet de l'éthanol a été étudié à une concentration relevant de la littérature (Larroche,l988 ). La figure 7 montre que la production de l'heptanone passe de 33% à un maximum de 48% lorsque la concentration en octanoate augmente de 54 à 72 ppm. Ensuite le rendement en heptanone diminue lorsque la concentration en substrat est supérieure à 72 ppm, en particulier à 108 ppm. Et lorsque la concentration d'octanoate augmente, la quantité d'acide utilisée par les spores augmente également de 50 à 6O%.(tableau 2) A 72 ppm, l'effet activateur de l'éthanol sur les spores jeunes pourrait être le résultat d'une perméabilisation de la membrane (Lawrence et Bailey, 1970). L'augmentation de la quantité d'acide utilisée serait le résultat d'une forte entée du substrat à l'intérieur des spores en présence d'éthanol. Cependant. I'effet inhibiteur de l'acide octanoique peut être accru lorsque celui-ci est en association avec I'ethanol (Viegas et al.. 1989). Le faible rendement en méthylcétones observé à 54 ppm est donc la révélation toxique de l'éthanol qui défavorise la production de I'heptanone. A une forte concentration de 108 ppm, la productivité en heptanone est faible. L'acide solubilisé par l'éthanol révèle une haute toxicité pour les spores à cette concentration. Hvdrolvsat de caséine L'hydrolysat de caséine est un mélange d'acide aminés et de peptides dérivés du lait. La quantité de méthylcétones produite en présence d'hydrolysat de caséine est présentée à la figure 5. Le tableau 2 montre également le niveau d'utilisation de I'acide octanoïque en présence de I'hydrolysat de caséine. Celui-ci est utilisé à une concentration de 0,l glmL (King et a1.,1980). L'analyse de variance indique que I'hydrolysat de caséine présente un effet hautement significatif sur le rendement en heptanone (tableau 3). Avec les trois concentrations d'acides présentées, le substrat est totalement transformé même aux concentrations pour lesquelles la répression catabolique vis- à -vis des spores a été manifestée (108 ppm). L'utilisation de l'hydrolysat de caséine à cette concentration (O.lg /mL) développe une pression osmotique exteme plus importante qui favorise la perméabilité des spores au substrat. Les rendements sont nettement élevés de 83,5% à 54 ppm d'octanoate et 80,5% pour 108 ppm. L'effet positif de l'hydrolysat de caséine sur le métabolisme de l'acide octanoïque provient de son potentiel nutritif pour les spores de P. roqueforti. En effet, I'hydrolysat de caséine est un mélange de peptides et d'acides aminés. II est riche en acide aminés tels que l'acide glutamique et l'acide aspartique. Ces deux acides aminés, contrairement à l'alanine, que les spores des moisissures pourraient mal utiliser, peuvent être rapidement métabolisés en s'incorporant dans le cycle de Krebs (Lawrence et Bailey, 1970). Une autre explication viendrait de l'effet tampon que les acides aminés pourraient exercer sur le milieu et réguler ainsi la délivrance du substrat aux spores et en maintenant un pH intracellulaire compatible avec les exigences métaboliques. Cet effet tampon est renfmé par la présence de peptides qui forment avec les acides gras des complexes l< sel 2. . Dans ce cas, le complexe formé entre I'octanoate et les groupements aminés des acides aminés et des peptides est plus soluble. Acide maloniaue L'utilisation de l'acide malonique ( 0,001 g/L) a montré une inhibition totale de la consommation du substrat. Ce résultat semble montrer i'inhibition du cycle de Krebs. Cependant, mime si les expériences ont été répétés trois fois pour chaque traitement afin de confirmer l'hypothèse du blocage du cycle de Krebs, il faudra mesurer le niveau des composés du cycle de Krebs, la consommation d'oxygène ainsi qu'à varier les différents paramètres (concentration inhibiteur, aération. agitation, etc). 3.2.5.Utilisation des acides aminés Les acides aminés de I'hydrolysat de caséine constituent une fraction importante du lait et du fromage (Polychroniadou et al., 1979). Les moisissures utilisent une variété de composés organiques incluant les acides aminés.lls constituent une source importante nutritive pour leur métabolisme (Lawrence et Bailey, 1970) et stimulent la germination des spores de Penicillium roqueforti (Lau-once, 1967). L'influence d'un hydrolysat de caséine sur la fermentation des acides gras en heptanone a été démontrée comme jouant un rôle nutritif pour P. roqueforti (King et a1.,1980 ). L'expérience présente est réalisée pendant une période limitée de non croissance (16h) et I'influence de I'hydrolysat de caséine sur la croissance est jugée négligeable. Pans une expérience précédente (figure 7), I'effet de I'hydrolysat de caséine sur la production en méthylcetones a été démontrée. Cependant durant la fermentation de i'ocatanoate de sodium, le pH reste constant. Ce qui nous amène à se demander si les acides aminés libres sont consommés, auquel cas le pH d~?vrait en principe augmenter. Ce travail consiste à évaluer l'utilisation de certains acides aminés du mélange pendant la fermentation. II cherche également à déterminer la nature des composés qui jouent le rôle majeur durant la consommation de I'acide octanoïque. L'assimilation des acides aminés du mélange durant la fermentation est illustrée sur la figure 8. L'analyse cinétique de ces acides aminés a été faite par chromatographie en phase gazeuse après dérivation et silylation des acides aminés L'acide aminé majoritaire détecté dans ce mélange est I'acide glutamique avec 0,11 mglmL. Les autres acides aminés tels que alanine, tyrosine, phenylalanine, histidine et autres sont en quantités mineures. Les acides aminés ne sont pas tous représentés . Le profil (figure 8) montre trois catégories d'utilisation des acides aminés: les acides aminés qui sont immédiatement consommés (acides glutamique et aspartique ), les acides aminés qui sont utilisés après un temps de latence ( tyrosine, phénylalanine et les acides aminés qui sont peu consommées (alanine et histidine ). La diminution des acides aminés est due à la consommation par les spores. La vitesse de consommation reliée aux différents acides aminés suggère un degré de sélectivité pour les acide glutamique et aspartique. La diminution plus rapide de 0,11 à 0,01 mglmL pour I'acide glutamique et de 0,037 à 0,0058 mg/mL pour I'acide aspartique indique une utilisation préférentielle du système perméase pour ces acides aminés. Les acides aminés tels que tyrosine, phénylalanine et histidine ne sont pas consommés dès les premières heures. Un temps de latence de 4 h est nécessaire avant que les perméases soient mobilisés. La cinétique de ces acides aminés aromatiques indique que leur diffusion peut contribuer à la production d'énergie nécessaire pour la dégradation de I'acide octanoïque. En général, le transport des acides aminés vers l'intérieur des cellules se fait par diffusion facilitée. Ce mode de transport est imposé par la présence d'un gradient de pH dû à la présence d'un milieu extérieur plus concentré en ions H' que le milieu intérieur. Ce gradient de pH est généré lors de l'oxydation des molécules NADH au niveau de la chaîne respiratoire à la suite de la dégradation de l'acide octanoïque en acétylcoA. Les ions H' produits migrent de la chaîne respiratoire vers l'extérieur de la cellule et créent le gradient de pH. Des études réalisées sur Streptococcus lactis ont montré la relation entre la vitesse de transport de glutamate et du pH interne (Driessen et al., 1987 ; Poolman et al., 1987). Dans notre cas, ce gradient est annule par l'existance d'un pH extérieur plus élevé. La vitesse de consommation des acides aminés demeure ainsi indépendante du gradient du pH . Elle apparaît probablement reliée au degré d'affinité des différentes perméases par rapport à la nature et à la concentration de ces acides aminés. L'utilisation rapide de ces aciaes aminés suggère la possibilita que les transporteurs spécifiques soient induits lors de la culture des spores. Ces derniers sont cultivés et se multiplient sur du PDA (Potato-Dextrose-Agar), riche en acide glutamique et aspartique par rapport aux autres acides aminés. Les proportions des acides aminés dans la pomme de terre par mg d'acide aminé1 100 g de matière sèche de tubercule sont de 162 à 212 mg pour I'acide aspartique, 345 mg pour l'acide glutamique, 19 à 45 mg pour l'alanine, 174 à 316 mg pour la tyrosine, 91 à 204 mg pour la phénylalanine et 71 à 239 mg pour l'histidine (Davies, 1977 ). Des transporteurs peuvent donc être induits plus que d'autres. Cette hypothèse peut être vérifiée en cultivant les :;ores sur du PDA en présence d'hydrolysat de caséine et en regardant de nouveau le profil d'utilisation des acides aminés. L'autre possibilité vient de l'induction de ces transporteurs en raison de la richesse en acides aminés. L'hydrolysat de caséine présente des concentrations différentes en acides aminés, ce qui influe sur les constantes d'affinités des transporteurs vis-àvis d'acides aminés plus que d'autres.Pour vérifier cette hypothèse, la fermentation devra être conduite en présence d'acides aminés individuels de même concentration et vérifier le nouveau profil d'utilisation. Enfin, les acides glutamiques et aspartiques sont métabolisés directement au niveau du cycle de Krebs par la voie de I'oxaloacétate et de l'alphacétoglutaraie en utilisant les molécules de NAD disponibles. Ce qui représente un intérêt pour les spores de se fournir rapidement de l'énergie. L'alanine et l'histidine sont au contraire peu consommés. Cette consommation est inactivée par la présence d'un haut pH interne qui inactive le transport de l'alanine dont le pK apparent est de 7 (Driessen et al., 1987) . Ce résultat confirme celui observé à la figure 7 et pour lequel l'alanine ne présente pas un effet significatif sur la production en rnéthylcétones lorsque les spores sont inertes. Tableau 1. Effet de la concentration en spores sur le rendement en heptanonea I Concentration I Rendement en heptanone (9) de spores/ mL Concentration d'acide (pprn) l " 1mL hexane, 1 mL Tampon phosphate pH 6,8,16 h ,28 O C , volume total=8mL. Tableau 2. Effet (%) des activateurs sur la transformation de l'acide gras Octanoate de sodium (ppm) Activateur(%) 54 72 1 1 08 1 Rendement (%) Témoin Glucose Ethanol Alanine Hydrolysat de Caséine Acide malonique Rendement (%)= Méthylcétone formé /Acide de départ. IT(%)=indice de transport=Acide transformé1Acide de départ IE (%)=indice d'efficacité= Méthylcétone formé1Acide transformé. . Tableau 3 Analyse de variance : Effet des différents activateurs a sur la production de i'heptanone Source de variation DL SCEb MC' Modele 6 5404.032 900.671 Errour 7 843.482 120.49 Total 13 6247.514 valeur F P 7.47" 0.009 0.0044 Contrastes Témoin VS Caséine 1 2057.006 2057.006 17.07" Témoin Vs Ethanol 1 357.708 357.708 2.97 0.128 Témoin Vs Glucose 1 68.495 68.495 0.57 0.475 Caséine Vs Ethanol 1 917.606 917.606 7.62' 0.028 "(Glucose, Ethanol, Alanine, Hydrolysat de caséine) ; %CE= somme des carrés des écarts. 'MCE= moyenne des carrés des écarts. DL= dégrée de liberté Coefficient de détermination :R2=0.86. Coefficient de variation : Ck20.73 "Affinité" Substrat- Spores 100% 80% DAcide mleu I O Acide transforme 60% Cetone mleuIAcide transforme 40% 20°>0 ~ C e l o n emleu/Acide depan O". Cl0 a C6 Acides gras Figure 3. Effet de la longueur des chaîne d'acides gras sur la conversion en méthylcétones correspondantes : 1,5'106 spores. 1ml d'hexane, 1.5 ml de tampon phosphate pH 6.8, 1,5 h ,28 O C . Milieu aqueux, volume totak8mL. 10.7 21 32 43 54 64.5 t 6 . 1 0 E 7 Acide octanoique(pprn) Figura 4. Effet de la concentration en acide octanoique et en spores sur le rendement en heptanone. Concentration de spores utilisées : 1.8x10bspores et 6x107spores; 1rnL d'hexane ;l,5mL tampon phosphate pH 6,8 ,16 h, 28 OC. Milieu aqueux. volume total =8 mL, O 5 10 15 20 Temps (h) I I Figure 5. Effet de la concentration initiale d'acide octanoïque et du temps de fermentation sur le rendement en heptanonea 100 - E g - 90 -- 80 -- 70 -- 60 --- P 50 40 LE 30 .- -20 -- t36ppm 10 .- t49ppm O O 5 10 Temps (h) 15 20 Glppm nppm +9Oppm Figure 6. Effet de la concentration initiale de sel d'acide octanoïque sur le rendement en heptanonea. '5'10' spores, ImL d'hexane, 2 mL de Tampon phosphate pH 7, 16 h, 28 OC. Milieu aqueux, volume total du milieu=8 mL. Figure 7. Activation de l'oxydation de I'octanoate de sodium par différents activateurs à différentes concentration d'acide. 5'107spores, 2 mL tampon phosphate pH 68, 16 h, 28°C.; éthanol 2vUmL, glucose ImglmL. Alanine 0,5 mglmL, Hydrolysat de caséine 0,l glmL. Milieu aqueux, volume total du milieu=8mL. -- 0.1 O 4 8 12 16 Temps (h) Figure 8. Utilisation des acides aminés provenant de I'hydrolysat de caséine durant la fermentation de I'octanoate de sodium par P.roqueforti. 10' spores. 60 mL d'hexane, 16 h, 28 OC. 0,04 glmL d'hdrolysat de caséine. Milieu aqueux, volume total du milieu= 500 mL. Dans cette étude, nous avons examiné certaines conditions du milieu permettant aux spores de P. roqueforti de produire des méthylcétones à partir d'acides gras. Une de ces conditions conceme la nature du substrat lui mëme. En raison de leur lony~eurde chaînes différentes, certains acides gras sont mieux métabolisés que d'autres par les spores de P. roqueforti. Bien que l'acide caprique est plus utilisée (38%) que l'acide caproïque (7%) et I'acide caprylique (2%), la quantité de méthylcétone issue de cette transformation est 19 fois plus importante chez I'acide caprylique qu' avec l'acide caprique alors qu'elle est nulle en présence de l'acide caproïque. L'acide caprylique, comme les autres acides gras, présente à des degrés variables une certaine toxicité. C'est ainsi que les spores utilisées dans l'étude étaient incapables de métaboliser des concentrations dépassant les 54 ppm durant les 16 h de la fermentation. En revanche, lorsque l'acide octanoïque est présent sous la forme de sel de sodium, la performance des biocatalyseurs est augmentée mëme à des concentrations de 72 ou de 108 ppm. Ces résultats montrent que la toxicité des acides gras est associée à leur forme non dissociée. L'entrée massive des molécules d'acide gras sous la forme protonée acidifie le milieu htracellulaire et peut causer un blocage de l'activité métabolique et enzymatique des spores. Durant la synthèse de I'heptanone, l'oxygène est requis. Le cycle de Krebs est aussi mis à contribution pour fournir l'énergie nécessaire à la dégradation de l'acide gras. Cette énergie provient en partie de I'acide lui même. Elle peut provenir également de . certaines substances telles que l'alanine, le glucose, l'éthanol l'hydrolysat de caséine, etc. Lorsque les spores sont jeunes et inertes. l'addition au milieu de ces composés énergétiques en présence de concentrations importantes en substrat. n'améliore pas leur performance. excepté pour I'hydrolysat de caséine. Ces résultats suggèrent qu'il y a certains composés métabolisés qui influeraient plus rapidement pour favoriser la transformation du substrat en énergie (glucose, éthanol) ou pour favoriser la formation des produits (hydrolysat de caséine). La non stimulation de l'oxydation de l'acide octanoïque en heptanone par le glucose (1 mglmL). l'alanine (0,5 mg/mL) ou l'éthanol (2 pVmL ) serait due au fait que les spores utilisés étaient plus jeunes que ceux utilisés par Lawrence (1966) et Larroche (1988). Ils n'ont pas subi de traitement de lavage (Lawrence et Bailey, 1970 ) ou de congélation (Larroche et a1.,1994 ). La capacité des spores à oxyder les acides gras diminue avec l'âge et c'est l'addition de ces composés activateurs qui vont stimuler la consommation d'oxygène et la formation des méthylcétones. Ces résultats semblent montrer également que hydrolysat de caséine est meilleur que les autres activateurs dans les conditions où les spores sont jeunes et la durée de fermentation courte. Ils suggèrent l'hypothèse selon laquelle les différents nutriments peuvent ëtre métabolisés à differentes vitesses, contrôlant la vitesse à la quelle le cycle de Krebs peut ëtre stimulé pour induire l'oxydation de l'acide gras. Pour apprécier le rôle de ces composés dans le fonctionnement du cycle de Krebs et la formation des méthylcétones, d'autres expériences auraient été nécessaires. Par exemple, on aurait pu mesurer le taux de consommation de l'éthanol, de l'alanine et du glucose dans le temps. On peut également vérifier l'efficacité de chaque activateur en utilisant differentes concentrations. La classification des activateurs reste pour l'instant difficile dans la mesure où les conditions utilisées n'étaient pas absolues. L'hydrolysat de caséine (0,l g/mL) est 200 fois plus concentrée que l'alanine. De même, le contenu énergétique pour ces différentes concentrations d'activateurs n'est peut ëtre pas équivalent. Ce sont donc les niveaux énergétiques de ces composés pour stimuler soit la perméabilité soit le cycle de Krebs qui devront ëtre comparés. Le manque de telles données dans la littérature ne nous a pas permis de vérifier l'information. Ces données sont nécessaires pour comprendre les conditions physiologiques du micro-organisme qui ne sont pas les mëmes suivant les niveaux de glucose, d'éthanol et d'alanine. Le rôle plus important joué par l'hydrolysat de caséine à la différence de l'alanine et des autres composés énergétiques, tient à sa richesse en acides aspartique et glutamique. Même pour des courtes périodes, ces acides aminés sont rapidement métabolisés, foumissant de I'énérgie aux biocatalyseurs. La vitesse à laquelle ces acides aminés sont assimilés est explicable par l'induction des transporteurs spécifiques. 5. Bibliographie Adda ,J. et Dumont, J..P. 1973. Les substances responsables de l'arôme des fromageî à pate molle.Le lait. 53 1-532, 1-12. h e b o r g , N . Moos, M.K Jakobsens, M. 1995 The effect of acetic acid Tolerance and Trehaiose content of Saccaromyces Cerevisiae.BiotechnologyLettea.17 :1299-1304. Barrios -Gonzàles, J. Maninez, C. Aguilera, A. et Raimbault, M.1989. Germination of concentnted Suspensions of Spores from Aspergillus Niger .Biotechnology Letters.l1:55 1-554. Creuly, C. Larroche,C. et Gros.J.B.1992. Bioconversion of fatty acids into methyl Ketones by spores of Penicilli~otn roqueforrii in Water-organic solvent, two-phase systern. Enzyme Microb.Technol.14:669-678. Daney. C.K et Kinsella ,J.E. 1971. Rate of formation of methylketones during blue cheese ripening. J. Agric. Food Chernistry. 19: 771-73. Daney, C.K. et Kinsella .J.E. 1973. Oxidation of sodium U-'' C pdrnitate into carbonyl compounds by Penicilliornt roqueforri spores. J.Agric. Food chem. 21:72 1. Davies. A.C.M. 1977. The free minoacids of tuben of potato varieties grown in England and Ireland. Potato Res. 2O:9-2 1. Driessen.A.J.M. Kodde, J. De J0ng.S. et Konings.W.1987. Neutd Amino acid tnnspon by membrane vesicles of Srreprococcus crentoris is subject to rerulation by interna1 pH. Journal of Bacteriology, 169: 2738-2754. Dwivedi ,B. K. et.Kinsella, J. E 1973. Continuous Production of Blue-Type cheese flavor by submegrrl fermentation of Penicillium roqueforri. Journal of Food Science.39: 620-622. Freese, E. Sheu,C.W. et Galliea.E.1973. Function of lipophilic acids as antirnicrobiai food additives. Nature .241:321-325. Fan, T.Y. Hwang. D.H et Kinsella, J. E. 1976. Methylketone formation during germination of P.roqueforti. J.Agric Food chem .24:34347. Feron, G. Bonnarme. P. et Durand. A.1996. Prospects for the microbiai production of food flavoun. Trends in food science & Technology. 7: p285-292. Gervais,P. Cnjek,W. Bensoussan.M.1988. Influence of the water activity of a solid subsu;tre on the growth n t e and sporogenesis of filamentous Fungi. Biotechnolog and Bioengineering. 3 1 :457-463. Gun; 1M.I.et J m e s , A.T.1980. lipid Biochemistry: An intro.luction, p75. Chapman & 1:alI. London.Harold ,L. Lewis et Dennis W.Darnail. 1970. Fatty acid toxicity and Methylhtone Production in Aspergillus niger . Journal of Bacteriology. 101:65-71. Hatton. P.V. et K;nderlerer,J.L1991. Toxicity of medium chain fatty acids to Penicillium crusrosum Thom and their detoxification to mett~ylketones.Journri1of Bacteriology. 70: 401407. Hwang, D.H. Lee, Y.J.et Kinsella, J.E.1976. P-ketoacyldecarboxylase activity in spores and Mycelium of Penicillium Roqueforri. int. J . Bic:hemistry, 7: 165-171. Kinderlerer, J.L. et Kellard, B.1984.Ketonic nncidity in coconut due to xerophilic fungi. Phytochemistry. 23:2847-2849. Kinderlerer, J.L.1987.Conve~ion of Coconut oil to methylketones by two aspergillus species. Phytochemisuy. 26: 1417-1420. King. R.D. et Clegg. GH .1979.The inetabolism of fatty acids methylketones and s e c o n d q alcools by Penicillium roquefoni in blue cheese slurries. J Sci . Food Agric 30 :197-202. King .R.D. et Clegg, G.H. 19S3. The effects of casein on the metabolism of fatty acids. methylketones and s e c o n d q alcohols by Penicillium roquefoni in buffered solutions. J.Sci. Food Agnc 3 1 :481486. . Kinsella J. E et Hwang. D. 1976a. Biosynthesis of flavors by Peiiicillium roqueforri. Biotechnol Bioeng .18 : 927-938 Kinsella, J.E. et Hwang, D.H.1976b. Enzymes . ~ fPenicilli~an roqueforri involved in the biosynthesis of cheese flavor. CRC crit. Rev. Food Sci. Xutr.8: 191-228. Kr~nz,C. Pmirz,C et Kunz ,B. 1992 . Biotransformation of frere fatty acids in mixtures to methyl ketones by Monascus purpuceus. Applied Microbiology and Biotechnology. 36 4 3 6 1 3 9 Lmberet,G. Auberger. B. Canteri. C et Lenoir, J. 1982. L'aptitude de Penicillium Caseicolun~à la digradation oxydative des Acides gras. Rev. lait Fr. 406.13-19. hoche,C. Besson, 1. et Gros. J.B. 1996. internai substnte concentrations dunng biotransformation of octanoic acid into 2-heptanone by spores of Penicillium roqueforri. Journal of Indusuiai Microbiology .16: 19-35. Lmoche C, Tallu. B. and Gros, J.B.1988. Aroma production by spores of Penicillium roqueforrii on a synthetic medium. J. Ind. Microbiol3: 1-8. L;irroche,C. et Gr0s.J.B. alginatenudngit 1989. Batch and continuous ?-heptanone production by ca- RL entrapped spores of Penicilliurn roqueforri. Biotechnolog et Bioengineenng. 34: 30-38. h o c h e , C. Besson. L et Gros, J.B. 1991. Behavior of spores of Penicilliurn roqueforri dunng Fed-Batch Bioconversion of Octmoic Acid into 2-Heptanone. Biotechnolog et Bioengineenng. a:699-709. Lawrence,R.C. 1966. The oxidation of htty acids by spores of Prnicillium roqireforti. J.Gen. Microbiol.U:393305. Lawrence, R.C. et Hawke J.C. 1968. The oxidation acids by mycelium of Prnicilliron roqireforri. J.Gen..Microbiol, 51,289-302. Lnwrence, 1967. The metabolisme of tnglycendes by spores of Penicilliron roqueforri. J.Gen. Microbiol. 46: 65-76. Lawrence, R.C et Bailey. R.W.1970. Evidence for the role of the citnc acid cycle in the activation of spores of Penicillirrrn roqcteforri. Biochim. Biophys. Acta.208:77-86. Waheva.E. G. Djelveh.C. h o c h e and J .B. Gros.1984. Spomlation of Penicilliirm roqrrrforri in solid subsvate fermentation. Biotechnol. Lett. 6 : 97-102 Moskowitz, G.J.1979. Inocula for blue-veined cheeses and blue cheese flavor. In: Microbial Technology.2nd. vol.11 (Peppler. A.J. and D. Perlman.eds.). pp.201-210, Academic Press. New York. Pannel. L K. et Olson. N.F. 1991. Methylketone production in milk-fat-coated microcapsules. 2. Methyl ketones from controlled concentntions of free fatty acids. J.Dairy Sci. 71 : 20512059. Poolman, B. Smid, E.J et Konings. W.N.1987. Kinetic Propenies of a phosphate- Bond- Driven Glutamate-Glutamine tmspon system in srrrprococcus lacris and srrrprococcrrs ,remoris. Journal of Bacteriolog, 169: 2755-2761. Polychroniadou, A. et Vlachos, J. 1979. Les acides aminés du fromage téléme. Le lait. 585-586: 235-243. Taylor.F.1995. Blue cheese flavor production by submerged fermentation with on-line monitoring by g s chromatognphy. Journal of Industrial Microbiology. 1571-74. Viegas,C.A. R0sa.M.F. Sacorrein.1. et NovYs.M.N.. Isabel Sa-Correla. et Julio M. 1989. Inhibition of yeast growth by octanoic acids produced dunng ethanolic fermentation. Applied and Environmental Microbiolog. 55 21-28. Yagi. T. Hatano. A.Kawagushi. M.Hatano, T. Furnio Fukui, F. et Fukui, S 1990 a. Methylalkylketone Fermentation from Palm-Kernel oil by penicillium decumbens IF07091. Journal of Fermentation and Bioengineering. 70:lOO-103. Yagi .T.Hatano, A.Kawaguchi, M. Hatano, T. Fukui, F. et Fukui ,S. 1990 b. Screening of Methylketones-Accumulating fungi from Type culture Strains. Journal of Fermentation and 2ioengineering .70: 94-99 CHAPITRE 2 Importance d e la fermentation d e s acides gras dans un milieu à deux phases Resumé L'heptanone est produite à partir de l'acide octanoïque ou de son sel de sodium par les spores de P.roqueforîi dans un système eau-hexane. La réaction utilise des spores inertes dans un milieu contenant l'acide octanoïque ou son sel de sodium et i'hydrolysat de caséine (0,04glmL). L'évaluation des paramètres tels que la température et le pH ont montré une température optimale de 28 OC . L'hydrolysat de caséine joue le rôle de tampon autour du pH 5,s à 6. La réaction a montré que I'hexane peut être utilisé pour augmenter la quantité d'oxygène solubilisée sans diminuer l'activité des spores. En fait, la productivité en heptanone s'en trouve doublée. L'hexane permet également aux spores de mieux supporter et d'utiliser des concentrations jugées toxiques d'acide octanoïque (10 mM) . Les acides gras sont des composés toxiques aux moisissures. Leur biotransformation en méthylcétones dépend de la concentration d'acide non dissocié présente dans le milieu . Plusieurs procédés de fermentation ont été utilisés pour produire des méthylcétones. Ces procédés utilisent des spores ou du mycélium dans une fermentation submergée en utilisant de la crème lipolysée sous pression et avec aération (Nelson,1970). Cette technique a été améliorée pour faire un système continu (Dwivedi et Kinsella,1974) mais elle demande des durées longues. C'est ainsi que la fermentation a l'état solide a été étudiée (Tomassini et a1.,1995). ce qui a permis de rabaisser la durée de fermentation de 19 a 6 jours. Cependant dans ces fermentations, la concentration d'acide gras doit ëtre étroitement contrôlée, surtout si d'autres précurseurs d'acide gras et lipases ont été ajoutés, car l'excès d'acides gras accumulé peut en effet inhiber la croissance de P.roquefortiet la réaction de P-décarboxylation. Pour limiter l'effet toxique des acides gras et favoriser la biosynthèse des méthylcétones, une autre approche est décrite par Pannell et Olson (1991). Les spores de P. roqueforfi ont été encapsulées avec une variété de lipases afin d'accélérer le développement des flaveurs. Les spores encapsulées tolèrent mieux des hautes concentrations d'acide gras car leur migration à l'intérieur des capsules diminue leur concentration effective. Cependant cette méthode n'empêche pas la métabolisation des . méthylcétones. Pour résoudre le problème lié a la toxicité d'autres techniques ont été utilisées . L'utilisation du silicate pour l'adsorption du n-butanol (Moreira et a1.,1981) et la technique de fermentation sous dialyse. Mais ces techniques réduisent la toxicité liée aux produits de fermentation et non celle du substrat. L'immobilisation des spores de P. roqueforfi étudié par Creuly et al. (1992) a permis d'augmenter la stabilité mécanique et l'activité des spores mais le transfert de l'oxygène est limité. Cette deuxième partie du mémoire traite l'importance de la fermentation des acides gras dans un milieu organique et l'influence de la durée sur la productivité. Étant donné que la synthèse des méthylcétones se fait par mécanisme aérobie. la disponibilité de I'oxygène aux cellules demeure un des facteurs à considérer pour favoriser la réaction. Celle-ci a eu lieu dans le milieu aqueux. Or trois problèmes sont rencontrés quand les méthylcétones sont synthétisés dans le milieu aqueux. Le premier est lié à la disponibilité de l'oxygène. La fermentation des acides gras est connue comme un processus aérobique et l'oxygène dissous est cnicial pour la bioconversion. L'alimentation de l'oxygène dissous est généralement limitée dans une fermentation aérobique à cause de sa faible solubilité dans les solutions aqueuses (8 à 10 ppm). Pour enlever cet obstacle, des vecteurs d'oxygène tels que certains hydrocarbures ont été ajoutés au milieu pour améliorer la fermentation (Rols et a1.,1989 ; Rols et Goma, 1989). 11 a été montré que les hydrocarbures jouent un rôle intermédiaire dans le transport de I'uxygène des bulles gazeuses à la phase aqueuse. Rols et Goma (1991) ont utilisé de l'huile de soja pour augmenter le transfert de l'oxygène durant la culture de Aerobacter aerogenes. De même, l'influence du n-hexadecanesur la fermentation de la pénicilline avec P. chrysogenum a été attribuée à la concentration de I'oxygène dissous et au changement morphologique (Peng et Chen.1994). Les effets des hydrocarbures ont été attribués à la haute solubilité de l'oxygène dans ces composés. Larroche et al. (1992) ont utilisé une isoparafffine industrielle afin de produire des méthylcétones (C5Cg) en utilisant des spores inertes initialement cultivées sur du sarrasin. La fraction d'acide octanoique convertie en 2-heptanone est évaluée à partir du rapport volume de CO, dégagé pendant la réaction sur le substrat. Cependant, il existe très peu d'information dans la littérature sur les effets des solvants organiques sur la production des méthylcétones. Or certains rapports ont préconisé la nécessité de maintenir un haut niveau d'oxygène pour favoriser la productivité en méthylcétones (Larroche et aLl994). Du fait que la fermentation se produit dans un environnement aqueux. la récupération des méthylcétones demeure une étape cruciale. Cette étape limite également la compétitivité du procédé de fermentation. Ceci en raison du fait que les méthylcétones ont un coefficient d'activité plus important dans l'eau (Larroche,l988). Par ailleurs, dans une fermentation, comme les méthylcétones sont en concentration faible. ils sont solubles dans I'eau. II est alors difficile de les séparer. C'est le deuxième probleme. La solution serait alors d'effectuer une distillation. Seulement si on chauffe trop, on risque de détruire les spores. Le dernier probleme est lié à la volatilité du produit surtout si on effectue un balayage avec de I'air. En plus, comme les méthylcétones sont en contact avec les spores. elles peuvent par conséquent ëtre métabolisées en alcools secondaires (King et Clegg,1979). En plus, il est souvent nécessaire de garder la concentration des méthylcétones au dessous d'une certaine concentration car elles peuvent à leur tour inhiber les biocatalyseurs. C'est pour réduire ces obstacles et limiter l'influence toxique des acides gras sur I'activité métabolique des cellules qu'une technique de fermentation extractive a été proposée (Minier et Goma, 1982). Elle est utilisée pour réduire l'inhibition par le produit en enlevant les produits de la fermentation in situ tout en gardant le substrat, ce qui réduit sa toxicité effective envers les spores. Malheureusement il existe très peu de publications sur la production des méthylcétones par fermentation extractive (Creuly et al .,1992). L'objectif de cette étude est donc de tirer profit de ces travaux en utilisant de I'hexane directement dans le milieu de bioconversion. Celui-ci offre I'avantage d'être accepté dans les procédés alimentaires (exemple, extraction des huiles végétales) et peut ëtre analysé directement par chromatographie en phase gazeuse. II reste à s'assurer que l'environnement marqué par la présence de I'hexane soit susceptible de maintenir la viabilité des cellules, car la piésence d'un solvact organique peut engendrer des effets biochimiques et physiques pouvant affecter I'activité catalytique des cellules en raison de sa toxicité (Pinheiro et Cabral, 1991). Osborne et al. ( 1990) ont utlisé un système aqueux-organique pour étudier I'activité de lla-hydroxylase de la progéstérone en présence des spores de Rhizopus nigricans. En raison de sa faible solubilité dans I'eau (0,143 mM), I'hexane était très loin de saturer la phase aqueuse pour pouvoir affecter les membranes de spores. Ainsi l'amélioration du procédé est possible car I'hexane non seulement améliore la solubilité de I'oxygène mais extrait les méthylcétones par affinité au fur et à mesure qu'elles sont produites dans la phase aqueuse, échappant ainsi à une possible dégradation par les spores. Cette technique offre l'avantage d'enlever les effets toxiques du produit et du substrat sur les spores. Dans ce chapitre, le comportement des spores de P.roqueforti durant la fermentation des acides gras dans ce système à deux phases sera rapporté. Les effets de I'hexane dans la bio-conversion de I'heptanone ainsi que la consommation en oxygène seront examinés. 1.1. Les méthodes de fermentation A cause du besoin croissant d'arômes concentrés dans les plats, desserts, salades et soupes, un certain nombre de techniques a été développé pour produire des concentrés de methylcétones. 1.1.1 Fermentation submergée Cette technique utilise des spores ou du mycélium frais. La fermentation submergée a été étudiée par Nelson (1970) afin de produire des méthylcétones potentiellement commercialisables. Le procédé utilise un inoculum riche en spores. En effet, la méthode qui encourage le maximum de sporulation est basée sur le contrôle de la composition du substrat avec une pression osmotique élevée. La moisissure est alors cultivée dans un milieu contenant du lait stérilisé en présence de 3 à 4% de sel. Les méthylcétones sont produites dans un milieu additionné de crème lipolysée, sous pression avec aération pendant deux à trois jours. Dwivedi et Kinsella (1974), tirant profit des travaux précédents, en particulier sur la possibilité d'obtenir un milieu riche en spores, ont développé dans leur laboratoire un système de fermentation continu utilisant du mycélium avec un flux de gras laitier alimenté en continu. Dans leur cas, les spores sont cultivées dans un milieu stérile comprenant 5% d'extrait de malt, 0,5% d'extrait de levure et en présence de 2% de glucose. Les spores sont récoltées aseptiquement dans un flacon contenant de la liqueur de mais. Un jeune mycélium se développe après 4 jours puis est transféré dans un deuxième contenant de liqueur de mais et de sucrose, dont le pH est ajusté à 7 par du NaOH. La culture préalablement diluée est enfin transférée dans un flacon n04 où des acides gras produits par une lipase pancréatique ont été envoyés par une pompe et ajustés de manière à obtenir 20 pmoles d'acide graslmg de moisissures. Bien que long (18 à 19 jours), le procédé présente l'avantage de pouvoir changer et ajuster les concentrations des méthylcétones en changeant celles des acides gras dans le milieu de fermentation. Nous avons vu que ces techniques demandent des durées longues. C'est ainsi qu'une technique de fermentation à I'état solide a été étudiée (Tomassini et a1..1995). Elle utilise du lait concentré contenant 50% de matière sèche et 26% de gras. Un coagulum est développé sous l'action de souches lactiques (L. lactis et L. helveticus]. Des coupes de 0.5 cm ont alors été effectués avant l'inoculation des spores de P. roqueforti. La production des flaveurs est réalisée pendant six à sept jours et les concentrations en 2heptanone et 2-nonanone sont respectivement six et deux fois plus hautes que celles obtenues par Dwivedi et Kinsella (1974). Dans ces fermentations submergées, la concentration d'acide gras doit être étroitement contrôlée surtout si d'autres précurseurs d'acide gras et lipases ont été ajoutés. Car l'excès d'acides gras accumulé peut en effet inhiber la croissance de P.roqueforfi et la réaction de j3-décarboxylation. L'utilisation potentielle de P. roqueforti dans une fermentation à I'état solide afin de diminuer la durée de l'opération a été aussi étudiée par Kirane et al. (1995). 11 s'agit d'un mélange de lait de vache (48%), de lait écrémé (la%), de caseinate de calcium (4%) et d'extrait de soja en poudre (30%). L'acidification du milieu est d'abord réalisée par fermentation de l'extrait de soja en présence de Lactobacillus acidophilus qui conduit à la réduction en sucres (stachyose. raffinose et saccharose). Le produit est alors mélangé avec le lait de vache et utilisé comme substrat pour P. roqueforti. Après quatre jours de maturation à 27 OC et 85% HR, 10% de crème lipolysée sont ajoutés. Une concentration maximale (11 mg.g") de méthylcétones est obtenu après 6 jours avec une faible teneur en sucres et la flaveur de fève de soja n'est plus détectée. II semble que le produit final offre des applications potentielles dans l'industrie alimentaire. Cependant l'élimination des hydrates de carbones indésirables est dépendante de la croissance du mycélium qui souvent pose problème dans la récupérationdes produits. Un problème inhérent à ces techniques souvent en .t batch 1~ est le décalage entre le moment de la prise d'échantillon et son analyse pour mesurer la concentration en méthylcétones. Ces essais nécessitent plusieurs extractions et des colonnes de séparation. C'est ainsi que la technologie de fermentation submergée a été améliorée en couplant au procédé de production une colonne chromatographique en phase gazeuse (Taylor, 1995). Une souche sélectionnée de P. decumbens a été utilisée et les conditions d'agitation et d'aération étudiées. La concentration en pentanone (100 ppm) obtenue est dix fois supérieure à celle rencontrée dans le fromage bleu (sur la base de la matière sèche). 1.1.2.Production par spores encapsulées Pour limiter l'effet toxique des acides gras et favoriser la biosynthèse des méthylcétones, une autre approche est décrite par Pannell et Olson (1991). Les spores de P. roqueforti ont été encapsulées avec une variété de lipases afin d'accélérer le développement des flaveurs. II est connu que la concentration en acides gras exerce un contrôle sur la production des méthylcétones. voire un effet limitant dans le fromage (Kinsella et Hwan,1976b). Même si des études pour déterminer le niveau de concentration maximale tolérable par les capsules sont nécessaires, il semble que celles-ci tolèrent mieux des hautes concentrations d'acide gras car leur migration à l'intérieur des capsules diminue leur concentration effective. Cependant cette méthode n'empêche pas le métabolisme et la disparition des méthylcétones. L'autre problème est lié à la possibilité qu'une certaine quantité d'acide gras puisse migrer dans les parois des capsules et échapper ainsi à la réaction. A cause de cette instabilité des méthylcétones, les capsules ne sont pas utiles pour beaucoup d'application visant la maturation accélérée du fromage. 1.1.3. Production par spores immobilisées. L'immobilisation des spores de P.roqueforti par un gel d'alginate enfermé sur un copolymère acrylate-méthacrylate permet d'augmenter la stabilité mécanique et l'activité catalytique des spores (Larroche et al.,) et donc la vitesse de consommation du substrat (Creuly et al1 ; 1990 ;1992) . Les spores immobilisés produisent jusqu'à 2 fois plus de méthylcétones que les spores libres (Creuly et al., 1990 ). Malgré cette performance, le procédé de l'immobilisation des cellules aérobiques présente des problèmes parmi lesquels la rétention des cellules dans la matrice, la résistance au transfert de masse de nutriments et des produits à travers la matrice. La vitesse de réaction peut être modifiée lorsque la concentration en biomasse dans la matrice dépasse 1 g/L (Creuly et a1..1990). Cette matrice devient alors incapable de retenir cette biomasse, ce qui peut provoquer une turbidité graduelle dans le surnageant. L'effet de l'immobilisation sur la physiologie de Penicillium chrysogenum pendant la production de la penicilline a été étudiée (Mussenden et al., 1993). Il a été conclu que la restriction sur le transfert de masse de l'oxygène lequel limite la productivité était le résultat de l'immobilisation. 2.Résultats et Discussion Pour augmenter la productivité des méthylcetones a partir de la fermentation d'acides gras. I'hexane a été utilisé. L'objectif est de fournir aux spores un environnement favorable pour la production de rnéthylcétones. Pour cela. la présence d'un solvant non miscible et très faiblement soluble à l'eau est une des stratégies. Cette condition est indispensable pour la viabilité des cellules. L'hexane permet de dissoudre le substrat hydrophobe, de limiter la toxicité de ce dernier vis à vis des spores et d'augmenter la solubilité de l'oxygène, indispensable dans une fermentation aérobie. 2.1 .Efficacité de la transformation en absence et en présence d'hexane Le taux d'utilisation d'acide utilisée par les spores en absence d'hexane est beaucoup plus important qu'en présence d'hexane (figure 9b). En effet. la quantité d'acide utilisée est 80% apres 2h et de 98% apres 24h dans le milieu aqueux contre 20% après 2 h et 45% en fin de réaction en présence d'hexane. L'acide est peu utilisé en présence d'hexane a cause de I'échange et de la libération lente entre les acides gras solubilisés dans la phase organique et les spores qui sont dans le milieu ;queux. Par contre la productivité en méthylcétones est de 1,5 à 2 fois plus élevée en présence qu'en absence d'hexane (figure 9c). Dans le milieu purement aqueux, les méthylcétones. en contact avec les spores, peuvent à leur tour être métabolisées (King et Clegg,1979). C'est ainsi que la courbe de I'heptanone en milieu aqueux reste en dessous de celle observée en présence d'hexane. Dans le milieu biphasique, les méthylcétones migrent par affinité au fur et mesure de leur synthèse. Elles échappent ainsi au métabolisme par les spores. A quatre heures, la courbe d'évolution de I'heptanone en présence d'hexane décroît pour réjoindre celle du milieu aqueux (figure 9c). Ce résultat indique une production instable, une perte quelconque par volatilité ou un problème d'analyse . Ces résultats démontrent clairement que le système à deux phases hexane-eau comparé au système purement aqueux (figure 9a et 9b.) peut être un bon milieu de bioconversion par les spores. Dans un systeme aqueux, les coefficients d'activité des méthylcétones sont élevés (Larroche et a1.,1988). La bonne récupération des méthylc4tones est favorisée par la baisse des coefficients d'activité de ces arômes et de leur dissolution dans l'hexane, ce qui prévient leur utilisation par les spores. Le rendement final en méthylcétones en présence d'un solvant organique est presque 2 fois celui récupéré dans un systeme purement aqueux (figure 9b). II est intéressant de constater que la présence du solvant organique dans le milieu c'affecte pas l'activité des spores soit par leur contact avec la portion immiscible, soit par la partie soluble de I'hexane dans l'eau (0,143 mM). L'amélioration du système demande toutefois d'évaluer les effets toxiques du solvant en réalisant des expériences qui déterminent les ratio solvant~volumedu milieu . 2.2.Effet de I'hexane températures. sur le rendement en heptanone à différentes L'effet de la température sur la production des méthylcétones en absence et en présence d'hexane est présenté au tableau 4. L'examen a été fait à des températures de 20,24 et 28 OC. En absence d'hexane, les concentrations en heptanone sont rapidement plus élevées durant les 8 premières heures avec des rendements comparables à 28°C et 24°C et un rendement inférieur à 20 OC. Cette productivité est trois à quatres fois moins élevée en présence d'hexane durant la même période. Dans le système aqueux, l'échange acide gras-spores est beaucoup plus rapide au départ à toutes les températures alors que dans le mélange biphasique c'est un échange lent qui se fait entre les molécules d'acides gras solubilisées dans la phase organique et les spores. Par contre après 12 h. la productivité en présence d'hexane devient plus forte, surtout à 28 OC, en raisori de l'augmentation de la vitesse de consommation du substrat. Celle-ci est facilitée par la capacité du solvant à solubiliser le substrat, à l'apporter et le faire passer à travers la capacité du solvant à solubiliser le substrat, à l'apporter et le faire passer à travers la membrane des spores. A partir de 12 h, les rendements baissent sauf à la température de 28 OC. A la fin de la réaction, le maximum de formation de i'heptanone s'est produit en présence d'hexane et à 28 OC. Ce résultat est relativement conforme à celui obtenu par Yagi et al. (1990a) avec Pénicillium o'ecumbens IF0 791. 11 montre que le métabolisme des acides gras par les spores de Pénicillium est davantage favorisé à une température de 28 OC laquelle correspond à la température optimale de la réaction (Kinsella et Hwang,1976b). Ces résultats indiquent que les spores sont capables de métaboliser les acides gras avec des niveaux d'éfficacité décroissant suivant les températures 28 OC >24 OC> 20 OC. 2.3.Effet de I'hexane sur la solubilisation de l'oxygène et sur la vitesse de réaction. Un élément important de toute fermentation aérobie est la fourniture en oxygène. Celuici est indispensable pour les NADH et FADH oxydases de la moisissure et doit être préalablement dissous dans le milieu aqueux. Or la solubilité de l'oxygene dans le milieu aqueux est limitée. Comme des solutions pour i'amélioration ds la fermentation des acides gras par les spores passe par le transport de i'oxygéne, une façon d'augmenter le taux de transfert de I'oxygène est donc d'ajouter une seconde phase dans le milieu de fermentation dans laquelle la solubilité de l'oxygène est augmentée. La figure 10 montre le profil de I'oxygène dissous pendant la fermentation de i'octanoate de sodium avec P .roquefortidans un fermenteur agité. La fermentation est conduite en utilisant 12% (vlv) d'hexane qui joue aussi le rôle d'antimousse en s'adsorbant sur l'interface gaz-liquide. Dans ces essais expérimentaux. la concentration de substrat utilisée est de 54 ppm dans 20 mL de milieu. Pour les essais de référence, sans vecteur d'oxygène (c'est à dire I'hexane), la concentration d'oxygène dissous dans le phase aqueuse passe de 8.2 à 9.5 ppm après agitation. Puis elle diminue pour se stabiliser à 9 pprr! après 2 heures . Le rendement en heptanone est égal à 23.5% et la biomasse accumulée à 16 heures est égale à 70 mg1L. Quand I'hexane est présent dans le milieu de fermentation , la diminution de l'oxygène dissous se fait pendant une demi heure puis augmente progressivement jusqu'à 9.8 ppm . Ce résultat indique que la solubilité de I'oxygène dans la phase aqueuse est favorisée en présence de solvant organique . L'hexane est ainsi devenu ainsi un réservoir d'oxygène et l'échange est plus facile entre deux phases liquides (hexane-eau) qu'entre air-eau. Durant l'échange hexane-eau, la production en heptanone est égale à 54,3% soit presque deux fois plus importante qu'en absence d'hexane. La production en biomasse est égale à 57 rngll. Le profil de l'oxygène dissous et le rendement obtenu montrent que la vitesse de consommation du substrat et la biomasse accumulée sont fortement influencées par la présence de I'hexane dans le milieu de fermentation .La diminution de I'oxygene dissous dans le milieu de fermentation indique sa consommation par les spores (figure 10). Cette consommation a eu lieu lorsque le substrat commence à pénétrer à l'intérieur des spores pour subir l'oxydation. La diminution de I'oxygène dissous se fait plus rapidement lorsque le fermentation a eu lieu en présence d'hexane. Ce qui indique que . la vitesse d'oxydation du substrat est plus grande. Enfin dans un milieu biphasique la vitesse de pénétration du substrat à l'intérieur des spores se fait plus rapidement que dans un milieu aqueux. Ces résultats montrent un des avantages qu'offre l'utilisation de I'hexane pour augmenter la solubilité de l'oxygène. II est en effet connu que la solubilité de I'oxygène dans les hydrocarbures est plus forte que dans Veau pure. D'une part, Rols et Goma (1989) ont exploré les moyens d'ajouter au milieu de fermentation un liquide qui a une haute solubilité en oxygène, et d'autre part, l'utilisation de l'hexadecane par Ho et al. (1990 ) a permis d'augmenter de huit fois cette solubilité et favoriser la production de la pénicilline. A cause de la faible diminution de I'oxygène dissous pendant les 16 heures de la fermentation (figure IO), l'addition dans le milieu de grandes concentrations (20mM) devrait permettre de visualiser mieux le phénomène de consommation de I'oxygène. Or comme le montrent les figures 11 et 12 , la concentration d'oxygène dissous ne varie pas par rapport à l'expériences précédente : faible consommation d'oxygène par les spores puis stagnation en absence d'hexane. La concentration de substrat utilisée étant considérée m ' w e pour P. roqueforti (Creuly et al., 1990), le rendement en heptanone obtenu en absence d'hexane est nul. La diminution de l'oxygene dissous peut être attribuée à une petite activité cellulaire . la biomasse a augmenté légèrement de 4 à 8 heures pour rester constante par la suite. Lorsque le solvant organique est ajouté au milieu, la quantité de l'oxygene dissous est augmentée (figure 12) et le rendement obtenu à 16 heures est de 12%. Ces résultats montrent que même pour des concentrations inhibitrices, l'utilisation de la fermentation extractive permet d'enlever cette inhibition. 2.4. Effet de la durée de fermentation sur la consommation en oxygène et sur le rendement en heptanone 2.4.1. Effet de la durée sur la consommation en oxygène par les spores inertes Les spores inertes cueillies sont incubées dans le milieu en absence de substrat et la consommation en oxygène par les cellules est mesurée à 28 Oc (température optimale de la scl~che)par une sonde pour une fermentation d'une durée de 50 h . L'évolution de la consommation d'oxygene est indiquée sur la figure 12 laquelle montre une biotransformation conduite en présence d'hexane, la concentration d'oxygène dissous augmente jusqu'à 12 ppm après agitation . En absence de substrat, la consommation d'oxygene endogène est très faible (figure 13) ; mais lorsque le milieu est additionné d'acide octanoïque, en présence d'hydrolysat de caséine comme sources ci,? carbone et d'énergie, la concentration d'oxygene dissous est fortement augmentée (figure 14). La concentration de l'oxygène dissous diminue de 11.8 à 7.9 mg/L durant les premières 18 heures et tombe presque à zéro par la suite. Lorsqu'on tient compte de la concentration d'oxygene dissous en absence de substrat (consommation endogène), on peut dédgire que la vitesse de consommation d'oxygene est de 350 nmoledh et par mg de poids sec lorsque 5 mM d'octanoate de sodium sont additionnés aux spores. Pour des cellules de même âge, la quantité d'oxygène consommée est donc fortement dépendante de la présence de substrat carboné. La pénétration de l'acide dans les spores résulte en une forte diminution de l'oxygène dissous compares à l'activité en absence de substrat indiquant sa consommation. Ces résultats suggèrent que les spores manifestent une activité métabolique lorsque les conidies et le substrat sont en contact. Cette expérience montre qu'on peut diviser la cinétique de fermentation en deux périodes: La première période est caractérisée par une faible consommation en oxygene qui est toute de mëme nécessaire pour assurer la régénération du NAD, et la deuxième phase (après 18 h ), caractérisée par une forte consommation en oxygène. Ceci signifie la très forte contribution du cycle de Krebs qui va assurer la production des squelettes carbonés précurseurs des constituants organiques cellulaires nécessaires pour la germination, par exemple. Aussi, l'observation directe des conidies au microscope à 6, 10, 18. 32, 42, et 48h a montré des changements morphologiques à partir de 18h . L'examen au microscope a eu lieu. Le gonflement des conidies par augmentation de leur diamètre indique leur début de germination. Un début de formation de mycélium a eu lieu à 48h. Cette germination résulterait de la perméabilisation des parois sous l'influence de I'oxygène (Barrios-Gonzales,l989). La consommation de celui-ci jusqu'à un certain seuil, déclenche la germination. L'oxydation du substrat ou du produit en tant que source de carbone et la présence d'hydrolysat de caséine comme source d'azote jouent également un rôle dans la germination. On note également une augmentation de la température à 50 h, ce qui semble indiquer la présence d'une culture exothermique. 2.4.2. Effet dc- la durée sur le rendement en heptanone L'accumulation de I'heptanone est indiquée sur la figure 15. Elle représente deux phases dont la première est caractérisée par une productivité élevée en méthylcétones et une consommation totale du substrat. L'analyse de la matière sèche montre également une biomasse globalement constante, ce qui explique que I'acide gras subit une transformation chimique sans qu'il participe à la croissance du micro-organisme au moins durant cette période. La deuxieme phase (après 18 h ) se manifeste par une diminution de la productivité en méthylcétones (figure 15) et une forte consommation en oxygène (figure 14). La figure 12 montre ainsi que les conditions aérobies influencent fortement la vitesse de synthèse de I'heptanone par les pores laquelle est de 7,14'10"' mmolelhlspore L'utilisation maximale de 1.18'10"\ 6,7'10'" d'acideIUspore foumit . g de méthylcétonesIU spore lorsque la consommation d'oxygène est minimale (première phase) pour un rendement de 57%. A noter que I'acide est complètement consommé avant la fin de la première période. Lorsque la concentration de l'oxygène dissous diminue jusqu'à 7,9 mglL, la productivité en heptanone baisse également. Quand l'expérience se poursuit jusqu'à la deuxième phase, les cellules sont capables d'une fermentation butyrique. En effet de I'acide butyrique dont la présence a été confirmé par spectrométrie de masse, est produit à 48 h. il est. La production de I'acide butyrique est le résultat d'une forte consommation en oxygène et de l'utilisation de méthylcétone comme source d'acétylcoA. Le début de germination pendant la deuxième période se passe quand le substrat est totalement consommé. En effet, les acides gras sont connus être inhibiteurs de la germinations des spores des bactéries et sont antifongiques. Ce début de germination coïncide aussi avec la baisse de la productivité en heptanone. Ce résultat montre que la période de meilleure productivité correspond à celle où les spores sont inertes, confirmant les résultats de Fan et al. ( 1976) qui ont montré que les spores incubées dans un milieu contenant une source de carbone et d'azote manifestent, après un cefiain temps, des changements morphologiques et physiologiques qui sont connectées à la germination. La perte de la capacité à synthétiser I'heptanone est reliée à la perte de résistance des parois au potentiel toxique des acides ( Fan et al., 1976 ) suite à ces changements. Ces modifications physiologiques des parois rendent les spores plus perméables à la pénétration de ces acides . Les résultats obtenus dans cette étude suggèrent que la germination des spores apparaît après une totale consommation de I'acide octanoïque et défavorise la synthèse de I'heptanone laquelle est favorisée lorsque les spores sont inertes. La pénétration de l'acide dans les spores est suivie d'une importante consommation en oxygène. Cette pénétration se passe par un mécanisme de transport actif qui nécessite de I'ATP (Larroche et a1.,1994 ;1996) produite par i'activité biocatalytique des spores. Cette étude montre que l'optimisation de la production de i'heptanone par les spores de P.roqueforti passe par la suppression de la période de germination. Elle implique pratiquement des fermentations de courte période et sans limitation d'oxygène. 2.4.3. Evolution du pH pendant la fermentation Le milieu initial a été ajusté à pH neutre par addition de NaOH et son évolution a été suivie (figure 16). Pour étudier i'évolution du pH durant la fermentation. nous avons ajouté 20 g d'hydrolysat de caséine au milieu réactionnel. En présence d'hydrolysat de caséine, le pH reste constant durant la fermentation que ce soit à faible ou à forte concentration d'acide (figures 11,12 et 14). Ceci indiquerait qu'il n'y a pas eu production de NH, dans le milieu, ou que les acides aminés jouent alors le rôle de tampon. En absence d'hydrolysat de caséine, le pH reste constant durant les quatre premières heures puis monte progressivementjusqu' à 7.9 après 16h. L'augmentation du pH en absence d'hydrolysat de caséine correspond à une diminution de la concentration d'acide dans le milieu. Ces résultats montrent que les acides gras entrent à i'intérieur des spores sous forme protonnée, ce qui diminue la concentration des ions H' dans le milieu de fermentation. Certains autsurs ont noté i'influence du pH sur la production des méthylcétones et il ressort que des conditions alcalines ou proches de la neutralité sont celles favorables à la production des méthylcétones (Yagi et a1..1990a), ce qui est le cas dans un milieu tamponné par hydrolysat de caséine (expériences précédentes). 2.5.Effet de I'hexane sur le rendement en biomasse et sur la diminution de la toxicité des acides gras Les acides gras sont des composés hydrophobiques connus pour être ar~tifongiqueset antibactériens. A cause de leur caractère hydrophobique, ils peuvent s'accumuler très fortement dans les membranes (Osbome et al., 1990) des cellules de Rhizopus nigricans. La toxicité des acides gras envers les micro-organismes eucaryotes peut s'exercer en inhibant la consommation de l'oxygène et /ou au niveau des membranes par accumulation. Ils peuvent alors inhiber des enzymes comme les déshydrogénases membranaires. Notre étude consiste à examiner l'effet de l'hexane sur l'accumulation de ces substances. En contrôlant le rendement en biomasse. L'effet de I'hexane a été examiné sur le rendement en biomasse. Comme indique dans le tableau 5 ci dessous, les rendements en matière sèche ont été calcules. Les résultats montrent qu'en absence d'hexane, les rendements en matière sèche sont de 16 à 24% supérieurs. Une autre expérience précédente réalisée en présence de 54 ppm (figure 9) donne une biomasse de 70 mg/L en absence d'hexane contre 57 mglL en présence d'hexane après 16h. soit une différence de 18%. A la lumière de ces résultats, 2 hypothèses peuvent être retenues :La première est que l'hexane extrait des composés nydrophobiques sur les membranes des spores augmente la perméabilité et diminue la quantité de matière sèche. La seconde est que les acides gras pourraient se coller au niveau des parois des spores (Larroche et a1.,1996) en raison de la nature lipohile de ces parois, ce qui augmente la biomasse en absence d'hexane. Ces résultats expliqueraient le potentiel toxique beaucoup plus important des acides gras sur les spores lorsque la fermentation est faite en absence de solvant organique. L'acide octanoïque s'accumule dans les membranes cellulaires ( Osbome et al .1990 ; Larroche et a1.,1996) et aux parois des spores. En se collant ainsi sur les parois, ils désorganiseraient certaines interactions proteines-lipides et empêcheraient l'entrée de nutriments essentiels comme les acides aminés. De plus l'oxydation enzymatique des acides gras se produit dans les structures intemes de la cellule proche de la paroi cellulaire. Tableau 4.Effet de I'hexane sur la biosynthèse de i'heptanone a différentes Rendement (%) SansHexane Temps TOC 28 24 " 54 ppm d'octanoate de sodium , AvecHexane 20 28 24 20 5'109 spores, hydrolysat de caseine (0,04 glmL), hexane (12% v/v). 16 h ; 28OC. Milieu acqueux, volume total=253 mL. Tableau 5. Effet de I'hexane sur le rendement en biomasse en présence et en absence d'hexanea Rendement de biomasse mg/L Temps (h) avec Hexane Sans Hexane Différence (%) " 3'10' spores, 5 mM d'octanoate de sodium , hexane (12% vlv), hydrolysat de caséine (0,05 glmL), 16 h, 28 "C ; Milieu aqueux, volume total=500mL. . -Csans hexane ' 10 15 20 25 +avec hexane ! 1 Temps (h) Figure 9a. Evolution de l'acide residuel durant la fermentation dans un milieu aqueux et organiquea "1 15 $' &sans 5 O 5 10 15 20 25 hexane hexane Temps (h) Figure 9b. Evolution de I'acide utilisé durant la fermentation dans un milieu aqueux et organiquea. '54 ppm d'acide octanoique, 3'10'spores. ,lmL Tampon phosphate pH6,8, 1 mL d'hexane, 28 OC Volume total, 8mL. La barre représente l'écart type. 01 O +sans hex +avec hex i I 5 10 15 20 25 Temps (h) Figure 9c. Evolution de i'heptanone formé durant la fermentation dans un milieu aqueux et organiquea. ' 54 ppm d'acide octanoïque. 3'1 O'spores, , 1 mL Tampon C . Milieu aqueux, volume totak8mL. La barre phosphate pH6,8, 1 mL d'hexane, 28 ' représente l'écart type. Temps (h) Figure 10. Evolution de la consommation d'oxygène en présence et en absence d'hexane. "54 ppm d'octanoate de sodium 1'10~spores, hexane (12% vlv) hydrolysat de caséine (0.04 glmL). 28 OC. Milieu aqueux, volume total= 20 m l .Rendement d'heptanone :sans hexane= 23,596 ; avec hexane=54,3%. 5.52 I+Oxygene dssous = 5.48 5.44 Temps (min) Figure 11. Evolution de la consommation d'oxygene durant la fermentation de I'octanoate de sodium en absence d'hexanea 10 mM d'octanoate de sodium d'hexane (12% vlv) , 3'10' spores, hydrolysat de caséine (0,049 ImL) , volume total, 500 mL. Figure 12. Evolution de la consommation d'oxygene durant la fermentation de i'octanoate de sodium en présence d'hexanea '20 mM d'octanoate de sodium , d'hexane (12% vlv) , 3'10' spores, hydrolysat de caséine (0,049 ImL), 28°C .Milieu aqueux, volume total, 500 mL. Figure 13. Evolution de la consommation d'oxygène par les spores en absence de substrata . 7'10' spores. d'hydrolysat de caséine (0.049 /ml), 0,175 g de chloramphénicol et d'hexane (12% vlv). 28 %.Milieu aqueux, volume total= 500 rnL. -cO*ygene O 10 20 30 40 50 dissous -+pH - Temps (h) Figure 14. Evolution de la consommation d'oxygène et du pH au cours de la fermentation de I'octanoate de sodiuma -n- Substrat residuel -a- RoduR f o r d O 10 20 30 40 50 Temps (h) Figure 15. Evolution de la consommation de I'octanoate de sodium, du produit et de la biomasse au cours de la fermentationa '5 mM d'octanoate de sodium ; 7.10~ spores, d'hydrolysat de caséine (0,04 glmL), 0.175 g de chloramphénicol et d'hexane (12% vIv), 28 OC. Milieu aqueux, volume total= 500 mL. 5.5 5 4.5 +pH . ( avec hydroiysal; caseine) -a- pH (sans hydroiysal ; ~ : caséine) Figure 16. Evolution du pH pendant la fermentation de I'ocatanoate de sodium" "5mM en présence d'hexane et 3'10' spores ; en absence et en présence d'hydrolysat de caséine (0,04 glrnL) , 16 h et 28 O C . Milieu aqueux, volume total=500 mL. A la lumière de ces résultats, on constate que la productivité en méthylcétones peut être augmentée par l'ajout dans le milieu de fermentation de l'hexane. L'utilisation d'un solvant organique non miscible à l'eau permet d'offrir aux cellules un environnement favorable en permettant entre autres, une augmentation de la solubilité de l'oxygène et une amélioration de l'activité fermentaire des cellules par l'augmentation du taux de transfert de l'oxygène. Après un certain temps, l'échange entre deux phases liquides (hexane-eau) est plus facile qu'entre deux phases air -eau. En outre, l'hexane permet de garder le substrat qui est foumi aux spores par échange contrôlé. Les produits issus de la réaction, les méthylcétones, migrent par affinité vers la phase organique. Ils échappent ainsi à leur transformation en alcools secondaires par les spores (King et clegg. 1979). Enfin, la toxicité des acides gras envers les spores diminue lorsque la fermentation se fait en présence d'hexane. La biomasse toujours élevée en absence d'hexane signifie que l'acide octanoïque pourrait, à cause du contact physique direct, peut s'accumuler dans les membranes cellulaires (Osbome et al.. 1990) ou s'incorporer facilement dans les parois des spores (Larroche et al., 1996). A cause de leur caractère fongicide, ces acides pourront empëcher les activités métaboliques et enzymatiques des spores mais les résultats démontrent que même à des concentrations dites inhibitrices pour les spores, l'utilisation de solvant organique permet de foumir le substrat à des niveaux acceptables pour les spores . L'examen de quelques paramètres de la fermentation dans le milieu biphasique a montré que la réaction est favorisée à 28 O C durant des périodes courtes et que le temps de la réaction ne doit pas pas dépasser 16 à 18 heures. En effet, lorsque la durée est trop longue, la concentration d'oxygène diminue dans le milieu et la germination, étape métabolique défavorable à l'activité fermentaire des spores. La paroi de celles-ci devient beaucoup plus perméable à l'entrée des acides qui s'accumulent à l'intérieur et manifestent leur toxicité. L'ensemble de ces résultats peut être étendu à d'autres solvants moins volatils que l'hexane, par exemple, l'octane qui fait l'objet du prochain chapitre. 4. Bibliographie Bmios-Gonzales, J. Mutinez. C . Aguilera, A. et Raimbault,M.1989. Germination of concentrated Suspensiosn of Spores from Aspergillus h'iger. Biotechnology Lettea. 1155 1-554. Creuly, C . h o c h e . C et Gros J.B. 1992. Bioconveaion of fatty acids into methyl Ketones by spores of Penicilliurn roquefonii in Water-oganic solvent. two-phase system. Enzyme Microb.Technol.l3:669-678. Creuly, C., h o c h e , C . et Gros J.B. 1990. A fed-batch technique for 2-heptanone production by spores of penicillirim roqritforrii. Appl. Microb Biotechnol. 34.20-25. Dwivedi, B. K. et.Kinsella, J.E.1974. Continuous Production of Blue-Type cheese flavor by submeged fermentation of Penicilliritn roqiieforti.Journal of Food Science. 39: 620-622. Fan. T. Y. Hwang,D.H et Kinse1la.J.E. 1976. Methylketone formation during germination of P.roqueforri.J.Agric Food Chem .24:44347. Ho, C.S. Ju, Lu-kwang. et Badour. R.F. 1990. Enhancing Penicillin fermentations by incremed oxygen solubility Throujh the addition of n-hexadecane. Biotechnology and Bioengineering. 36: 110-11 18. King, R.D. et Clegg, G.H. 1979.the metabolism of fatty acids. méthylketones and secondxy alcools by Penicilli~imroqlreforri in blue cheese slurries. J Sci Food Agric 30 :197-202. Kinsella, J.E. et Hwang, D .H. 1976a. Biosynthesis of flavors by Penicilliiim roqrieforri. Biottechnol Bioeng 18 : 927-938 Kinsella, J.E. and D.H. Hwang.1976b. Enzymes of Penicillium roqiieforri involved in the biosynthesis of cheese flavor. CRC cric. Rev. Food Sci. Nutr.8: 191-228. Kirane, D. Viera- Machad0.E.S. C0chet.N. Nonus, M. et Jean- Michel Lebeault, J.iM.1995. Blue cheese flavour production on a mixed substnte and lipolyzed c r e m : Stachyose, sucrose biodegradation and Methylketones formation. Sciences des Aliments. 15 A55-466. h o c h e , C . Muhammad Arp& M. et Gros, J.B. 1989. Methyl-ketone production by CaalginateEudngit RL entrapped spores of penicillirim roqrieforri. Enzyme Microb.Techno1. ll:lO6-ll2. Lmoche, C. Tallu, B. et Gros, J.B.1988. Aroma production by spores of Penicillirtrn roqriefortii on a synthetic medium. J. Ind Microbiol3:l-8. Larroche. C. Besson, 1. et Gros. J.B. 1993. Brhavior of spores of Prnicilliirttt roqirrforri during Fed-Batch Bioconversion of Octanoic Acid into 2-Heptanone. Biotechnology and Bioengineenng. 44: 699-709. Minier. M. et Goma, G. 1982. Ethano1 production by extractive fermentation. Bioteshnol. Bioeng. 13: 1565-1679. morei ira, A .R. Ulrner, D.C. et Linden, J.C. 1981. Butanol toxicity in the butylic fermentation. Biotechnology and Bioengineenng Symp. II 567.579. mus sen den, P.Keshavm,T. Saunders, G. and Bucke, C.1903. Physiological studies related to the immobilization of Per~icillirrm clirysogrrirrrn and penicillin production. Enzyme Microb. Technol .5:2-7. Nelson JH. 1970. Production of blue cheese flavor via submerged fermentation by Prtiicilliirni roqirrforri. J.Agr Food Chem. 18 567-569 0sborne.S.J. Leaver, J. Turne. M.K..Dunill, P. 1990. Correlation of biocataiytic activity in an oganic-aqueous twwo-liquid phase system with solvent concentration in the ceIl membrane Enzyme Micr3b.Technol. 12: 28 1-29 1. Panne1 .L.K. and Olson. X.F. 1991. ~Methylketoneproduction in milk-fat-coated microcapsules. 2. Llethyl ketones from controlled concentrations of fret fatty acids. J.Dairy Sci 74 : 20542059. Peng. Chao-shien et chen. Teh-Limg. 1994. influence of n-hexane on Penicillin fermentation with Prriicillirrm Clirysogrt~lrni:the morphological effect. Biotechnology techniques.S:773-778. Pinheiro. H.M.et Cabral, J.M.S.1991. Effects of solvent Moleculx Toxicity and Microenvirament composition on the A' Dehydrogenation Activity of Arrlirobcicrrr Siniplex cells. Biotechnology and Bioengineering. 37: 97-102. Rols. J.L et Gorn3.G. 1989. Enhancement of oxygen transfer rates in fermentation using oxygenvectors. Biotech Adv. 7: 1-13. Rols, J.L. Condoret. J.S. Fonade. C. et Goma.1989. mechanism of Enhanced Oxygen Tnnsfer in fermentation using Emulsified Oxygen-vectors Biotechnology and Bioengineering. 35:427335. Rols. J.L. et G0ma.G. (199l).Enhanced oxygen transfer ntes in fermentation using soybean oilin-water dispersions. Biotechnol. Lett. 13: 7-12. Taylor. F.1995. Blue cheese flavor production by Submerged frernentation with on-line monitoring by sas Chromatography. Journal of Industrial Microbiology. 15:71-74. Tomassini, A . Bustillo, G et Lebeault. J.M.1995. Production of Blue cheese Flavour Concentrates from Different substntes Supplernenteds with lipolyzed Cream. Int Dairy Journal, 5747-257. Yagi,T. Hatano, A.. Kawaguchi,M. Hatano T. Fukui,F. et Fukui .S. 1990. Methylalkylketone Fermentation from Palrn-Kernel oil by Penicillium decumbens IF0 709 1. Journal of Fermentation and Bioengineering .70: 100-103. CHAPITRE 3 Effet du dioxyde de carbone sur la fermentation de l'acide octanoique par Penicillium roqueforti en culture Fed-batch dans un milieu octane-eau. Resumé. Une technique en Fed-batch pour la production de I'heptanone à partir de l'acide octanoïque dissous dans de l'octane est présenté. II a nécessité l'utilisation d'un pH constant par addition de NaOH 2 N pour neutraliser l'addition régulière de I'acide. Cette réaction est réalisée en présence d'un mélange d'air et dioxyde de carbone pour stimuler la production de I'heptanone. A 15% de CO, , le système montre une haute stabilité avec un rendement de 64% à 8 h avec 1,39 rnmolelh de produit formé. La réaction Fed-batch peut donc être utilisée pour étudier la production de I'heptanone dans le temps. II est connu depuis de nombreuses années que la croissance et le métabolisme des micro-organismessont accompagnés par la consommation etlou l'évolution du dioxyde de carbone. Leur besoin en dioxyde de carbone ou d'oxygène varie suivant la nature et l'état du micro-organisme et certains, comme les autotrophes, dépendent de la fixation du dioxyde de carbone. L'effet de ces gaz sur la croissance microbienne et sur la formation de produit est différent et dépend généralement de la souche du microorganisme mais aussi des conditions et de I'état de la culture. Le dioxyde de carbone est un important composant dans le métabolisme microbien non seulement comme produit mais aussi comme réactif. II est aussi nécessaire pour la production des intermédiaires métaboliques tels que I'oxaloacetate par la pyruvate carboxylase . Quand le CO, se dissout dans l'eau, il réagit selon la réaction suivante. CO, + H,O + H,CO,+HCO' ,+H' Le dioxyde de carbone est capable de pénétrer dans le cytoplasme des cellules comme dans la matrice mitochondriale. Dans ce cas, la structure de la paroi cellulaire influence sa vitesse de transport (Mclntyre et McNei1,1997). Le résultat de ce transport est I'accurnulation de I'acide carbonique et des ions bicarbonates dans la cellule ( HCO; H,CO, et 1. La dissociation de ces demiers peut neutraliser les charges sur la membrane, induisant des pressions osmotiques et donc un gonflement, causant une grande pénétration des petits ions dans la cellule. Ho et Smith(1986a) ont montré que ce phénomène de dépolarisation causait une inhibition de Pénicillium chrysogenum. Le CO, peut altérer également les membranes cellulaires en affectant le core des acides gras des membranes cellulaires des levures, altérant ainsi la fluidité membranaire (Castelli et a1.,1969 ). Les ions HCO; peuvent eux aussi affecter les charges des groupes phospholipides et des protéines de surface de la membrane. Mais le dioxyde de carbone a aussi des rôles bénéfiques, par exemple pendant la maturation du fromage. D'ailleurs, ce sont des hautes concentrations de CO, combinés avec des basses concentrations d'oxygène qui jouent un rôle important lors de la maturation du fromage bleu. des conditions défavorables pour les autres micro-organismes (Dixon et Ke11,1989). Golding (1940) a montré que P. roqueforti est capable de croître dans une atmosphère contenant 75% de CO, et 5% d'oxygène alors que P. glaucum manifeste une germination en présence de 90% de CO, . Déjà longtemps. Thom et Currie(l913) ont analysé ces gaz dans le fromage et ont mesuré des pourcentages respectifs de 21,14 à 40.95 pour le CO, et de 2.42 à 7,00 pour I'oxygène. La production de protéase par A. oryzae est aussi stimulée à 0,02-0,05 atm de dioxyde de carbone (Narahara et a1.,1982). En fermentation solide, 0,05 atm de dioxyde de carbone stimule la production de cellulase par Aspergillus sp. (Mudgett and Bajracharya,l979). En culture submergée, des hautes teneurs en CO, sont capables d'inhiber la production de pénicilline (Pirt et Mancini,l975) ou causer des changements morphologiques dans les cultures de Penicillium chrysogenum (Ho et Smith,1986a). Compte tenu de ces résultats, il a été montré que le contrôle de l'environnement gazeux peut ëtre utilisé pour optimiser les procédés de fermentation et considérer un outil pour examiner les effets du CO, et de l'oxygène sur le métabolisme microbien. Les méthylcétones sont les principaux composés aromatiques du fromages bleu. Ils sont utilisés comme ingrédient pour donner le goüt aux soupes, salades et autres plats. Creuly et a1.(1990) ont utilisé une procédure de Fed-batch pour la production de I'heptanone. Dans ce système, le pH est maintenu constant à 6,s et 0,4 mM/h d'acide a pu ëtre consommé. Dans une expérience précédente (chapitre 2), nous avons montré l'importance d'utiliser un solvant organique comme I'hexane dans la fermentation des acides gras par P. roquefofli. L'hexane permet de multiplier jusqu'à trois fois le rendement en heptanone. Mais en raison de sa volatilité, I'hexane diffuse plus facilement dans le matériel de fermentation souvent couvert de silicone. Celui-ci gonfle après un contact prolongé avec I'hexane, ce qui peut détériorer le matériel et fausser les lectures des mesures. Dans cette présente étude, nous avons au contraire utilisé l'octane, moins volatil que I'hexane et considéré la faisabilité d'utiliser les spores dans une réaction Fed-batch en présence d'un mélange d'air et de dioxyde de carbone. Dans ce travail, les effets de CO, sur la formation de I'heptanone dans un fermenteur aéré et clos ont été examinés. 2.Résultats et Discussion 2.1. Influence du CO2 sur la production en rnéthylcétones. Quatre séries de fermentation sont réalisées en opérant dans un milieu octane-eau. Une quantité de 59 d'acide sont préalablement dissout dans 100 mL d'octane puis alimenté dans le fermenteur à raison de 25 mL toutes les 4 heures. Un mélange d'airCO, est utilisé pour donner des concentrations finales dans le mélange de 5, 15, et 30% de CO, Les différentes fermentations sont comparées au contrôle dans lequel le CO, n'a pas été ajouté. Le pH tout le long du procédé reste constant à 6.5 grâce à l'addition de NaOH 2 N de manière automatique et la température est de 28 OC. Quant aux concentrations d'heptanone, elles sont mesurées à des intervalles réguliers. Ces résultats sont montrés sur la figure 17 et le tableau 6. Les valeurs reportées représentent les valeurs moyennes de deux fermentations. II se dégage de ces résultats que la concentration du CO, de la phase liquide exerce une influence sur la synthèse de l'heptanone. Le tableau 6 montre que le maximum de concentration d'heptanone est produite à 8 heures lorsqu'un mélange d'air à 15% de CO, a été utilisé pour un rendement de 64%. En présence de 30% de CO,, une très faible concentration est produite avec un maximum à 12 h. En présence de 5% de CO,. un maximum de rendement de 23% est atteint à 8 h.Toutes les concentrations de CO, présentent un effet positif par rapport au témoin. Ce phénomène peut être dü à I'effet stimulateur du CO, au niveau du cycle de Krebs. Mclntyre et McNeil (1997) ont travaillé sur Aspergilluç niger et la conclusion qui est ressortie de cette étude montrait que I'isocitrate déhydrogénase d'Aspergillus était affectée suggérant les effets spécifiques du C0,sur des enzymes clés du cycle de Krebs. L'absence presque de production chez le témoin montre l'effet hautement toxique de la concentration d'acide octanoïque utilisée même en mode fed-batch. Enfin, le faible niveau de concentration en heptanone produite en présence de 30% de CO, indique une inhibition du métabolisme secondaire et peut être primaire lorsque les spores sont exposées à des hautes concentrations en dioxyde de carbone. Ce faible niveau de production peut être le résultat de plusieurs phénomènes. Premièrement, le CO, exerce une inhibition non spécifique des enzymes nécessaires à l'utilisation du substrat ou une inhibition de leur consommation. le CO, à forte concentration peut exercer un effet inhibiteur sur l'activité des spores. C'est le cas où la pression partielle du dioxyde carbone dans la phase liquide est supérieure à la pression normale dans le cytoplasme. L'entrée d'une excessive concentration en CO, va générer une augmentation des ions HCO; dans le cytoplasme et provoquer un effet narcotique sur le métabolisme ou sur certaines voies du métabolisme primaire. Des hautes concentrations de CO, peuvent provoquer des changements au niveau de la paroi de la membrane des spores. Ho et Smith (1986b) ont étudié les altérations morphologiques causés par différentes concentrations de dioxyde de carbone allant de 8 à 15% sur Penicillium chrysogenum. Des effets tels qu'un retard de production d'antibiotique, une diminution de la vitesse de croissance et des changements morphologiques ont été constatés. Ce sont d'abord les propriétés de transport membranaire qui sont affectés en raison du gonflement provoqué par la pression osmotique. Une étude sur l'inhibition de Sclrotium rolfsii (Kritzman et Henis, 1977) a révélé une augmentation significative de I'isocitrate déhydrogénase et de I'isocitrate lyase à des niveaux de CO, de 1-10%. Deuxièment, le changement de pH induit par des hautes pressions partielles de CO, peuvent ëtre suffisantes pour perturber l'équilibre enzymatique inteme. Tel changement de pH inteme peut affecter les enzymes comme celles impliquées dans les réactions de décarboxylation qui produisent du CO, dans le milieu. II n'est pas impossible également que l'accumulation de CO, dans la cellule ralentit la vitesse de décarboxylation de l'acide octanoïque, qui est l'étape finale conduisant à I'heptanone. Le CO, peut aussi exercer une influence indirecte sur les enzymes en affectant leurs propriétés physico-chimiques, ou en réagissant avec les acides aminé Comme ceux des protéines membranaires, et causant des changements importants au niveau de l'activité. 2.2. Comportement des spores en mode discontinu et en mode Fed-batch . Les résultats montrent que la consommation du substrat diminue sous l'influence du CO, et que la concentration en heptanone augmente lorsque les concentrations en CO, sont minimales. Ceci peut indiquer que la première cause des effets indiqués peut provenir du CO,. Lorsque la concentration du dioxyde de carbone est augmentée, l'efficacité du CO, est diminuée. Celui-ci. grâce à sa capacité à pénétrer les membranes, peut produire des changements de pH intracellulaires. Ces changements, causés par une forte diffusion, peuvent être suffisantes pour perturber les équilibres enzymatiques. Dans une fermentation en discontinu (expériences du chapitre 2), la vitesse de production de I'heptanone à partir de 5 mM de sel d'acide octanoïque est de 0,32 mM/h soit 2,29'1UV mmole de produit formé par heure et par spore. Dans une réaction en fedbatch en présence de l'acide octanoïque dissous dans l'octane, la vitesse de réaction est nettement améliorée et donne 2,78mM/h. Dans une autre expérience en fed-batch, les spores ont été immobilisées afin d'améliorer la stabilité mécanique des spores (Creuly et a1..1990). Un taux de transformation de substrat de 1,73mMlh de substrat a été alors observé. Leur expérience a été réalisée sur du Bioflo C30, du verre où les spores se collent et s'agglutinent. Les résultats de l'expérience en Fed-batch en présence de 15% de CO, sont comparés à ceux de Creuly et a1.(1990). Ils montrent que l'expérience réalisée dans un fermenteur en Teflon évite le problème de l'agglutination et donne un taux de transformation supérieur à près de 65%, soit 2,78mM/h (tableau 7). 2.3. Vitesse de production de I'heptanone La vitesse de production de I'heptanone par Penicillum roqueforti est un important paramétre pour apprécier la performance du micro-organisme. L'effet du dioxyde de carbone sur la vitesse de production de I'heptanone est examiné pour chaque fermentation et comparé par rapport au témoin. La figure 18 montre que des fortes concentrations de dioxyde de carbone sont capables de réduire sérieusement la capacité des spores de P. roquefort! à produire de I'heptanone. Lorsqu'un mélange de CO, à 15% est utilisé. la vitesse de production atteint un maximum de 2.78 mMlh à 8 h. Quand un mélange d'air et de CO, à 30% est injecté dans le fermenteur, la vitesse de production est considérablement réduite par rapport à un mélange de CO, à 15% ou 5%. Cependant, l'utilisation du CO, à 30% est toujours bénéfique si on compare au témoin. Ce dernier est presque incapable de transformation en raison de la concentration de l'acide octanoïque hautement toxique utilisée (34 mmoles). Les spores non stimulées par le CO, ne sont plus capables de transformation. Lorsque les spores sont soumises à des concentrations de 30% de CO,, la production de I'heptanone est faible et la raison peut être attribuée à une accumulation toxique du dioxyde de carbone et ou des changement morphologiques des spores à de telles concentrations ( Ho et Smith, 1986a ;1986b). Ces auteurs ont étudié l'effet du CO, de 3 à 20% sur la production de la pénicilline. Ils ont montré que ses effets qui réduisent la vitesse de production, sont associés à des changements morphologiques de Pénicillium chrysogenum. Tableau 6. Effet du CO2 s u r la production de I'heptanonea Temps %CO? 4h 8h 12 h 16 h "5% d'acide octanoïque dans octane (ph), hydrolysat de caséine (0.04 g/mL), 10gspores; 28OC. Milieu aqueux, volume total=SOOmL. Tableau 7. Effet du type de fermentation et du CO2 sur la productivité en heptanonea [Subsuat initiale] Vitesse maximale* mm 1 I+Octane l Discontinu +hexane 1 Témoin 30% CO? Vitesse production mmolrm/ spore 0,003 0.3 produit total formé 5 l6h (mmoles) 0,014 1,97*1O"~ 5miM 0.32 2,29* IO'" 2Omh4 0.15 2,j*10.11 3,23 fed-batch immobilisé 4mM Vempérature=28 O C , pHS.5 ; Volume total, 500 mL. "reuly et a1.1990 ' Substrat dont production estimée à 100% de transformation en heptanone. ' La vitesse n'est pas linéaire tout au long de la réaction de fermentation. La vitesse maximale est enregistrée au cours de la première phase de la réaction (durant les premières 8h pour la réaction fed-batch et durant les 18 premières heures pour la réaction discortinue en présence d'hexane). 4 8 12 16 temps (h) Figure 17. Effet de la concentration du dioxyde de carbone sur la production d'heptanone en mode fed-batcha .5% d'acide octanoïque dans octane (p/v). hydrolysat de caséine (0,04 glmL). 10gspores,28°C.Milieu aqueux, volume totak500mL. La barre représente l'écart type. Le témoin était incapable de produire de I'heptanone à cette concentration d'acide. 4 8 12 16 Temps (h) Figure 18. Effet de la concentartion du dioxyde de carbone aqueux sur la vitesse de production de l'heptanoneaau cours de la fermentation 5% d'acide octanoïque dans octane (ph), hydrolysat de caséine (0,04 g/mL), 109 spores, 28°C. Milieu aqueux, volume total=500 mL. Cette étude a montré que le dioxyde de carbone est capable d'influencer la production de I'heptanone par les spores de P. roqueforfi. Pour les trois concentrations de dioxyde de carbone utilisées pour l'expérience, le mélange à 30% réduit la productivité. La fermentation soumise à 15% de CO, résulte en une nene augmentation de la productivité. La fermentation exposée à 5% de CO, est peu affectée. Quant à la fermentation conduite en absence de CO, elle montre que ce gaz est, d'une part nécessaire pour stimuler la production et d'autre part que les spores sont incapables de fermenter I'acide octanoïque en présence d'une aussi forte concentration en raison de sa toxicité. Castelli,A.Littani, J.P. et Barbesie,G. 1969. Effect of pH and CO2 ccncentration chançc -7 lipids and fatty acids of Saccharomyces cerevisiae. Archiv.fÜr Mihiok ..:;...' .6:34-39. Crsuly,C. larroche,;. et Gros. J.B.1990. A fed-batch technique for 2-heptanone production by spores of penicjlliumroquefortii. Appl Uicrobiol Biotechno1.34:20-25. Dixon,N.M. et Kell, D.B. 1989.The inhibition by CO2 of the growth and metabolism of micro-organisms.J. Appl. Bacteriol. 67:109-136. Golding.1940.The gaz requirements of mold. III. The effect of various concentrations of carbon dioxide on the growth of Penicillium roqueforti. J 'dairy Sc .No455 :891-898. Ho ,C. et Smidt,M.D. 1986a.Effect of dissolved carbon dioxide on penicillin fermentations: Mycelial growth and ?enicillin production. Biotechnol.Bioeng.28:668-667. Ho, C. et Smith ,M. D.1986b. hf.orphological alterations of Penicillium chrysogenum caused by carbon Dioxide. Journal of General Microbiology.l32:3479-3484. Kritzman, G.I. et Henis,Y. 1977. Effect of carbon dioxide on growth and carbohydrate metabolism in Sclerotium rolfsii . J.Gen.Microbiol.l00:167-175. Mclntyre. M. et McNeil, B. 1997. Dissolved carbon dioxide effects on morphology. growth. and citrate production in Aspergillus niger A60. Enzyme and Microbial Technology.20: 135-142. Mudgctt,R.E. et Bajracharya, R. 1979.Effects of controlled Gaz Environnements in Microbial Enhancement of Plant Protein recovery. J. Food. Biochem. 3:135-149. Narahara,H. Koyama, Y. Yoshida, T. Pichangkura,S. Ueda,R. et Taguchi.H.1982. Growth and Enzyme Production in a solid-state culture of Aspergillus oiyzae. J. Fenent. Technol, 60: 311-319. Pirt ,J.S. et Biagio, M.1975.lnhibition of Penicillin Production by Carbon Dioxide. J. appl.Chem. Biotechnol. 25:781-783. Thom. C. et Curie, J.N. 1913. The dominance of Roquefort mold in cheese. Jour. Biol.Chem.15:249-258. ANNEXES Valeurs numériques pour les tableaux et les figures Tableau 2. Effet(%) des activateurs sur la transfonation de i'acide gras Figure3. Effet de la longueur des chaînes d'acides gras sur la conversion en rnéthylcétones correspondantes Cétone isolél acide de départ Cl0 xl 1 .2 C6 O x2 0.8 Moyenne 1= 0.28 O Cétone isolél acide transformé CIO CS C6 2.08 65.6 O CIO 30.1 C6 6.8 3.92 75.8 O 311.3 70.72721 Acide transformé 37.3 33.74.09 10.8 8.8e.82 70.3 98 96 66.3d.5 1 94.3fi.23 91.2t6.78 Acide isole C 10 C8 C6 62.1 90.6 86.1 e Figure 4. Effet de la concentration d'acide octanique sur le rendement en heptanone Concentration (en ppm) xl l.8x10bspores x2 x3 M0ye~e22 10.7 22.8 30.: ..-. a.> 7 36.8 35 8.2 26.6 28.7 34.6 37 38 6.9 31.3 41.7 42.8 48 48.5 6.2 26.9~4.25 33.5536 36.76.36 40.6k6.4 40.5+7.08 7.111.01 21 32 43 54 65 Figure 5. Effet de la concentration initiale d'acide octanoique et du temps de fermentaticn sur le rendement en heptanone Concentration d'acide(ppm) 32 ppm Temps(h) x l 2 2.3 4 6,7 8 15,2 16 24.8 Temps(h) x l 2 2,s 4 85 18,4 8 16 25.6 Temps(h) 2 4 8 16 x2 03 8.3 21,4 29 54ppm Moyenne 1,620.58 7,521.13 18,314.38 26.9Q.96 x2 03 3,6 15.8 29.2 81P P ~ xl 2.6 52 18,6 27.9 x2 09 7,4 23 28.5 Moyenne 1.4+1.55 6.12353 17,121.83 27.4Q.54 Moyenne 1,521.53 6,321.55 20,823.1 1 28.220.42 43ppm xl 2,5 7,1 18,2 25.7 65ppm xl 2,2 4,7 20,8 26.5 x2 0,3 5.7 21,2 33.1 Moyenne 1,421.55 6,410.98 19.7Q.12 29.425.23 Moyenne 1 1.620.84 7,7 6,2Q.12 18 19,421.97 25.325.9+0.84 x2 Figure 6. Effet de la concentration en sel d'acide octananoique sur le rendement en heptanone Temps (h) xl 16 12,5 42,8 72.3 Moyenne 11,l 47,4 75.9 11,8+0.98 45,113.25 74.122.54 Figure 7. Activation de i'oxydation de i'octanoate de sodium par différents activateurs B différentes concentrations d'acide Figure 8. Utilisation des acides aminés provenant de I'hydrolysat de caséine durant la fermentation de I'octanoate de sodium par P.roqueforti Moyenne 0,04510.019 0,013 0.01 1 Moyenne 12 16 0,051 1 0,0158 0.00457 0,003 0,004 Moyenne 12 16 0,045 0.036 0,023 0,021 Chapitre 2 Tlibleilu 4. Effet de I'hexane sur la biosynthke de I'heptanone h différentes rempér~tures. 4 8 12 16 4 8 12 16 11,6 16,2 70,s 68.1 14,2 80 76.5 20°C 15,2'1,41 75,4+6,50 72.315.93 xl x2 11,2 16.2 65,4 51.1 56 8,4c3,95 56,4 36.7 60,9r6,36 43.9210.18 Tableau 5. Effet de I'hexane sur le rendement en biomasse en présence et en absence d'hexane 12 16 Matière sèche avec hexane (mglL) moyenne 80+5,65 95+7,07 70 75+7,07 7521 1,31 83 12 16 Matière sèche sans hexane (mg/L) moyenne 100+4,24 11012,82 112 108 112 108 110+2,82 106 114 110+5.65 Figure 13. Evolurion de la consommxion d'oxyghne par les spores en absence de substnr Quantité d'oxygène dissous (ppm) Temps (h) O 2 4 6 8 1O 12 14 16 18 20 22 xl 11.86 9,68 8,78 8,68 8,79 9,Ol 936 9,41 9,74 10.35 10,s 10,6 x2 11.9 9,76 92 8.88 8,95 9,17 9,46 9.53 9,88 10,19 10,68 10.46 moyenne 11,8810.028 9,7210,056 8,9910,296 8,7810,141 8,8710,113 9,09t0,118 9,41=0,070 9,4710,084 9,8110,098 10,27r0,113 10,5910,127 10,5310,098 Figure 14. Evolution de la consommation d'oxjgene durant la fomentation de I'octanoate de sodium Temps (h) O 2 8 12 16 18 24 32 42 48 Quantité d'oxygène dissous (ppm) x2 moyennele xl 4,936 11,38 10,249 8,41 8,23 0.375 0,387 0,382 0,391 0.45 4.982 11,56 10,433 9,15 644 0.355 10,401 0,402 0,413 1.638 4,95920,032 11,47+0,127 10,341 20,130 8,78t0,523 7,33521,265 0,365=0,014 0.394=0,009 0,39220,014 0,402=0,015 1.044+0.840 Fiaure 14. Evolution du DH durant la fermentation de I'octanoate de sodium Mesures de pH durant la fermentation moyenne Temps (h) pH1 pH2 O 2 8 12 16 18 24 32 42 6,l 6,047 63 6,378 634 6,342 636 6,39 6.38 6,02 6,037 6,154 6,384 6.56 6.42 6,41 4,338 4.574 6,0630,056 6,042=0,007 6,22710.1 03 6,38120,004 6,4520.1 55 6,38150,055 6,385*0,035 5,36451,450 5,47721,277 Figure 15.Evolution du produit formé au cours de la fermentation Heptanone (produit) formé Temps(h) xl x2 Moyenne O 6 18 24 32 42 48 O O 0.169+0,028 0,475+0,236 0,434+0.107 0,391+0,084 0,35420,083 0.389+0,008 O 0,149 0.642 051 0,451 0,413 0,395 0,189 0,308 0.358 0,331 0,295 0,383 Figure 15. Evolution du substrat résiduel au cours de la fermentation Acide(substrat résiduel) isolé Temps xl O 0.83 0.37 0,Ol O O O 6 18 24 32 42 48 50 O x2 083 0,47 0,054 O O O O O Moyenne 083 0,42+0,070 0,032=0.031 O O O O O Figure 15.Evolution de la biomasse au cc-irs de la fermentation Biomasse(matière sèche) en g/L Temps xl O 0,1E4 0,163 0,162 0,135 0,135 0,135 0.134 0.136 6 18 24 32 42 48 50 x2 0,166 0,147 0,088 0,115 0,115 0.115 0,136 0.164 Moyenne 0,165+0.001 0,155+0,011 0.125+0,052 0,125+0,014 0,125+0,014 0,125+0,014 0,135+0,001 0.15+0.019 Fioure 16. Evolution du pH en absence d'hydrolysat de caséine pendant la fe;mentation de I'octanoate de sodium. Temps(h) 1 . 2 4 6 8 1O 12 14 16 pH en absence d'hydrolysat de Caseine moyenne x2 xl 6,65+0,56 6,69 6,61 6,53i0,141 6,63 6.43 6,5i0,226 6,66 6,34 6,553~0,113 6,47 6,63 6,750,438 6.39 7.01 7,Ol *C.551 6.62 7.4 7,37i0,070 7,32 7,42 7,67+0,155 7,78 7,56 7.82i0.056 7.86 7.78 Chapitre 3 Tableau 6. Effet du C0,sur la production de I'heptanone Melange d'air et de 5% de CO2 moyenne initiale rnrnoles 12 16 Temps(h) 12 16 17,36 26,04 5,Ol 34.72 3.2 Melange d'air et de 15% de CO2 Concentration 1x1 26.04 6,04 34.72 0.9 Meiange d'air et de 30% de CO2 3,49 1.54 1,18t1,159 4,05t1,060 4,2521,074 2,3721,173 x2 moyenne 2.96 1.68 1 moyenne initiale rnrnoles 16 17,36 26,04 34.72 0,38 0.9 0.5 1 0.92