Bac blanc Février 2014

1
Bac blanc Février 2014
Lycée de la Côtière
Epreuve de physique chimie enseignement de spécialité :
(Durée 3h30)
L’usage de la calculatrice est autorisé.
Pour faciliter le travail des correcteurs, rédiger chaque exercice sur des copies séparées,
joindre l’annexe à la copie de l’exercice 3.
Exercice 1 : (5 points)
De nombreuse questions sont indépendantes où peuvent-être résolues sans avoir fait les questions précédentes.
Sur une autoroute rectiligne à deux voies, que l'on suppose infiniment longue, se trouve une camionnette (de
masse M=3 t et de longueur L = 8m) qui roule à la vitesse constante de VC = 72 km.h-1 ; et une voiture (de masse
m= 800 kg et de longueur l =5m) qui roule initialement à VO = 90 km.h-1.
PHASE I : DEPASSEMENT DE LA CAMIONNETTE PAR LA VOITURE
La voiture se place sur la voie de gauche pour doubler la camionnette à la date t=0s.
Elle réalise son dépassement, en restant constamment sur la voie de gauche, avec une accélération constante :
aO = 2,0 m.s-2 tant qu'elle n'a pas dépassé la camionnette d’exactement d = 20 m.
On étudiera le système voiture ramenée au point MV de son pare-choc avant auquel on affecte toute la masse de
la voiture.
Le repère d’étude est lié à la Terre et son origine coïncide avec la position du point MV de la voiture lorsqu’elle
débute le dépassement. On ne travaille que suivant l’axe [Ox), en conséquence seule l’abscisse des différents
vecteurs est demandée.
Début du dépassement, t = 0 s :
Fin du dépassement, t = t1 :
I.1. Conditions initiales dans le cas de la voiture.
I.1.1.Donner les caractéristiques du vecteur vitesse de la voiture à t = 0 ?
La valeur sera exprimée en m.s-1.
I.1.2.Donner les caractéristiques du vecteur position de la voiture à t = 0 ?
La valeur sera exprimée en m.
I.2. Donner la nature du mouvement de la camionnette ; puis la nature du mouvement de la voiture lors de cette
phase de dépassement.

2
I.3. Equations horaires du mouvement de la voiture.
I.3.1. Exprimer le vecteur accélération de la voiture.
I.3.2. Montrer (en faisant une primitive) que le vecteur vitesse de la voiture s’écrit :
VV (t) = ( a0 t + V0 ) i
I.3.3.Montrer que le vecteur position de la voiture s’écrit : OMV (t) = x(t) i avec x(t) =
2
1
a0 t2 + V0 t .
I.4. Exploitation des équations horaires.
Le dépassement s'achève à la date t1= 6,09 s,
I.4.1. Calculer la distance totale parcourue par la voiture à la fin du dépassement.
I.4.2. Calculer la vitesse de la voiture en fin de dépassement.
PHASE II : RALENTISSEMENT DE LA VOITURE
La voiture se rabat sur la voie de gauche, lève le pied de l’accélérateur pour ralentir dans un mouvement
uniformément varié et retrouver sa vitesse initiale de VO = 90 km.h-1 au bout de 3,0 s.
II.1. Donner la définition d’un mouvement uniformément varié.
II.2. Calculer la valeur de l’accélération de ralentissement.
II.3. Parmi les graphiques suivants, indiquer, en le justifiant, ceux qui représentent la coordonnée du vecteur
vitesse de la voiture et la coordonnée du vecteur position de la voiture pendant ce ralentissement :
PHASE III : L’ACCIDENT
Le conducteur de la voiture aperçoit un lapin en train de traverser la route, il freine brusquement et s'arrête
quasiment sur place. Le conducteur du camion, qui est en train de téléphoner, ne s'en aperçoit pas : c'est
l'accident. La camionnette percute la voiture.
On suppose:
- qu'au cours de ce choc, le système, composé de l'ensemble voiture et camionnette, est pseudo isolé.
- qu'après le choc de la camionnette reste immobile et la voiture est projetée vers l'avant.
On souhaite déterminer la valeur de la vitesse avec laquelle la voiture est projetée vers l'avant.
III.1. Donner la définition d'un système pseudo-isolé.

3
III.2. Quelle grandeur se conserve dans un tel système ?
III.3. En utilisant la question précédente, calculer la valeur de la vitesse de la voiture après le choc.
III.4. La voiture atteint-elle réellement cette vitesse ? Proposer une explication.
Exercice 2 :(5 points)
1. Spectroscopie
On se propose d'étudier la structure et les fonctions organiques de ces molécules par spectroscopie.
Document 2a : Spectroscopie Infrarouge en phase liquide. Spectre IR1(http://www.sciences-edu.net)
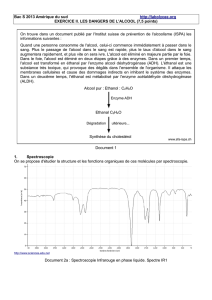
Document 1 :
On trouve dans un document publié par l'Institut suisse de prévention de l'alcoolisme (ISPA) les informations
suivantes :
Quand une personne consomme de l'alcool, celui-ci commence immédiatement à passer dans le sang. Plus
le passage de l'alcool dans le sang est rapide, plus le taux d'alcool dans le sang augmentera rapidement, et
plus vite on sera ivre. L'alcool est éliminé en majeure partie par le foie. Dans le foie, l'alcool est éliminé en
deux étapes grâce à des enzymes. Dans un premier temps, l'alcool est transformé en éthanal par l'enzyme
alcool déshydrogénase (ADH). L'éthanal est une substance très toxique, qui provoque des dégâts dans
l'ensemble de l'organisme. Il attaque les membranes cellulaires et cause des dommages indirects en
inhibant le système des enzymes. Dans un deuxième temps, l'éthanal est métabolisé par l'enzyme
acétaldéhyde déshydrogénase (ALDH).
www.sfa-ispa.ch
Alcool pur : Ethanol : C2H6O
Enzyme ADH
Ethanal C2H4O
Dégradation ultérieure...
Synthèse du cholestérol
Transmittance (en%)
Nombre d’onde (en cm-1)

4
Document 2b : Spectroscopie Infrarouge en phase liquide. Spectre IR2
http://www.sciences-edu.net
Document 2c : Table de données pour la spectroscopie IR
Liaison
C - C
C - O
C = O (carbonyle)
C - H
O - H
Nombre d'onde
(cm-1)
1000-1250
1050-1450
1650-1740
2800-3000
3200-3700
Document 3 : Spectre de RMN de l'éthanol
Remarque : On considère que l’atome d’hydrogène lié à l’atome d’oxygène ne possède pas de voisin.
Transmittance (en%)
Nombre d’onde (en cm-1)

5
1.1. Le document 1 évoque les molécules d'éthanol et d'éthanal : représenter en formule semi-développée ces
deux molécules et encadrer leurs fonctions caractéristiques.
1.2. Quel est le nom du groupe fonctionnel porté par l'éthanol ? À quelle famille appartient cette molécule ?
1.3. Quel est le nom du groupe fonctionnel porté par l'éthanal ? À quelle famille appartient cette molécule ?
1.4. En utilisant les données spectroscopiques du document 2, associer chaque spectre infrarouge (IR) à la
molécule correspondante en justifiant correctement.
1.5. Le document 3 présente le spectre RMN de l'éthanol. En utilisant la courbe d'intégration, calculer les
rapports h1 / h2 et h3 / h2.
1.6. Utiliser les rapports calculés pour associer aux trois massifs du spectre, les groupes de protons équivalents
de l'éthanol.
1.7. Le massif de pics situé au déplacement chimique 1,25 ppm se présente sous la forme d'un triplet. Justifier
cette multiplicité.
2. Contrôle de qualité d'un vin : dosage par spectrophotométrie de l'éthanol.
On peut lire dans le code de la santé publique depuis juin 2000 : catégorie Vins doux : vins, apéritifs à base de vin
ne titrant pas plus de 18 degrés.
On se propose de vérifier en laboratoire si un vin obéit à cette législation.
Définition : Le titre alcoométrique, exprimé en degré, est égal au nombre de litres d'éthanol contenus dans 100
litres de vin.
Données : M(éthanol) = 46,0 g.mol -1 µ(éthanol) = 0,78 g.mL -1
Afin de procéder au contrôle, on réalise le titrage par spectrophotométrie du vin en suivant le protocole suivant :
Première étape : On recueille l'éthanol du vin par distillation.
Deuxième étape : L'éthanol est oxydé par la NAD+ dans une réaction catalysée par une enzyme spécifique
similaire à celle évoquée dans la partie Il. La réaction produit de la nicotinamide-adénine-dinucléotide réduite
(NADH) en quantité de matière égale à celle de l'éthanol dosé selon l'équation :
Ethanol + NAD + Ethanal + NADH + H+
Troisième étape : La NADH absorbant dans le domaine UV, on mesure son absorbance par spectrophotométrie.
L'étalonnage du spectrophotomètre avec différentes solutions d'éthanol permet de vérifier la loi de Beer-Lambert :
A = k.Cm avec k = 1,6x10–3 L.mg -1 et Cm la concentration massique d'éthanol dans l'échantillon.
Réalisation de la mesure :
On distille 10 mL de vin ; le distillat est ensuite ajusté à 100 mL avec de l'eau distillée pour obtenir une solution
appelée S.
On prépare l'échantillon à doser par spectrophotométrie en introduisant dans une fiole jaugée de 100 mL :
1 mL de solution S, on ajoute le catalyseur puis NAD + en excès. On complète avec de l'eau distillée.
L'absorbance mesurée pour cet échantillon vaut : Ae = 0,15.
2.1. Déterminer à partir de l'absorbance mesurée Ae, la concentration massique Cm en éthanol de l'échantillon
étudié.
2.2. En tenant compte des deux dilutions successives, calculer les concentrations massiques en éthanol
suivantes :
3.2.1 CS dans la solution S.
3.2.2. CV dans le vin.
2.3. Quelle est la valeur du titre alcoométrique exprimé en degrés du vin ?
2.4. Ce vin est-il conforme au code de la santé publique ?
 6
6
 7
7
 8
8
 9
9
1
/
9
100%