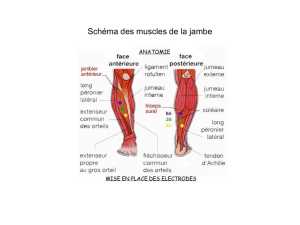
Imagerie TDM et IRM en ophtalmo-pédiatrie

Imagerie TDM et IRM
en ophtalmo-pédiatrie
Mehdi MEJDOUBI
Radiologue
Ancien Chef de Clinique-Assistant des Hôpitaux
Annick SEVELY
Radiologue
Praticien Hospitalier
Jean-Louis ARNE
Ophtalmologue
Professeur des Universités-Praticien Hospitalier

1
I
I
IM
M
MA
A
AG
G
GE
E
ER
R
RI
I
IE
E
ET
T
TD
D
DM
M
ME
E
ET
T
TI
I
IR
R
RM
M
M
E
E
EN
N
NO
O
OP
P
PH
H
HT
T
TA
A
AL
L
LM
M
MO
O
O-
-
-P
P
PE
E
ED
D
DI
I
IA
A
AT
T
TR
R
RI
I
IE
E
E
M
M
Me
e
eh
h
hd
d
di
i
iM
M
ME
E
EJ
J
JD
D
DO
O
OU
U
UB
B
BI
I
I
A
A
An
n
nn
n
ni
i
ic
c
ck
k
kS
S
SE
E
EV
V
VE
E
EL
L
LY
Y
Y,
,
,J
J
Je
e
ea
a
an
n
n-
-
-L
L
Lo
o
ou
u
ui
i
is
s
sA
A
AR
R
RN
N
NE
E
E
M
M
Me
e
eh
h
hd
d
di
i
iM
M
ME
E
EJ
J
JD
D
DO
O
OU
U
UB
B
BI
I
I
R
R
Ra
a
ad
d
di
i
io
o
ol
l
lo
o
og
g
gu
u
ue
e
e
A
A
An
n
nc
c
ci
i
ie
e
en
n
nC
C
Ch
h
he
e
ef
f
fd
d
de
e
eC
C
Cl
l
li
i
in
n
ni
i
iq
q
qu
u
ue
e
e-
-
-A
A
As
s
ss
s
si
i
is
s
st
t
ta
a
an
n
nt
t
td
d
de
e
es
s
sH
H
Hô
ô
ôp
p
pi
i
it
t
ta
a
au
u
ux
x
x
A
A
An
n
nn
n
ni
i
ic
c
ck
k
kS
S
SE
E
EV
V
VE
E
EL
L
LY
Y
Y
R
R
Ra
a
ad
d
di
i
io
o
ol
l
lo
o
og
g
gu
u
ue
e
e
P
P
Pr
r
ra
a
at
t
ti
i
ic
c
ci
i
ie
e
en
n
nH
H
Ho
o
os
s
sp
p
pi
i
it
t
ta
a
al
l
li
i
ie
e
er
r
r
J
J
Je
e
ea
a
an
n
n-
-
-L
L
Lo
o
ou
u
ui
i
is
s
sA
A
AR
R
RN
N
NE
E
E
O
O
Op
p
ph
h
ht
t
ta
a
al
l
lm
m
mo
o
ol
l
lo
o
og
g
gu
u
ue
e
e
P
P
Pr
r
ro
o
of
f
fe
e
es
s
ss
s
se
e
eu
u
ur
r
rd
d
de
e
es
s
sU
U
Un
n
ni
i
iv
v
ve
e
er
r
rs
s
si
i
it
t
té
é
és
s
s-
-
-P
P
Pr
r
ra
a
at
t
ti
i
ic
c
ci
i
ie
e
en
n
nH
H
Ho
o
os
s
sp
p
pi
i
it
t
ta
a
al
l
li
i
ie
e
er
r
r

2

3
SOMMAIRE
SOMMAIRE
En vue de l’actualisation de cet ouvrage, toute remarque, suggestion ou image est la
bienvenue ; vous pouvez l’envoyer à l’adresse suivante : [email protected]
TECHNIQUES D’IMAGERIE page 5
•Echographie
•TDM
•IRM (dont IRM fœtale)
RADIOANATOMIE NORMALE page 11
RAPPEL EMBRYOLOGIQUE page 17
MALFORMATIONS CONGENITALES page 21
•Microphtalmie - Anophtalmie - Hypoplasie du nerf optique
•Colobome
•Morning Glory syndrome
•Dysplasie septo-optique (syndrome de De Morsier)
•Syndrome de Peters et dysplasies du segment antérieur
•Fentes orbito-facio-crâniennes, craniosténoses
PATHOLOGIE TUMORALE page 35
Maligne
•Rétinoblastome
•Rhabdomyosarcome
•Métastases
Bénigne
•Inclusions ectodermiques (kyste dermoïde, kyste épidermoïde)
•Tumeurs neurogènes (neurofibrome, neurofibrome plexiforme, schwannome)
•Gliome des voies optiques
•Dacryocystocèle
•Histiocytose X
•Tératome
•Phacome

4
Lésions de voisinage
•Mucocèle
•Esthésioneuroblastome
•Lésions hypophysaires (craniopharyngiome)
PATHOLOGIE RETINIENNE NON TUMORALE page 57
•Persistance hyperplasique du vitré primitif (PHVP)
•Maladie de Coats
•Rétinopathie des prématurés
PATHOLOGIE INFLAMMATOIRE page 63
Infections orbitaires
•Bactériennes
•Parasitoses (kyste hydatique, toxocarose)
•Tuberculose
Pseudotumeur inflammatoire idiopathique (PTII)
Névrite optique
PATHOLOGIE VASCULAIRE page 73
•Hémangiome capillaire
•Malformations veineuses et capillaro-veineuses
•Malformation capillaire
•Malformations artérielles
•Lymphangiome kystique
PATHOLOGIE TRAUMATIQUE page 79
•Lésions du globe
•Corps étranger intra-orbitaire
•Fractures de l’orbite
DIVERS page 85
•Dysplasie fibreuse
•Drusens
•Pathologie du cristallin (cataracte, ectopie)
ORIENTATIONS DIAGNOSTIQUES page 93
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
1
/
100
100%