INTRODUCTION

1
INTRODUCTION
Le terme "embryologie" signifie l'étude de la formation et du développement des êtres vivants.
Toutefois, il est rare d'employer le terme dans le cas des êtres unicellulaires, même si ceux-ci
peuvent passer par différents stades durant leur vie. On parle plutôt de cycle cellulaire ou
cycle vital. L'embryologie suppose l'étude du développement d'êtres pluricellulaires, résultant
de la reproduction sexuée de leurs parents. Néanmoins, les eukaryotes multicellulaires ont
évolué à partir de protozoaires unicellulaires et c'est chez eux que sont apparus les caractères
de base du développement.
Le sexe et la reproduction sont deux processus distincts et qui peuvent être séparés:
la reproduction consiste en la création de nouveaux individus;
le sexe consiste en la combinaison de gènes de deux individus différents en un nouvel
arrangement.
La reproduction en l'absence de sexe est fréquente chez les unicellulaires, chez qui se
confondent reproduction et division cellulaire. Le mécanisme de la mitose équationnelle
assure en principe la transmission conforme de l'information génétique, les nouveaux
individus étant identiques à leurs prédécesseurs. Certains organismes pluricellulaires se
reproduisent également par un simple processus de mitoses successives suivies d'une
fragmentention de l'organisme parental, le fragment détaché du parent constituant le nouvel
individu: il s'agit du bouturage chez les plantes, du bourgeonnement ou de la scissiparité chez
les animaux. Dans la reproduction non sexuée il n'y a pas de brassage de gènes.
Le sexe sans la reproduction se retrouve communément chez les unicellulaires. Les bactéries
transfèrent des gènes d'un individu à l'autre par des piliers sexuels sans qu'il y ait reproduction.
Les protozoaires en font de même par conjugaison. En permettant le brassage des caractères
héréditaires, la sexualisation a introduit la notion de variation dans l'espèce, favorisant ainsi
les phénomènes d'évolution.
L'union des deux processus distincts, sexe et reproduction, en reproduction sexuée se
rencontre pour la première fois chez certains eukaryotes unicellulaires, tel Chlamydomonas.
Les individus sont morphologiquement identiques (pas de mâles et de femelles) et haploïdes.
Quand deux individus se rencontrent, disons un + et un -, ils joignent leurs cytoplasmes et
leurs noyaux pour former un zygote diploïde, seul stade diploïde du cycle cellulaire. Le
zygote subit une méiose pour former quatre nouvelles Chlamydomonas haploïdes. Il s'agit

2
d'une reproduction, car plusieurs nouveaux individus sont formés, sexuée, car il y a
réarrangement des chromosomes lors de la méiose.
Dans ces premières tentatives de reproduction sexuée chez des unicellulaires, deux
avancements ont été accomplis:
- la méiose: le complément diploïde des chromosomes est réduit à l'état haploïde

3
- la formation d'un tube de fertilisation, grâce à la polymérisation de la protéine actine,
mécanisme qui permettra la reconnaissance et la fusion du spermatozoïde et de l'oeuf chez les
pluricellulaires sexués.
Les organismes pluricellulaires ont pour la plupart adopté la voie de la reproduction sexuée.
Ils se constituent à partir d'une cellule diploïde initiale, le zygote, par une succession de
mitoses équationnelles. Ce processus conduit à l'établissement d'une communauté formée,
d'une part, d'un grand nombre de cellules diploïdes qui sont spécialisées morphologiquement
et fonctionnellement: la lignée somatique, et, d'autre part, d'un autre type cellulaire diploïde
qui évolue de façon particulière: la lignée germinale. Au terme de leur évolution, les cellules
de la lignée germinale entreprennent la méiose et donnent naissance à des cellules haploïdes
spécialisées en vue de la reproduction: les gamètes. L'union des gamètes mâle et femelle, la
fécondation, conduit à la formation du zygote diploïde, qui est à l'origine d'un nouvel
organisme.

4
Le cycle vital des métazoaires comprend trois phases principales:
phase progressive: qui elle-même comprend trois étapes importantes:
- pro-ontogenèse ou progenèse: qui inclut
- gamétogenèse: formation des gamètes: soit spermatogenèse soit ovogenèse
- fécondation: union des gamètes mâle et femelle donnant le zygote.
- embryogenèse: le développement embryonnaire comme tel, qui comprend:
- segmentation: série de mitoses qui résulte en la formation de la blastula
- gastrulation: mouvements morphogénétiques des cellules de la blastula (blastomères)
résultant en l'établissement des trois feuillets fondamentaux: endoderme, ectoderme,
mésoderme.
- organogenèse: division, réorganisation et migration des cellules des trois feuillets pour
former les organes. La plupart des organes contiennent des cellules provenant de plus d'un
feuillet.
- croissance: période davantage caractérisée par une augmentation volumétrique des
composantes de l'animal (et de l'animal entier) que par la formation de nouvelles structures.
Dans cette période s'accomplit aussi la maturation des fonctions.
phase adulte: arrêt général de la croissance, maintien de l'organisme
phase sénile: vieillissement de l'organisme, dégénérescence et mort éventuelle.

5
GAMETOGENESE (cours 1)
Gamétogenèse: différenciation des cellules germinales ou reproductrices, les gamètes.
L'isogamie est la condition selon laquelle les gamètes des deux sexes sont semblables. Mais
chez la plupart des espèces, les deux types de gamètes sont morphologiquement différents; il
s'agit d'anisogamie ou hétérogamie:
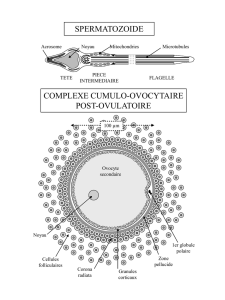
gamète mâle: spermatozoïde
gamète femelle: oeuf
La gamétogenèse prend le nom de spermatogenèse ou d'ovogenèse, selon le sexe. Elle se
produit dans des organes spécialisés, les gonades: gonade mâle: testicule
gonade femelle: ovaire
Les gonades des Vertébrés jouent aussi un rôle endocrinien en renfermant dans leur tissu des
cellules endocrines, d'où le terme de glandes génitales.
Chez les espèces dites gonochoriques, spermatogenèse et ovogenèse se déroulent chez des
individus différents. C'est le cas de la plupart des Vertébrés, sauf certains poissons et reptiles.
Le sexe des individus gonochoriques est déterminé génétiquement dès la fécondation par la
nature des chromosomes sexuels, symbolisés par X et Y chez les mammifères et Z et W chez
les oiseaux.
- L'un des sexes est homogamétique et ne forme qu'une catégorie de gamètes: la femelle (XX)
chez les mammifères et le mâle (ZZ) chez les oiseaux.
- L'autre sexe est hétérogamétique et forme deux catégories de gamètes différents par la
nature d'un chromosome sexuel: le mâle (XY) chez les mammifères et la femelle (ZW) chez
les oiseaux.
Chez les espèces dites hermaphrodites, un même individu porte les gonades mâle et femelle,
comme on le rencontre fréquemment chez les Invertébrés.
- Hermaphrodite spontané: un même individu peut avoir simultanément des activités mâle et
femelle, et la fécondation entre partenaires est réciproque. Ex. ver de terre, escargot.
- Hermaphrodite successif: un même individu est successivement à activité mâle puis femelle.
Ex. certains mollusques.
La différenciation des gamètes présente une certaine uniformité dans le règne animal. Ainsi
peut on décrire des stades communs à la spermatogenèse et à l'ovogenèse de toute espèce.
1- phase de multiplication: la gamétogenèse commence par une phase de multiplication
pendant laquelle les cellules germinales diploïdes, spermatogonies et ovogonies, se divisent
par mitoses et augmentent leur nombre.
2- phase d'accroissement: les gonies cessent de se diviser par mitoses et prennent le nom
d'auxocytes primaires: spermatocytes I et ovocytes I; leur volume augmente par
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
1
/
51
100%