Cancers de l`anus

Cancers de l’anus
J. Girodet
INTRODUCTION
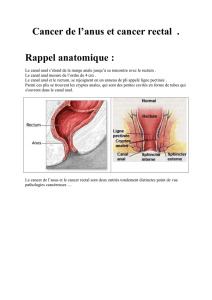
L’anus est la partie terminale du tube digestif
faisant suite au rectum. Le canal anal s’étend de la
limite supérieure à la limite inférieure du sphincter
interne, depuis le rectum jusqu’à la peau périnéale.
Il est revêtu successivement par trois types
d’épithéliums :
– un épithélium cylindrique transitionnel (éga-
lement appelé épithélium cloacogénique, car situé
au niveau de l’ancienne membrane cloacale qui
sépare durant l’embryogenèse l’endoderme de l’ec-
toderme) qui va remplacer la muqueuse glandulaire
rectale. L’étendue de cette zone varie de 6 à
15 mm. Les cancers qui en sont issus sont des can-
cers épidermoïdes d’un type histologique particu-
lier appelé « cancer épidermoïde cloacogénique ou
transitionnel » (parfois aussi appelé « cancer basa-
loïde » en raison de l’agencement particulier des
cellules tumorales sur coupes histologiques).
Considérés longtemps comme étant d’un pronostic
plus péjoratif que le cancer épidermoïde du canal
anal, ces tumeurs ont un comportement analogue
et doivent donc être traitées de la même façon (1);
– un épithélium malpighien non kératinisé va
ensuite tapisser le canal anal en aval sur environ
2,5 cm. Il va être le point de départ du cancer le plus
fréquent : le cancer épidermoïde du canal anal;
– enfin, encore plus en aval, un épithélium mal-
pighien kératinisé associé aux structures cutanées
habituelles, follicule pileux, glandes sudoripares…,
fait la transition avec la peau au niveau de la ligne
anocutanée. Cette région, appelée « marge anale »,
arbitrairement étendue jusqu’à 5 cm en deçà de
l’anus est le siège de tumeurs d’origine cutanée
(tableau I).
Au sein du canal anal, situées dans les plans
profonds, les glandes anales (glandes de Hermann
et Desfosses) dont l’abouchement se situe au
niveau des cryptes, entre les colonnes de Morgagni,
vont donner des adénocarcinomes se présentant
essentiellement comme un cancer colloïde très
muco-sécrétant (cancer colloïde muqueux).
Le traitement du cancer du canal anal poursuit un objectif double : non seulement guérir mais
aussi préserver la fonction sphinctérienne. Le traitement de référence du cancer du canal anal
repose sur une radiothérapie exclusive (T1 et T2) ou sur une association radiothérapie et
chimiothérapie (T3 et T4). Les récidives locorégionales surviennent plus de huit fois sur dix
dans les deux premières années qui suivent la fin du traitement. Plus de la moitié des personnes
traitées d’un cancer du canal anal sont en vie après dix ans de suivi.
Cancers épidermoïde carcinomes habituellement diffé
renciés et kératinisants
Mélanomes malins également présents dans le canal
anal lui-même
Condylomes malins infection virale
Tumeur de Buschke- pathologie tumorale d’origine
Loewenstei virale à développement loco-
régional
Cancer verruqueux forme rare de cancer épidermoïde
très bien différencié
Maladie de Bowen prolifération malpighienne intra-
épithéliale
Maladie de Paget prolifération dans l’épithélium
de la marge anale de cellules
glandulaires muco-sécrétantes
Lymphome malin exceptionnel en dehors du SIDA
Tableau I – Principales lésions néoplasiques malignes de
la marge anale.

440 Pelvi-périnéologie
CANCER DU CANAL ANAL (CCA)
Les tumeurs de l’anus sont des tumeurs rares (2).
Le carcinome épidermoïde du canal est de loin le
cancer de l’anus le plus fréquent. Il ne représente
cependant que 3 % des tumeurs de la région
anorectale. Son incidence était analogue en
Europe et dans les pays anglo-saxons et notam-
ment nord-américains. Elle était de l’ordre de
1/100 000 chez la femme et seulement de
0,3/100 000 chez l’homme. Il s’agissait donc
d’un cancer essentiellement féminin et qui sur-
vient habituellement au cours de la 6edécade.
Depuis une dizaine d’années, on voit appa-
raître, en plus de la population classique de
femmes âgées, une population masculine beau-
coup plus jeune d’homosexuels où le cancer du
canal anal paraît 10 fois plus fréquent et plus par-
ticulièrement chez les sujets séropositifs pour le
HIV (Human Immuno deficiency Virus). Dans
cette population à risque, l’incidence du cancer
du canal anal atteint 37/100 000 (3, 4, 5). Cette
augmentation serait en grande partie expliquée
par l’incidence accrue des infections par les virus
du papillome humain (HPV : Human Papilloma
Virus). Les infection ano-périnéales à HPV sont
majoritairement sexuellement transmissibles.
Comme dans le cancer du col utérin chez la
femme, certains types de HPV, notamment les
types 16 et 18, ont un pouvoir oncogène. La
coïnfection par le HIV intervient par le biais
d’une immunodépression systémique (6). Une
équipe américaine vient de publier des résultats
prometteurs sur l’efficacité d’un vaccin expéri-
mental contre le HPV de type 16 chez la femme
où ce type de virus est présent dans plus de 50 %
des cas de cancer du col (7). Si ces résultats se
confirment, on devrait également s’attendre à une
diminution de la fréquence des cancers du canal
anal chez la femme dans quelques décennies et
l’on pourrait alors étendre le bénéfice de cette
vaccination à d’autres groupes à risque et plus
particulièrement les homosexuels masculins.
Présentation clinique
La symptomatologie clinique du CCA est parfai-
tement non spécifique ce qui va souvent expliquer
sa banalisation par le patient et va conduire à d’im-
portants retards de diagnostic.
Le délai entre l’apparition des premiers symp-
tômes et le diagnostic est donc souvent long :
dans notre expérience, 60 % de patients n’ont
consulté que six mois après l’apparition des pre-
miers signes (8).
Les rectorragies sont le symptôme le plus fré-
quent présent chez 30 % des patients puis vien-
nent les douleurs chez 14 %, les troubles du
transit chez 10 %, la tumeur elle-même est palpée
par 17 % des patients, chez 30 % d’entre eux
plusieurs symptômes sont associés.
L’aspect macroscopique peut prendre plusieurs
aspect lésionnels résumés dans le tableau II.
Bourgeonnement Plus ou moins volumineux, par
extériorisé fois ulcéré
Fissuration anale Souvent à larges bords surélevés
pouvant présenter un bourgeonne
ment irrégulier dans le fond de la
fissure. Cette fissure peut siéger
aussi bien au pôle postérieur et
antérieur que sur toute la circonfé-
rence de l’anus
Lésion infiltrée Purement endocanalaire perçue au
toucher rectal et confirmé à l’anu-
scopie
Tableau II – Principaux aspects macroscopiques du car-
cinome épidermoïde du canal anal.
La caractéristique commune à toutes ces
lésions est leur induration nettement perçue au
toucher qui doit impérativement faire suspecter le
diagnostic de cancer.
La confirmation de ce diagnostic doit être
obtenue par une biopsie, le plus souvent facile à
réaliser, éventuellement en ayant recours à une
anesthésie locale. Cependant certaines tumeurs,
surtout de type fissuraire et endocanalaire, peu-
vent être très douloureuses à l’examen ce qui
peut amener à réaliser une courte anesthésie
générale permettant un meilleur bilan local et la
réalisation des prélèvements.
Certains CCA peuvent se présenter sous des
aspects trompeurs de lésions a priori bénignes :
condylome fibreux, fissure d’allure banale,
condylomes et même hémorroïdes dont la surface
peut paraître non seulement un peu irrégulière,
mais aussi tout à fait normale (9). Il est donc
impératif de confier à l’anatomopathologiste
toute lésion anale qui fait l’objet d’une exérèse
chirurgicale et de biopsier toute lésion indurée ou
d’évolution chronique.

L’examen clinique à l’œil, au doigt, aidé par
l’anuscope, le rectoscope et éventuellement le
sigmoïdoscope permet d’apprécier :
– le volume de la tumeur;
– le siège de la lésion : canal anal seul ou pou-
vant « déborder » sur la marge anale vers le bas ou
– le rectum vers le haut;
– l’importance de l’envahissement circonfé-
rentiel ;
– son infiltration en profondeur;
– chez la femme, dans les lésions antérieures,
la présence éventuelle d’une fistule recto-vagi-
nale.
L’extension ganglionnaire doit s’apprécier
d’abord cliniquement :
– lors du toucher rectal en recherchant un
cordon induré s’étendant vers le haut, et la pré-
sence d’adénopathies pararectales.
La palpation des creux inguinaux peut révéler
des adénopathies dont le caractère métastatique
doit être confirmé par ponction cytologique ou
par biopsie.
Au moment du diagnostic des métastases gan-
glionnaires sont présentes non seulement dans le
pelvis chez environ 30 % des patients, mais aussi
au niveau des creux inguinaux chez 15 à 20 %
d’entre eux, 80 % de ces métastases n’étant
qu’unilatérales (10-12).
Le cancer du canal anal est une maladie loco-
régionale, l’extension métastatique n’excédant
pas 10 % lors de la présentation initiale et n’étant
habituellement le fait que des grosses tumeurs.
Au terme de ce bilan clinique une classifica-
tion est établie. Actuellement le mode de classe-
ment le plus utilisé est le système TNM UICC de
1987 (tableau III).
Examens complémentaires
L’échoendoscopie en est l’examen de référence.
Il précise l’extension de la tumeur vers les
sphincters interne puis externe. C’est le meilleur
examen pour évaluer l’atteinte ganglionnaire
périrectale. Certains ont proposé une classifica-
tion complémentaire de la classification TNM de
l’UICC (13, 14) résumée dans le tableau IV.
Cancers de l’anus 441
T1 ≤2 cm
T2 > 2-5 cm
T3 >5cm
T4 Envahissement aux organes adjacents
(vagin, urètre, vessie)
N1 Adénomégalies périrectales
N2 Adénomégalies inguinales, iliaques internes
N3 Adénomégalies périrectales et inguinales
Adénomégalies iliaques internes ou
Inguinales bilatérales
M Métastases à distance
Tableau III – Classification clinique des cancers du
canal anal (TNM UICC).
us T1 : Atteinte de la muqueuse et sous-muqueuse sans
infiltration de sphincter interne
us T2 : Atteinte du sphincter interne avec respect du
sphincter externe
us T3 : Atteinte du sphincter externe
us T4 : Atteinte d’un organe de voisinage
N 0 Pas d’adénopathie suspecte périrectale
N + Adénopathie(s) périrectale(s) ayant des critères
échoendoscopiques de ganglion malin (rond,
hypoéchogène, contours nets)
Tableau IV – Classification US (Ultra Sound) des can-
cers de l’anus.
Le scanner abdomino-pelvien n’est pas très
performant dans l’évaluation des lésions ano-rec-
tales, mais il peut être utile dans l’étude des gan-
glions iliaques et lombo-aortiques. Il permet de
mettre en évidence des lésions hépatiques dans
les cancers volumineux et sera alors complété
d’une radiographie du thorax.
Les marqueurs sanguins ne sont pas très spé-
cifiques. Le SCC (Squamous Cell Carcinoma) a
été employé. Il est d’une sensibilité limitée, sa
spécificité est meilleure, mais il ne peut en aucun
cas être un élément diagnostique ou pronostique.
Lorsqu’il est élevé à la phase initiale de la
maladie, il peut être utile comme élément de sur-
veillance.
Examen anatomopathologique
Le cancer du canal anal est un carcinome épi-
dermoïde. On classe sa dédifférenciation en trois
stades selon le degré de kératinisation. Ces dis-
tinctions n’ont pas de valeur pronostique dans les
études multivariées. Les cancers cloacogéniques
n’en sont différents que par leur aspect histolo-
gique. Ils représentent 10 à 20 % des cancers du
canal anal. Certaines études avaient voulu leur
attribuer une valeur pronostique péjorative, mais

d’une part cette valeur n’est pas retrouvée par
tous les auteurs et n’a pas de valeur pronostique
significative en analyse multivariée lorsque le
stade TNM est pris en compte (1).
Traitement
Maladie essentiellement locorégionale dans la
majorité des cas, le traitement poursuit deux
objectifs : guérir les patients et conserver la fonc-
tion sphinctérienne.
Irradiation
C’est le traitement de référence. Elle va stériliser
les lésions et tenter de préserver un sphincter
fonctionnel. Elle est utilisée chez tous les patients
sauf en cas d’irradiation pelvienne antérieure
(cancer du col utérin, par exemple), d’incapacité
à subir les séances quotidiennes d’irradiation et
en cas de refus. Cette irradiation est en règle
isolée pour les tumeurs T1 et T2 et associée à une
chimiothérapie pour les tumeurs T3 et T4 (15).
Les techniques d’irradiation varient peu d’un
centre à l’autre aussi bien quant au protocole lui-
même d’irradiation, qu’en ce qui concerne les
appareillages utilisés. À l’Institut Curie, depuis de
très nombreuses années, le protocole habituel
d’irradiation consiste d’abord en une irradiation
externe pelvienne initialement délivrée au téléco-
balt 60, actuellement fournie par des énergies de 16
ou 25 MeV en photons par accélérateur linéaire
(16). Cette technique irradie d’une part la tumeur
primitive : la dose délivrée est de 40 à 45 Gy à
raison de quatre à cinq jours de traitement par
semaine, comportant donc une dose de 2 à 2,5 Gy
par séance. La limite supérieure du champ est en
règle le plan de L5-S1, mais d’autre part irradie
aussi les territoires ganglionnaires inguinaux
(40 Gy), même en l’absence d’adénopathie pal-
pable. Cette irradiation ganglionnaire systématique
n’est pas réalisée dans d’autres centres qui ne
l’effectuent qu’en cas de métastase ganglionnaire
prouvée (17). Après cette première séquence de
radiothérapie et après une pause de deux à six
semaines selon les réaction périnéales, une irradia-
tion complémentaire de surdosage est délivrée le
plus souvent par faisceau périnéal direct, parfois
par curiethérapie interstitielle en utilisant l’iri-
dium 92 pour obtenir une dose totale de 60 à 65 Gy
sur la tumeur.
Toutes les grandes séries publiées rapportent des
survies analogues de l’ordre de 70 % à cinq ans et
de 60 % à dix ans (2). Cette survie est liée à la taille
initiale de la tumeur, passant de plus de 70 % de
survie à trois ans pour les tumeurs classées T1, à
moins de 20 % pour les tumeurs classées T4 (12,
18).
La radiothérapie peut entraîner des effets
secondaires malgré une dosimétrie de plus en
plus précise (19). Ceux-ci se manifestent soit lors
de l’irradiation elle-même, ces complications pré-
coces surviennent dans plus de 20 % des cas mais
n’imposent que rarement l’arrêt provisoire du
traitement. Elles sont le plus souvent rapidement
régressives à l’arrêt du traitement. D’autres com-
plications peuvent apparaître plus tardivement
dans les semaines, les mois ou années qui suivent
l’arrêt de la radiothérapie constituant les véri-
tables complications de la radiothérapie (20, 21).
La curiethérapie interstitielle utilisée seule serait
responsable d’un taux de nécrose locale plus
important que la radiothérapie externe.
442 Pelvi-périnéologie
Grade I survenant dans Compatible avec une vie
20 à 30 % des cas normale marquée par des
rectorragies occasionnelles, une
fibrose périanale pas ou peu dou-
loureuse, un rétrécissement modéré
du canal anal, un œdème modéré
de la vulve ou prurit
Grade II chez moins Déterminée par l’existence d’une
de 15 % des patients incontinence modérée principale-
ment aux gaz, une nécrose cica-
trisant sous traitement médical, des
modifications du transit intes-
tinal, une fibrose du canal anal, un
œdème marqué de la vulve ou des
membres inférieurs
Grade III chez Lésions sévères et invalidantes pou-
5 à 10 % des patients vant conduire un acte chirurgical qui
sera le plus souvent une stomie de
dérivation du fait d’une nécrose
sévère, d’une sténose ou d’une
incontinence anale, d’une fistule
recto-vaginale
Tableau V – Quantification des lésions radiques induites.
Les complications tardives sont classées en
3 grades de gravité (tableau V).
Chimiothérapie
Cette approche thérapeutique a été initiée par
Nigro qui employait du 5FU et de la mitomycine
avant la radiothérapie (22). De nombreux proto-
coles se sont développés conjointement avec la
radiothérapie, fondés sur l’association de 5FU et

de mitomycine, cette dernière drogue étant
actuellement remplacée par le cisplatine moins
hématotoxique. La plupart des équipes réalisent
une véritable association radiothérapie plus chi-
miothérapie, en donnant un premier cycle en
début d’irradiation, un deuxième trois à quatre
semaines plus tard, complétés éventuellement par
1 à 3 cycles au décours de l’irradiation.
Chirurgie
Le traitement chirurgical de première intention a
surtout été proposé par les auteurs anglo-saxons
qui l’ont cependant abandonné au profit des asso-
ciations radiothérapies plus chimiothérapies (23).
L’intervention réalisée le plus souvent est une
amputation abdomino-périnéale (AAP) avec une
exérèse large ganglionnaire pelvienne. Si les
résultats, en terme de survie sont comparables,
les taux de récidives sont beaucoup plus élevés
(de l’ordre de 30 %) (24).
Les principales indications de la chirurgie du
cancer du canal anal sont rapportées dans le
tableau VI.
Un geste chirurgical d’exérèse est également
nécessaire en cas de récidive locale. Dans notre
série, comme pour d’autres auteurs, cette éven-
tualité est rencontrée chez 25 % de patients. Chez
deux tiers d’entre eux une AAP est réalisable,
alors que pour l’autre tiers l’exérèse des lésions
n’est pas possible et conduit à une simple colo-
stomie palliative. Chez les malades qui ont pu
subir une intervention d’exérèse cette chirurgie de
rattrapage donne une survie de 50 % à cinq ans
ce qui justifie la réalisation de ces interventions
(26, 27). La durée de cicatrisation du périnée
après AAP de rattrapage est significativement
plus longue (plus de trois mois pour la moitié
des patients) et est considérablement améliorée
par la réalisation, au niveau de la brèche péri-
néale, d’une épiplooplastie, d’un lambeau myo-
cutané de grand droit de l’abdomen, mais n’est
pas toujours réalisable pour des raisons anato-
miques surtout chez les personnes âgées.
Surveillance
Quel que soit le mode de traitement initial, plus
de 80 % des récidives locorégionales et des méta-
stases viscérales vont apparaître dans les deux
ans qui suivent le traitement. Pendant cette
période la surveillance doit se faire tous les trois
mois (ou moins en cas de doute).
Cette surveillance est fondée essentiellement
sur l’examen clinique et sur l’échoendoscopie.
Le toucher rectal est souvent difficile, doulou-
reux (sur un canal anal qui a perdu sa souplesse,
porteur de brides fibreuses) et souvent hémorra-
gique. La découverte d’une anomalie doit être
évaluée avec prudence, corrélée aux données
échoendoscopiques et ce n’est que devant un
aspect tumoral net ou une modification clinique
patente que des biopsies pourront être réalisées
soit directement sur une lésion visible, soit par
ponction écho-guidée. En effet, sur les tissus irra-
diés, la biopsie expose au risque majeur de
nécrose. Ce n’est donc que si l’AAP est prévue
que la biopsie est possible sans danger fonc-
tionnel.
En ce qui concerne les creux inguinaux, la sur-
veillance clinique est souvent difficile, le recours
à l’échographie peu utile. La ponction cytolo-
gique prend ici toute sa valeur (28, 29).
Une radiographie du thorax et un scanner ou
une échographie abdominale sont réalisés tous
les six mois à la recherche de métastases à dis-
tance. Les métastases viscérales, aussi bien au
Cancers de l’anus 443
Petites lésions de Complétées par une curiethérapie
moins de 2 cm
Stomie de dérivation Proposée en début de traitement
transitoire en cas de destruction sphincté
rienne ou en cas de fistule recto-
vaginale. ou en cas de complica-
tions radiques sévères
Amputation En cas de réponse insuffisante à
abdominopérinéale la première phase de radiothé-
rapie (moins de 50 % de réponse)
laissant présumer d’un mauvais
contrôle tumoral avec un risque
de récidive précoce quasi certain
Amputation En cas de récidive locale
abdominopérinéale
ou colostomie
définitive palliative
Tableau VI – Principales indications actuelles de la chi-
rurgie du cancer du canal anal.
Dans notre expérience à l’Institut Curie, une
réponse insuffisante nous a amenés à réaliser une
AAP chez 14 % des patients. Cette association
radio-chirurgicale a été plus souvent nécessaire
pour les grosses tumeurs : 31 % chez les T4
contre 2 % chez les T1 (25). Aucune décision ne
doit cependant être prise a priori, car 5 % des T4
ont pu bénéficier d’une irradiation exclusive.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%