QDND N°38 - Maladie de Lyme et infections transmissibles par les

INTRODUCTION
De par leur répartition et leur comportement, les tiques sont capables
de transmettre de nombreuses maladies humaines et animales,
bactériennes, virales ou parasitaires. Sept maladies transmissibles par
les tiques ont une importance épidémiologiques en France : cinq sont
bactériennes (Maladie de Lyme, Fièvre Boutonneuse Méditerranéenne,
Fièvre Q, Ehrlichiose et Tularémie), une parasitaire (Babésiose) et une
virale (Encéphalite Virale à Tiques).
Les différentes infections transmises par les tiques sont des zoonoses
faisant intervenir 3 protagonistes : le réservoir animal, le vecteur et
l’agent pathogène, l’homme n’étant qu’un hôte de rencontre accidentel.
Les tiques sont des ectoparasites hématophages stricts. Cette
hématophagie est à l’origine de la transmission de germes pathogènes.
Dans ce QDND, nous aborderons principalement la maladie de Lyme
et la fièvre boutonneuse méditerranéenne.
MALADIE DE LYME
La maladie de Lyme ou borréliose de Lyme est une maladie
bactérienne due à un spirochète du genre Borrelia. L’affection doit son
nom à la ville du Connecticut où elle a été reconnue pour la première
fois aux Etats-Unis en 1975.
Agent causal :
Récemment, grâce à des méthodes de biologie moléculaire, plusieurs
groupes de recherches ont indiqué la complexité antigénique de
Borrelia burgdorferi (B.b). Ces études ont conduit à la sub-division de
l’espèce initiale en 4 nouvelles espèces : B. burgdorferi stricto sensu, B.
garinii, B. Afzelii et B. japonica. Les 3 premières espèces sont
directement liées à la maladie de Lyme. La dernière, B. japonica,
présente essentiellement au Japon, ne semble pas intervenir dans
l’étiologie de la maladie.
L’intérêt de cette nouvelle classification fut démontré par des travaux
recherchant la ou les espèces responsables des différents symptômes.
En effet, il semble que l’espèce B. burgdorferi stricto sensu soit plutôt
responsable des manifestations rhumatologiques tandis que les
espèces B. garinii et B. afzelii provoqueraient respectivement de
manière prépondérante les manifestations neurologiques et
dermatologiques de la maladie de Lyme.
Ces 3 espèces co-habitent dans les bocages et les forêts de notre pays
et il a pu être montré la co-existence d’espèces différentes chez un
même patient.
Fréquence et groupes à risques :
La maladie de Lyme existe sur tous les continents mais prédomine
dans l’hémisphère nord. Elle peut être contractée dans toutes les
régions de France, avec probablement des zones à risque plus marqué
(les forêts de l’Aubrac par exemple).
En France, on observe plus de 1000 nouveaux cas de borrélioses
chaque année, ce qui permet de conclure à l’endémicité de la
borréliose dans notre pays.
Toutes les activités qui exposent à des contacts avec les tiques
constituent un facteur de risque : promenade en forêt, camping… ainsi
que travaux agricoles et forestiers, situations où elle est reconnue
comme maladie professionnelle.
Réservoir, transmission :
Le réservoir de germes est très vaste puisqu’il intéresse de
nombreuses espèces de mammifères (cervidés, bétails, petits
rongeurs, chiens,…), des oiseaux et enfin les tiques. Il semble que les
animaux puissent rester porteurs de Borrelia pendant de longues
périodes de leur vie sans manifestations cliniques. La transmission à
l’homme se fait très généralement par piqûre de tique du genre Ixodes
(Ixodes ricinus en Europe). Les tiques peuvent transmettre la maladie à
tous les stades de leur développement (larve, nymphe et adulte).
D’autres insectes ont été très rarement incriminés dans la transmission
(taons, certaines mouches…).
La contamination humaine se superpose à la période d’activité
maximale des tiques, fonction des conditions climatiques, et se fait
donc en France entre le début du printemps et la fin de l’automne.
Pathogénie :
Après inoculation de Borrelia au niveau de la peau à la suite de la
piqûre, la borréliose de Lyme évolue schématiquement en trois phases
comme la syphilis. La phase primaire s’exprime essentiellement par
une lésion cutanée s’étendant à partir du point d’inoculation : l’érythème
chronique migrant (ECM). Cette lésion qui n’est pas constante, peut
s’accompagner parfois de signes généraux et évolue spontanément et
favorablement dans un délai variable. A partir du point d’inoculation,
Borrelia peut aussi disséminer par voie hématogène et ensemencer
d’autres organes comme le cerveau, le cœur, les articulations,… qui
sont alors le siège de manifestations cliniques secondaires observées
quelques semaines après la contamination. Ces manifestations vont,
elles aussi, souvent régresser spontanément même en l’absence de
traitement. Ultérieurement des manifestations chroniques constituent la
phase tertiaire de la maladie qui apparaît en général après plusieurs
années.

Les tableaux réalisés sont en général liés à l’action directe du germe
notamment aux phases primaire et secondaire. La responsabilité d’un
processus immunologique associé est très probable en particulier lors
des phases secondaires tardives et de la phase tertiaire.
Cette distinction en trois phases est remise actuellement en question
pour ne retenir qu’une phase précoce et une phase tardive.
Clinique :
1.
Phase primaire
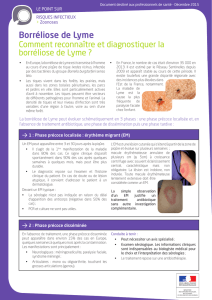
L’érythème chronique migrant (ECM) pathognomonique constitue la
manifestation clinique essentielle de cette phase. Il débute 3 à 30 jours
après l’inoculation de B.b., siège préférentiellement au niveau des
membres inférieurs (50% des cas), en particulier au creux poplité ou à
la partie haute de la cuisse. Il peut également siéger au niveau du
tronc, des membres supérieurs, du visage ou du cuir chevelu.
Il s’agit initialement d’une petite macule ou papule rouge modérément
inflammatoire, centrée sur le point de piqûre. La lésion va évoluer de
façon centrifuge, typique de l’ECM, pour atteindre un diamètre variable
pouvant atteindre 20 à 30 cm (voire plus). La lésion est ronde ou
ovalaire, présente une bordure périphérique active, plus érythémateuse
que le centre qui, peu à peu retrouve une teinte sensiblement normale.
L’ECM n’est pas prurigineux habituellement. Il peut être associé à une
adénopathie satellite et/ou des manifestations générales (fébricule,
céphalées, arthralgies) qui traduisent la dissémination septicémique
précoce du germe.
En l’absence de traitement, l’ECM persiste 3 à 4 semaines (parfois
plus), avant de pâlir et disparaître sans séquelle.
2.
Phase secondaire
Elle révèle parfois la maladie, l’ECM pouvant manquer ou être passé
inaperçu (30 à 50% des cas). Elle peut coexister avec l’ECM lorsque
celui-ci est d’évolution prolongée. Elle survient la plus souvent quelques
semaines à mois après la phase primaire.
Manifestations cutanées
Rares en France, plus fréquentes aux USA, il s’agit de lésions multiples
d’ECM, identiques à la lésion primaire à l’exception du point de piqûre
central qui est absent. Chacune de ces lésions évolue de façon
centrifuge, souvent associées à des manifestations générales.
Manifestations articulaires
Les arthralgies, précoces, sont fréquentes. Les arthrites sont de
survenue plus tardive et moins fréquente ; elles réalisent une mono- ou
une oligo-arthrite touchant surtout les grosses articulations en
particulier le genou. Le tableau est celui d’une arthrite aiguë typique,
évoluant par poussées brèves, séparées par des périodes de rémission
plus ou moins complètes. Ces poussées répétées d’arthrites peuvent
évoluer vers le tableau d’arthrite chronique de la phase tertiaire.
Manifestations cardiaques
L’atteinte cardiaque est soit une myocardite, soit une péricardite, les
deux pouvant être associées.
La myocardite s’exprime le plus souvent par des troubles de la
conduction, en particulier auriculo-ventriculaires, responsable d’un BAV
qui peut être complet. Tout trouble de la conduction au cours de la
maladie de Lyme impose l’hospitalisation. Dans d’autres cas, la
myocardite se traduit par des signes d’insuffisance cardiaque. Ces
atteintes cardiaques sont caractérisées par leur variabilité dans le
temps et par leur évolution habituelle vers la guérison sans séquelles.
Manifestations neurologiques
Les complications neurologiques de la borréliose de Lyme sont plus
fréquentes en Europe qu’aux Etats-Unis. Ces variations cliniques
observées entre les différentes zones géographiques seraient liées à la
variabilité dans la répartition des espèces de B. b. Ainsi, la
prédominance des manifestations neurologiques en Europe serait liée à
la présence de B. garinii dont le tropisme pour le tissu nerveux est plus
marqué.
Ces manifestations neurologiques peuvent être révélatrices de la
maladie et sont les suivantes :
-la méningo-radiculite sensitive
Elle débute en général dans le territoire de la piqûre de la tique. Elle
peut rester localisée à ce niveau ou s’étendre aux métamères
adjacents. Elle est responsable de douleurs très importantes,
notamment nocturnes, mal calmées par les antalgiques et les anti-
inflammatoires. L’examen clinique peut être normal ou objectiver une
hypoesthésie, une diminution de la force musculaire ou une abolition
des réflexes dans le territoire intéressé.
-les atteintes motrices périphériques isolées sont possibles mais
rares.
-l’atteinte des nerfs crâniens est fréquente. Tous les nerfs peuvent
être touchés mais c’est l’atteinte du nerf facial, uni- ou bilatérale qui est
de loin la plus fréquente.
-les atteintes centrales, encéphalitiques, cérébelleuses ou médullaires
sont plus rares. Lorsqu’elles sont isolées, elles peuvent être difficiles à
rapporter à leur véritable cause.
-l’atteinte méningée.
Le plus souvent muette cliniquement, elle se traduit par une méningite
lymphocytaire (une centaine d’éléments par mm
3
), avec protéinorachie
élevée et normoglycorachie. Il existe généralement une augmentation
oligoclonale des gamma-globulines intrathécales. Cette atteinte
méningée peut être isolée. Elle est fréquente, mais non constante chez
les patients ayant une atteinte neurologique périphérique ou centrale.
Autres manifestations
Plus rares, il peut s’agir d’hépatites granulomateuses, d’atteintes
oculaires, ORL ou musculaires.
Manifestations générales
A l’exception d’une asthénie souvent marquée, inexpliquée, elles sont
rares. Il n’y a pas de fièvre, en général, au cours d’une borréliose de
Lyme.
Les manifestations décrites précédemment peuvent être isolées ou
parfois associées chez un même patient.
3.
Phase tertiaire
Des mois ou des années après l’infection peuvent apparaître des
manifestations tertiaires parfois en apparence primitives.
Manifestations cutanées
-L’acrodermatite chronique atrophiante (ACA) ou maladie de
Pick-Herxheimer est une atteinte des membres inférieurs
principalement. Elle réalise au début une infiltration inflammatoire peu
spécifique de la peau, plus ou moins étendue qui évolue en plusieurs
mois ou années vers une atrophie cutanée laissant un épiderme fin
recouvrant un réseau veineux superficiel très apparent.
-Le lymphocytome cutané bénin se traduit par des nodules de 1 à
2 cm de diamètre, de couleur rouge ou violette. Il n’est pas spécifique
de la borréliose de Lyme mais dans ce cas se localise au niveau du
lobule de l’oreille et sur le scrotum.
Manifestations articulaires
Elles réalisent une mono ou un oligo-arthrite intéressant
essentiellement les grosses articulations et en particulier le genou. Le
respect des poignets et des articulations des mains et le caractère peu
inflammatoire permettent d’éliminer une arthrite rhumatoïde.
Manifestations neurologiques
Les manifestations sont très variées et traduisent des atteintes
médullaires ou/et cérébrales, responsables de tableaux neurologiques
ou psychiatriques divers (pseudo-sclérose en plaque, démence,…).
D’autres manifestations tardives sont possibles (atteintes cardiaques,
musculaires,…) mais encore mal connues car difficiles à rattacher de
façon formelle à l’infection par B.b..

Diagnostic biologique :
Le diagnostic est avant tout clinique.
Les données biologiques standards sont le plus souvent normales
(numération formule sanguine, VS < à 30 mm à la première heure).
La sérologie :
Les examens sérologiques utilisent de multiples méthodes
(immunofluorescence, hémagglutination, ELISA, Western blot) pour
lesquelles les réactifs ne sont pas bien standardisés et dont la
sensibilité et la spécificité sont variables.
En règle générale, le test ELISA ou équivalent est utilisé en première
intention avec recours au Western blot pour la confirmation (ce test
pouvant être effectué à l’initiative du biologiste en cas de recherche
d’Ac positive). Il est préférable d’utiliser une technique permettant de
différencier les Ac IgG des Ac IgM plutôt que d’utiliser une méthode
dosant les Ac totaux (IgG, M et A ).
Un test sérologique utilisant un petit nombre de protéines
recombinantes sera plus spécifique mais moins sensible qu’un test
utilisant un lysat de Borrelia.
Quatre éléments doivent être pris en compte dans l’interprétation du
résultat de la sérologie :
-Il existe de faux positifs parce que le sujet est porteur d’Ac dirigés
contre des bactéries proches de B.b. (tréponèmes, leptospires) mais
également avec des micro-organismes ayant des déterminants
antigéniques communs (MNI, tuberculose…). Un TPHA doit être
effectué pour tout prélèvement positif en sérologie de Lyme.
-Compte tenu de la fréquence de la bactérie dans les biotopes
forestiers, la prévalence des porteurs sains (sérologie positive sans
maladie) peut atteindre 15 à 20% dans certains groupes de patients
(séjours fréquents et prolongés en forêt, chasseurs). Une sérologie
positive n’aura de valeur pathologique que dans un contexte clinique
spécifique.
-La réponse sérologique à l’infection est relativement tardive après la
contamination ; les IgM apparaissent 3 à 6 semaines après le contact
infectant et les IgG apparaissent plus tard et atteignent leur maximum
en plusieurs mois. En fait, en début de maladie, la sérologie est le plus
souvent négative. En cas de forte présomption, un contrôle sérologique
doit impérativement être réalisé un à deux mois après le premier
prélèvement.
Pour les formes compliquées précoces, essentiellement les
neuroborrélioses, la sérologie est plus fréquemment positive, mais les
taux d’Ac restent modérés.
Dans les arthrites ainsi que dans les acrodermatiis chronica
atrophicans (ACA), la réponse en Ac est particulièrement intense avec
une sensibilité proche de 100%.
La présence d’anticorps dans le LCR au cours des formes
neurologiques ou dans le liquide synovial dans les formes articulaires
sont des arguments relativement fiables en faveur du diagnostic. La
ponction lombaire est fortement recommandée à ce titre dans les
formes méningées.
Erythema Migrans
Neuroborréliose
Arthrite et
ACA
IgM
positif faible ou
négatif
positif faible
rarement positif
IgG
souvent négatif
positif faible
positif fort
En confirmation, le Western-Blot permet d’obtenir une bonne
spécificité ; il est plus informatif au niveau qualitatif mais manque
quelquefois de sensibilité.
La culture : L’isolement de B.b. par culture (à partir du sang, du LCR,
d’une biopsie ou de liquide synovial) reste difficile et n’est pas utilisé en
routine. Cette méthode est peu sensible en raison de la difficulté de la
technique et du faible taux circulant de spirochètes chez un patient
infecté.
La recherche d’ADN par amplification génique : La mise en
évidence de l’ADN bactérien, en particulier dans le liquide synovial et le
LCR est intéressante (analyse hors nomenclature / prix = 55€).
Diagnostic différentiel :
Les particularités sémiologiques de l’ECM typique permettent de le
distinguer des réactions cutanées secondaires aux piqûres d’autres
acariens ou insectes. En pratique, il convient surtout d’envisager le
diagnostic de borréliose de Lyme devant des manifestations
neurologiques, articulaires ou cardiaques mal expliquées, en particulier
dans les zones d’endémie.
Une sérologie positive ne permet pas à elle seule de retenir le
diagnostic de borréliose de Lyme.
Evolution, pronostic :
Le risque d’évolution vers une phase secondaire ou tertiaire après une
contamination initiale, en l’absence de traitement antibiotique, n’est pas
systématique mais mal évalué.
Le pronostic de la maladie traitée correctement est en général bon mais
le risque d’évolution ultérieure ne peut pas être formellement éliminé.
Traitement :
Son but est de guérir les manifestations cliniques et d’éviter l’évolution
vers des phases secondaires ou tertiaires en stérilisant l’ensemble des
organes potentiellement infectés.
De nombreux antibiotiques sont actifs sur B.b.
En pratique on utilise une bêta-lactamine ou une cycline.
-
ECM isolé (sans signe clinique de dissémination septicémique) :
amoxicilline 3 à 4 g/24
h
pendant 14 jours ou doxycycline 200 mg/jour
pendant 14 jours chez l’adulte.
-
ECM avec signes de diffusion septicémique ou phase secondaire
de la maladie : amoxicilline 6 à 8 g/jour pendant 21 jours ou
ceftriaxone 2 g/jour par IM ou IV pendant 21 jours.
-
Phase tertiaire : ceftriaxone 2 g/jour pendant au moins 1 mois.
Prévention et surveillance :
La prévention est difficile compte tenu de la diversité du réservoir
animal. La résistance des tiques aux insecticides rend difficile leur
destruction.
La meilleure prévention est individuelle et consiste à retirer les tiques le
plus rapidement possible avec précaution pour ne pas casser le rostre.
Il n’est pas justifié de traiter systématiquement par antibiotiques les
sujets venant d’être piqués par une tique. Toutefois chez la femme
enceinte, un traitement par amoxicilline est souhaitable en raison du
risque d’infection fœtale. Un vaccin est disponible aux Etats-Unis.
FIEVRE BOUTONNEUSE MEDITERRANEENNE
Agent causal :
La fièvre boutonneuse méditerranéenne (FBM) est due à Rickettsia
conorii, bactérie intracellulaire stricte de la famille des rickettsies ; elle
est endémique dans le sud de la France, sur tout le pourtour
méditerranéen.
Réservoir, transmission :
La maladie est transmise par la tique brune du chien, Rhipicephalus
sanguineus, qui pique rarement l’homme mais dont le taux d’infection
est très élevé. L’infection des tiques est héréditaire (trans-ovarienne).
Elles sont donc à la fois réservoir et vecteur de la maladie. Le chien
joue un rôle comme réservoir de tiques.
Fréquence et groupes à risques :
La répartition géographique de la maladie est celle de Rhipicephalus
sanguineus.
Malgré le caractère habituellement méditerranéen de la maladie, le
diagnostic ne doit pas être d’emblée écarté en dehors des zones
d’endémie : il ne faut négliger ni les séjours récents (du patient ou du
chien) en zone infestée, ni la facilité d’installation de micro-foyers de R.

sanguineus dès que le climat ou le biotype le permet. C’est ainsi que
des cas autochtones ont été diagnostiqués jusque dans le Puy de
Dôme ou le Poitou.
La FBM sévit sur le mode endémique avec poussées épidémiques
estivales. L’incidence moyenne de la maladie dans le Sud de la France
est de 50/100 000 habitants par an.
Pathogénie
La bactérie injectée par la tique se fixe sur sa cible, la cellule
endothéliale vasculaire, où elle se multiplie. Cette multiplication
engendre bactériémie et vascularite (phénomènes locaux d’éruption
purpurique). La piqûre de la tique est indolore et celle-ci doit rester
attachée au moins 20 heures pour transmettre la maladie.
Clinique
Six jour en moyenne après la piqûre, les premiers signes apparaissent,
constitués au départ d’un syndrome général associant une fièvre
élevée (39°C), des céphalées violentes dans plus de 50% des cas et
des algies diffuses (arthralgies, myalgies, rachialgies) dans 1 cas sur 3.
L’examen clinique minutieux retrouve l’escarre d’inoculation, la
fameuse tache noire, 3 fois sur 4. Celle-ci peut siéger dans les plis
(aines, aisselles), ou dans le cuir chevelu ou il faudra savoir la
rechercher. Elle est indolore, rouge ou noirâtre, et peut être confondue
avec un furoncle ou une excoriation. Elle peut être drainée par
quelques adénopathies.
En 3 à 5 jours, la période d’état est atteinte avec au premier plan une
éruption maculo-papuleuse fébrile. Les signes généraux s’amplifient
(asthénie majeure, hypotension, amaigrissement). Les manifestations
extracutanées ont une intensité variable qui conditionne le pronostic de
la maladie.
Diagnostique biologique
Sur le plan biologique, dans les premiers jours une thrombopénie et
une leucopénie sont obervées, suivies d’une hyperleucocytose à
polynucléaires. Les transaminases et les LDH sont fréquemment
élevées. L’hyponatrémie et l’hypocalcémie sont des signes péjoratifs.
Le diagnostic repose sur la sérologie, l’immuno-fluorescence indirecte
constituant la technique de référence. Deux sérums doivent être
prélevés à 7 ou 10 jours d’intervalle. Une séroconversion, la présence
d’IgM ou une augmentation significative (x4) du titre des Ac signent le
diagnostic.
L’identification de la bactérie à partir de biopsie cutanée de la « tache
noire » par Immunofluorescence directe ou la culture sur milieu
cellulaire à partir du sang est réservée à des centres spécialisés pour le
diagnostic des formes graves.
Evolution, pronostic :
Le pronostic dépend du terrain de l’hôte et du délai thérapeutique. La
FBM a une fausse réputation de bénignité. Sa létalité pour les patients
hospitalisés est de 2,5%. Les formes malignes (5 à 6% des cas)
surviennnent en particulier chez les sujets âgés, les alcooliques et les
patients porteurs de déficit en G6PD.
La forme maligne comporte une atteinte polyviscérale avec coma,
détresse respiratoire et insuffisance rénale. Elle est mortelle dans 50%
des cas. Le traitement précoce empêche cette évolution défavorable.
Traitement :
Chez l’adulte : doxycycline (VIVRAMYCINE, 200 mg/j classiquement
pendant 7 jours ou jusqu’à 2 jours après l’apyrexie, ou prise unique de
2 comprimés (200 mg). En cas d’allergie ou contre-indication,
fluoroquinolones (CIPROFLOXACINE) pendant 5 jours.
Chez l’enfant : la josamycine 500 mg/kg/j pendant 8 jours est une
alternative, de même que chez la femme enceinte (3 g/l).
Prévention et surveillance :
La meilleure prophylaxie consiste à éviter les piqûres de tiques. La
durée d’attachement nécessaire à la transmission (20h) justifie, en
période estivale en zone d’endémie, un dépistage soigneux, en
particulier chez les enfants.
Après piqûre de tique, l’antibioprophylaxie n’est pas conseillée car elle
s’accompagne, dans un délai de 7 à 15 jours après son arrêt, de
formes cliniques différées de la maladie.
FIEVRE Q
La fièvre Q (« query fever » : query = « à élucider ») est due à une bactérie
Coxiella burnettii. Il s’agit d’une zoonose ubiquitaire aux manifestations
cliniques polymorphes qui peut se présenter sous forme aiguë ou chronique.
La transmission se fait le plus souvent au contact d’animaux infectés (ovins,
caprins, chats… chez lesquels l’infection est généralement inapparente), par
inhalation d’aérosols contaminés ou par ingestion de lait cru. La transmission
par les tiques reste anecdotique.
TULAREMIE
L’agent causal de cette infection bactérienne est Francisella tularensis.
Le réservoir est constitué par les rongeurs et plus particulièrement le lièvre. La
contamination humaine a lieu lors de manipulation de l’animal, Francisella
tularensis franchissant la peau saine. Plus anecdotique, la tularémie peut être
transmise par des tiques.
La forme clinique la plus fréquente est ulcéro-glandulaire, associant un
syndrome grippal à une ulcération nécrotique avec adénopathie satellite.
EHRLICHIOSE
Les Ehrlichia sont des bactéries intracellulaires strictes avec un tropisme
particulier pour les éléments figurés du sang.
L’ehrlichiose recontrée en France est l’ehrlichiose granulocytique humaine
(EGH). Elle est transmise par la morsure d’une tique, Ixodes ricinus, principal
vecteur de Borrelia burgdorferi.
Les symptômes sont peu spécifiques type syndrome pseudogrippal. Une
leucopénie et une thrombopénie sont retrouvées dans la plupart des cas.
L’EGH peut être grave, entraînant des décès par infections opportunistes liées
à la neutropénie profonde.
BABESIOSE
La babésiose, épizootie parasitaire due à Babesia divergens est
éventuellement transmise à l’homme par des tiques Ixodes. Les rares cas
français (9 cas rapportés) sont observés en été, dans les régions d’élevage
bovin intensif, chez des travailleurs ruraux ou des touristes. Le tableau clinique
est pseudo-palustre, particulièrement grave chez les sujets splénectomisés ou
immunodéprimés
ENCEPHALITE VIRALE A TIQUES
L’Encéphalite virale à tiques, également transmise par Ixodes ricinus est rare
en France. Le virus circule entre les rongeurs sauvages et autres petits
mammifères et les tiques.
L’homme est un hôte accidentel, soit par piqûre de tiques soit par ingestion de
lait (principalement de chèvre) contaminé. Le tableau clinique débute par un
syndrome grippal qui évolue vers une méningo-encéphalite.
CONCLUSION
La transmission de l’agent infectieux, qui se fait soit par régurgitation,
soit par les déjections de la tique, ne peut se faire que si la tique reste
attachée un temps suffisant (au moins 20 heures pour la fièvre
boutonneuse méditerranéenne). La première règle est donc d’extirper
la tique le plus précocement possible (dans un mouvement circulaire
après l’avoir agrippée près du rostre fiché dans la derme). Il importe
donc de s’inspecter consciencieusement au retour d’une promenade en
forêt ou dans des broussailles, tout en gardant à l’esprit d’une part que
la piqûre de certaines tiques peut être parfaitement indolore et d’autre
part que les larves et les nymphes peuvent passer facilement
inaperçues. Enfin, hormis des soins de désinfection, aucune couverture
antibiothérapique n’est à conseiller en l’absence de signe clinique. Le
patient doit être surveillé et impérativement consulter au moindre signe.
S. EYRARD - J.P. BOUILLOUX
prochain sujet : interprétation des résultats du spermogramme
1
/
4
100%