199- Profil de sensibilité aux antibiotiques des Entérobactéries

REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE
MINISTERE DE L’ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE SCIENTIFIQUE
Université des Frères Mentouri Constantine !"#$#%&'#
Faculté des Sciences de la Nature et de la Vie $()*
"+, %&
Département de Microbiologie
Mémoire présenté en vue de l’obtention du Diplôme de Master
Domaine: Sciences de la Nature et de la Vie
Filière : Sciences Biologiques
Spécialité : Microbiologie Générale et biologies Moléculaire des microorganismes
Intitulé:
Présenté et soutenu par: MENDACI AMEL Le : 23/06/2015
MIHOUBI SIHEM
Devant le jury:
Président: M
me
MERGOUD L. Maître assistante classe A. Université des Frères Mentouri
Constantine
Rapporteur: M
elle
MEZIANI M. Maître assistante classe B. Université des Frères Mentouri
Constantine
Examinateur: M
me
ZERMENE F. Maître assistante classe A. Université des Frères
Mentouri Constantine
Année Universitaire : 2014-2015
Profil de sensibilité aux antibiotiques des Entérobactéries uropathogènes
(Escherichia coli, Proteus mirabilis, Klebsiella pneumoniae)

REMERCIEMENTS
Nous remercions en premier lieu Allah le tout puissant de nous avoir guidés et donné le
courage d’arriver à ce stade.
Nous sommes très honorés et tenons à remercier les membres du jury:
M
me
MERGOUD L. Maître assistante classe A à l’Université des Frères Mentouri de
Constantine pour avoir accepté de présider le jury.
M
me
ZERMENE F. Maître assistante classe A à l’Université des Frères Mentouri de
Constantine Pour avoir accepté de lire et de faire l’analyse critique de ce mémoire en tant que
examinatrice.
Nous tenons à remercier tout particulièrement M
elle
MEZIANI M. Maître assistante classe B
à l’Université des Frères Mentouri de Constantine, de nous avoir encadrés et suivies durant la
réalisation de notre étude.
Nous remercions également: Mr KHMISSI S. médecin biologiste à l’hôpital militaire
régional universitaire de Constantine "Allaoua Benbaatouche" et Mr BELBEKOUCHE T.
technicien à l’hôpital militaire régional universitaire de Constantine "Allaoua Benbaatouche",
pour leur conseils et pour nous avoir facilitée l’accès au laboratoire et la réalisation de ce
travail.
Merci à toutes les personnes ayant contribué de loin ou de prés a la réalisation de cette étude.

DEDICACES
C’est avec une profonde et sincères gratitude que je dédie ce modeste travail:
À celle qui m'a donné la vie, le symbole de tendresse de courage de responsabilité et
d’amour, votre prière, votre bénédiction, et votre patience qui s'est sacrifiée pour mon
bonheur et ma réussite. Que dieux te garde, te comble de santé, et te donne longue vie ma
douce maman
A mon défunt père qui est plus de ce monde mais sont âme reste toujours prêt de moi pour
me soutenir, que dieu t’accueille dans sont vaste paradis.
A mes chères sœurs Aziza, Warda, Radia, qui mon soutenues avec leur amour et bonté et
gentillesse. Je souhaite simplement que Dieu nous accorde une longue vie et une bonne santé
pour que nous puissions cheminer ensemble sur la route du destin avec amour, honnêteté,
sincérité, respect mutuel, solidarité, dignité comme nous l’ont enseigné nos parents.
A mes chers frères Boubakeur, Massoud, Bachir, Didine, Khaled, Azzedine, Billel, j’ai
beaucoup apprécié l’estime et la tendresse que vous me portez. Que Dieu vous protège.
A ma chère tante Djida, que Allah te bénisse et te protège te donne longue vie.
A mes belles sœurs, Soumaia, Wafa, Salima, Julie, que dieu vous protège et vous accorde une
longue vie pour que vous assisté les réussites de vos enfants.
A mon neveu Houssam et mes nièces Tawes, Julia, Rose, Batoul, votre innocence et gaieté
mon donner une bouffé d’énergie. Que Dieu fasse que vous suiviez mes traces et que vous
fassiez plus que moi. Je vous aime.
A ma chère Siham, tu as été pour moi durant ces années passées ensemble plus qu’une amie,
une sœur. Qu’Allah te protège, je t’aime.
À mes amies: Abir, Ahlam, Aziza, Imane, Amina, avec laquelle j'ai partagé de très bons
moments à l’université et l’hôpital.
MENDACI AMEL

DEDICACES
Que ce travail témoigne de mes respects:
À mes parents:
Ma mère, qui a œuvré pour ma réussite, de par son amour, son soutien, tous les sacrifices
consentis et ses précieux conseils, pour toute son assistance et sa présence dans ma vie, reçois
à travers ce travail aussi modeste soit-il, l'expression de mes sentiments et de mon éternelle
gratitude.
Mon père, qui peut être fier et trouver ici le résultat de longues années de sacrifices et de
privations pour m'aider à avancer dans la vie. Puisse Dieu faire en sorte que ce travail porte
son fruit; Merci pour les valeurs nobles, l'éducation et le soutient permanent venu de toi.
Grâce à leurs tendres encouragements et leurs grands sacrifices, ils ont pu créer le climat
affectueux et propice à la poursuite de mes études.
Aucune dédicace ne pourrait exprimer mon respect, ma considération et mes profonds
sentiments envers eux.
Je prie le bon Dieu de les bénir, de veiller sur eux, en espérant qu’ils seront toujours fiers de
moi.
À ma sœur Kawthar et à mon frère Akram.
À la famille MIHOUBI.
Ils vont trouver ici l’expression de mes sentiments de respect et de reconnaissance pour le
soutien qu’ils n’ont cessé de me porter.
À tous mes professeurs: Leur générosité et leur soutien m’oblige de leurs témoigner mon
profond respect et ma loyale considération.
À ma chère amie Amel avec laquelle j'ai partagé de très bons moments.
À tous mes amis et mes collègues : Ils vont trouver ici le témoignage d’une fidélité et d’une
amitié infinie.
MIHOUBI SIHAM

TABLE DES MATIERES
INTRODUCTION .................................................................................................................... 1
SYNTHESE BIBLIOGRAPHIQUE ....................................................................................... 2
CHAPITRE1 : GENERALITES............................................................................................. 2
1. APPAREIL URINAIRE ....................................................................................................... 2
2. DEFINITION DE L’URINE ................................................................................................. 2
3. DEFINITION DES INFECTIONS URINAIRES ....................................................................... 2
4. ETIOLOGIE ...................................................................................................................... 3
5. TRAITEMENT MEDICALE ................................................................................................ 4
CHAPITRE2 : RESISTANCE BACTERIENNE AUX ANTIBIOTIQUES ...................... 5
1. DEFINITION DES ANTIBIOTIQUES .................................................................................... 5
2. NOTIONS DE RESISTANCE ET SENSIBILITE ...................................................................... 6
2.1. Résistance naturelle et résistance acquise ............................................................ 6
2.1.1. Résistance naturelle ............................................................................................ 6
2.1.2. Résistance acquise .............................................................................................. 6
3. MODE D’ACTION ............................................................................................................. 7
3.1. Antibiotiques agissant sur la synthèse du peptidoglycane ................................. 8
3.2. Antibiotiques inhibant la synthèse des protéines ................................................ 8
3.3. Antibiotiques agissant sur les acides nucléiques ................................................. 8
3.4. Antibiotiques agissant sur les membranes ........................................................... 9
4. CLASSIFICATION DES ANTIBIOTIQUES ............................................................................ 9
4.1. Critères de classification ........................................................................................ 9
4.1.1. Classification selon l’origine .............................................................................. 9
4.1.2. Classification des antibiotiques en fonction de leur spectre d’activité ........ 10
4.1.3. Classification en familles d’antibiotiques ....................................................... 10
CHAPITRE 3 : BIOLOGIE DES ENTEROBACTERIES UROPATHOGENES........... 12
1. BIOLOGIE DES ENTEROBACTERIES .............................................................................. 12
1.1. Définition .............................................................................................................. 12
1.2. Historique ............................................................................................................. 12
1.3. Classification ........................................................................................................ 13
1.4. Habitat .................................................................................................................. 15
1.5. Caractères bactériologiques ................................................................................ 15
1.5.1 Les caractères morphologiques ........................................................................ 15
1.5.2. Les caractères culturaux ................................................................................... 15
1.5.3. Les caractères biochimiques ............................................................................. 15
1.5.4. Les caractères antigéniques ............................................................................. 16
2. LES ENTEROBACTERIES UROPATHOGENES ................................................................. 17
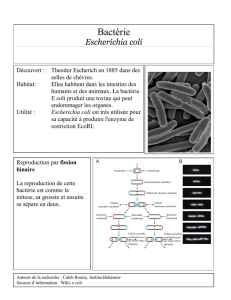
2.1. Escherichia coli ......................................................................................................... 17
2.1.1. Définition ............................................................................................................ 17
2.1.2. Habitat ................................................................................................................ 17
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
1
/
88
100%