Le risque biologique et la méthode d`évaluation du risque

Le risque biologique et la méthode
d'évaluation du risque
Rapport final
Ministère de l’Aménagement du Territoire et de
l’Environnement
R. BONNARD
Unité Evaluation des Risques Sanitaires
Direction des Risques Chroniques
15 Novembre 2001

INERIS DRC-01-25419-ERSA-RBn-383/microb6.doc
1/70
Le risque biologique et la méthode
d'évaluation du risque
Rapport final
MINISTERE DE L’AMENAGEMENT DU TERRITOIRE ET DE
L’ENVIRONNEMENT
15 NOVEMBRE 2001
R. BONNARD
Ce document comporte 70 pages (hors couverture et annexes).
Rédaction Vérification Approbation
NOM R. BONNARD A. CICOLELLA E. VINDIMIAN
Qualité Ingénieur de la Direction des
Risques Chroniques Responsible de l'Unité
Evaluation des Risques
Sanitaires
Responsible de la Direction
des Risques Chroniques
Visa

INERIS DRC-01-25419-ERSA-RBn-383/microb6.doc
2/70
TABLE DES MATIERES
1. RÉSUMÉ 5
2. GLOSSAIRE 6
3. ACRONYMES 8
4. INTRODUCTION 9
5. LA NATURE DES AGENTS PATHOGÈNES 9
5.1. Les champignons et levures 10
5.2. Les algues 12
5.3. Les helminthes 13
5.4. Les protozoaires 13
5.5. Les bactéries 14
5.5.1. Exemples de bactéries infectieuses 15
5.5.2. Les agents toxiques des bactéries 16
5.5.2.1. Les endotoxines 16
5.5.2.2. Le peptidoglycane 17
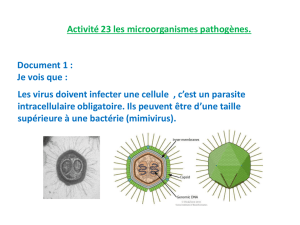
5.6. Les virus 17
5.7. Les prions ou agents transmissibles non conventionnels 19
5.8. Les fragments de matériel animal et végétal 21
6. OBJECTIVATION DES RISQUES BIOLOGIQUES DANS LA POPULATION
: ÉTAT SANITAIRE ET FAITS MARQUANTS 22
6.1. Les données statistiques sur les pathologies infectieuses 22
6.2. L'accroissement de la susceptibilité de la population 25
6.3. La résistance des germes accrus 26
6.4. Une maladie émergente liée aux installations industrielles et domestiques modernes : la
légionellose 27
6.5. Les pathologies respiratoires non infectieuses liés aux agents biologiques 28
6.5.1. Les pathologies allergiques 29
6.5.2. Les pathologies non allergiques 29
6.5.3. Eléments d'information sur la fréquence des pathologies respiratoires non infectieuses dues à
des agents biologiques 30

INERIS DRC-01-25419-ERSA-RBn-383/microb6.doc
3/70
7.LA MÉTHODOLOGIE DE L'ÉVALUATION DES RISQUES : LES
SPÉCIFICITÉS LIÉES AU RISQUE BIOLOGIQUE 32
7.1. La caractérisation du site et de l'activité 33
7.2. Identification des dangers 34
7.2.1. La pathogénicité 34
7.2.1.1. Les mécanismes de la pathogénicité 34
7.2.1.2. Le pouvoir pathogène 35
7.2.2. Approche proposée 36
7.2.3. Difficultés liées à l'interprétation des données 36
7.3. Evaluation de l'exposition 37
7.3.1. Difficultés 37
7.3.2. Les méthodes analytiques 38
7.3.2.1. Les analyses dans les milieux environnementaux 38
7.3.2.1.1. Les méthodes de culture 38
7.3.2.1.2. Les méthodes microscopiques 39
7.3.2.1.3. Les méthodes moléculaires 39
7.3.2.1.4. Les méthodes immunologiques 40
7.3.2.2. Les analyses de milieux biologiques 41
7.3.3. Approche proposée 41
7.4. Relation dose-effet 42
7.4.1. Aspects théoriques 43
7.4.2. Données disponibles 45
7.4.3. Difficultés d'évaluation d'une relation dose-effet 46
7.4.4. Approche proposée 47
7.5. Caractérisation du risque 48
7.5.1. Approche 48
7.5.1.1. Eléments complémentaires de réflexion 49
8. LA PRISE EN COMPTE ACTUELLE DU RISQUE MICROBIOLOGIQUE 50
8.1. Le secteur alimentaire 50
8.2. Les eaux de baignade 52
8.3. Le domaine professionnel 52
8.4. Les risques pour la population liés aux déchets et aux effluents 54
8.5. L'air intérieur des bâtiments 58
9. QUELLES SONT LES QUESTIONS QUI NOUS SONT POSÉES ET
COMMENT Y RÉPONDRE ? 59
9.1. Réalisation d'évaluation de risques pour de futures installations 59
9.2. Réalisation d'évaluation de risques pour des installations existantes 63
9.3. Réalisation d'évaluations de risque suite à l'apparition de symptômes ou de pathologies
diagnostiquées dans la population 63
10. CONCLUSION 64

INERIS DRC-01-25419-ERSA-RBn-383/microb6.doc
4/70
11. RÉFÉRENCES 66
12. LISTE DES ANNEXES 70
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
1
/
111
100%