Nouvelles lumières sur l`étiologie possiblement virale de la

162 Revue Médicale Suisse
–
www.revmed.ch
–
16 janvier 2013
actualité, info
Nouvelles lumières sur l’étiologie
possiblement virale de la myasthénie
auto-immune
Depuis qu’elles ont été décrites, étiquetées
et répertoriées les maladies auto-immunes
constituent un mystère physiopathologi que.
Et les explications disponibles pouvant être
aujourd’hui fournies aux personnes chez
lesquelles elles ont été diagnostiquées ne
sont pas de nature à les rassurer. Pour quel les
raisons premières un organisme est-il le ter-
rain d’un conflit (les métaphores guerrières
demeurent d’actualité) entre son système
immunitaire et certaines des cellules qui le
constituent ? Pourquoi cette brutale erreur
dans la reconnaissance de son soi ? Et com-
ment accepter au long cours l’idée qu’une
fraction de son corps soit devenue étrangère
à ce même corps. Il y a là une forme biolo-
gique de schizophrénie cellulaire qui ne man-
que pas de troubler, déranger, irriter. C’est
aussi une situation bien connue de tous ceux
qui ont à prendre en charge des patients
souffrant de ces pathologies.
Et c’est à cette énigme que c’est attaqué
un groupe international de chercheurs réu-
nis au sein du projet FIGHT-MG («Com-
battre la Myasthénie Grave»), financé par la
Commission européenne.a Ils apportent au-
jourd’hui la preuve du concept qu’une mo-
lécule «mimant un virus» peut déclencher
une réponse immunitaire inappropriée dé-
gradant des fonctions musculaires. Ces ré-
sultats originaux viennent d’être publiés dans
la revue Annals of Neurology.1 Dirigés par
Sonia Berrih-Aknin et Rozen Le Panse, ces
chercheurs démontrent que des molécules
mimant une infection virale sont capables
d’induire, chez la souris, une myasthénie
auto-immune. Ils précisent que, jusqu’à pré-
sent, ceci n’avait jamais été démontré. Cette
preuve de concept établit donc qu’une infec-
tion virale pourrait entraîner une inflamma-
tion du thymus et conduire au développe-
ment d’une myasthénie auto-immune. Pour
fondamentale et sans doute bien en amont
d’une application thérapeutique qu’el le soit,
cette approche ne peut manquer d’être si-
gnalée.
La myasthénie est une maladie auto-im-
mune rare de la jonction neuromusculaire.
Sa prévalence est généralement estimée à
environ 1/5000. «Elle se caractérise par une
faiblesse musculaire avec fatigabilité, fluc-
tuante mais non douloureuse, impliquant
des groupes de muscles spécifiques, résume
le site Orphanet (www.orpha.net/consor/
cgi-bin/index.php?lng=FR). La présentation
la plus classique est une faiblesse oculaire,
avec ptose asymétrique et diplopie binocu-
laire. L’évolution est variable et la plupart
des patients se présentant initialement avec
une faiblesse oculaire développent une fai-
blesse bulbaire ou des membres durant les
trois années suivant l’apparition du premier
symptôme. Cette maladie résulte d’une réac-
tion immune à médiation humorale dépen-
dant des cellules T, dirigée contre la plaque
motrice de la membrane post-synaptique.»
En pratique, chez les patients présentant
une faiblesse musculaire avec fatigabilité, le
diagnostic de myasthénie est confirmé par
différentes méthodes spécialisées, de nom-
avancée thérapeutique
74_77.indd 1 14.01.13 11:52

Revue Médicale Suisse
–
www.revmed.ch
–
16 janvier 2013 163
a Le projet FIGHT-MG (www.fight-mg.eu/) cherche à dé-
terminer les facteurs de risque génétiques et environne-
mentaux associés à la survenue de la maladie et à son
évolution. Le projet s’attache à identifier également les
molécules immunologiques clés associées à son appari-
tion, à étudier les mécanismes pathogènes à la jonction
neuromusculaire, à établir de nouveaux tests de diagnostic,
ainsi que de nouvelles thérapies (thérapies cellulaires,
thérapies immunorégulatrices, immuno-absorption des
autoanticorps pathogènes et autres thérapies pharmaco-
logiques). FIGHT-MG a démarré en décembre 2009 et
durera quatre ans, avec un budget total d’environ 6 mil-
lions d’euros de l’Union européenne. Ce projet implique
douze partenaires, basés en France, Grèce, Israël, Italie,
Norvège, Allemagne et Suisse (Université de Bâle).
Bibliographie
1 Cufi P, Dragin N, Weiss JM, et al. Implication of dsRNA
signaling in the etiology of autoimmune myasthenia gra-
vis. Ann Neurol 2012 ; epub ahead of print.
Les auteurs travaillent au sein de l’unité Cnrs et Inserm
«Thérapie des maladies du muscle strié», groupe hospi-
talier Pitié-Salpêtrière, Paris), de l’Université de Maas-
tricht (School of Mental Health and Neuroscience, Fa-
culty of Health, Medicine and Life Sciences) Pays-Bas,
ainsi que du Département de chirurgie cardiaque des
cardiopathies (Hôpital Marie Lannelongue, Le Plessis
Robinson, France).
breuses entités pathologiques devant par ail-
leurs être écartées (syndromes myasthéni-
ques congénitaux, botulisme, intoxication
aux organophosphorés, les anomalies mito-
chondriales, syndrome de Guillain Barré,
sclérose latérale amyotrophique, etc.). Le
trai tement peut comprendre un traitement
symp tomatique par des anticholinestéra-
siques et une modulation de la réponse im-
mune par l’administration de corticoïdes,
d’azathioprine, de ciclosporine et de myco-
phénolate mofétil. En cas de crises myasthé-
niques et de périodes d’exacerbation, une
amélioration rapide mais temporaire peut
être obtenue par la plasmaphérèse ou l’in-
jection d’immunoglobulines par voie intra-
veineuse. «Le pronostic est actuellement fa-
vorable, avec un taux de mortalité inférieur
à 5% et une espérance de vie quasi normale,
grâce à l’amélioration des tests diagnosti ques,
à l’immunothérapie et aux soins intensifs»
résume Orphanet.
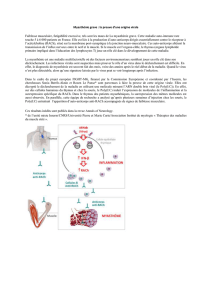
Pourquoi cette production d’auto-anticorps
circulants qui bloquent les récepteurs de l’acé-
tylcholine (RACh) ? Aujourd’hui, la myas-
thénie est présentée comme une maladie
multifactorielle dans laquelle des facteurs
environnementaux semblent jouer un rôle
important. Les infections virales sont sus-
pectées mais comment prouver le rôle pa-
thogène d’un virus dans le déclenchement
d’un processus pathologique quand le diag-
nostic est fait, comme ici, des mois, voire
des années après l’amorce de ce même pro-
cessus ? Dans le cadre du projet européen
FIGHT-MG, les auteurs de la publication de
la revue Annals of Neurology sont parvenus à
décrypter ce déclenchement en utilisant une
molécule mimant l’ARN double brin viral –
le Poly(I:C). Ils se sont centrés sur le thymus
qui, comme on sait, est le lieu de maturation
des lymphocytes T, acteurs centraux des ré-
ponses immunitaires.
Ils ont ainsi mis en évidence in vitro que
le Poly(I:C) était capable d’induire spécifi-
quement une surexpression de RACh par
les cellules épithéliales thymiques. Et ce en
activant trois protéines : le récepteur «toll-
like» 3 (TLR3), la protéine kinase R (PKR) et
l’interféronbêta (IFN-b) ; cette dernière en-
traînant une inflammation au niveau du thy-
mus.
Ces chercheurs ont en parallèle analysé
des thymus pathologiques des malades at-
teints de myasthénie. Ils y ont observé une
surexpression de ces trois protéines, surex-
pression caractéristique d’une infection vi-
rale. Enfin, ils sont parvenus à identifier les
mêmes changements moléculaires dans le
thymus de souris, et ce à la suite de l’injec-
tion de Poly(I:C). Après une période d’injec-
tion prolongée, ils ont aussi observé chez
ces souris la prolifération de cellules B anti-
RACh, la présence d’auto-anticorps bloquant
les récepteurs RACh et des signes cliniques
synonymes de faiblesse musculaire comme
dans la myasthénie.
«Au total, ces résultats originaux mon trent
que des molécules mimant une infection vi-
rale sont capables d’induire une myasthénie
chez la souris, ce qui jusqu’à présent n’avait
jamais été démontré, résume-t-on auprès de
l’Institut national français de la santé et de la
recherche médicale (Inserm). Les prochai nes
étapes de cette recherche consisteront à dé-
terminer de quel virus exogène il pourrait
s’agir ou s’il s’agit d’une activation anor-
male d’une réponse antivirale par des molé-
cules endogènes.»
Jean-Yves Nau
jeanyves.nau@gmail.com
CC BY Yair Haklai
©istockphoto.com/Jana Blašková
74_77.indd 2 14.01.13 11:52
1
/
2
100%