Activité 11 : activité documentaire Objectifs : Connaissances

Activité 11 : activité documentaire
Objectifs :
Connaissances/ compétences du cycle travaillées lors de l’activité :
- Connaître les constituants de l’atome et sa structure interne
DE L’ANTIQUITÉ À NOS JOURS : COMMENT EST CONSTITUÉE LA MATIÈRE ?
I - L’ATOME : UN MODÈLE POUR COMPRENDRE LA CHIMIE.
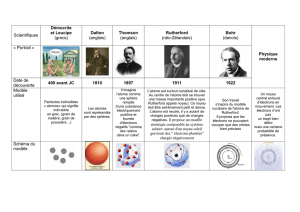
Dès 420 avant JC, Démocrite (philosophe grec) a l’intuition de l’existence des
atomes et invente leur nom (« atomos » en grec qui signifie insécable). Aristote
(philosophe grec) conteste cette existence par la théorie des quatre éléments,
selon laquelle toute matière est faite des 4 substances indestructibles : eau,
feu, air, terre. Son prestige est tel, qu’il imposera sa théorie et qu’il faudra
attendre des siècles pour découvrir la réalité.
• En 1805, John Dalton, un chimiste britannique qui étudia les réactions
chimiques, repris l’hypothèse de Démocrite. Pour lui, l’atome est une sphère
pleine de matière. Tous les atomes d'un même élément sont identiques et les
atomes sont différents d'un élément à l'autre d’après lui.
• En 1897, J. J.Thomson découvre l’un des composants de l’atome. Ces
recherches lui ont permis de découvrir l’existence de charge négative en
mouvement, qu’il appellera électrons. En 1904, Thomson, partant de l’idée que
l’atome est électriquement neutre, pense qu’il doit aussi contenir des charges
positives, que ces charges positives doivent compenser les charges négatives des
électrons. Il suppose alors, que la charge positive est répartie dans un petit
volume (qui peut avoir la forme d’une sphère) et que les électrons sont réparties
dans cette sphère comme un cake au raisin, d’où le nom de son modèle : le
pudding de Thomson.
• En 1910 Ernest Rutherford était un physicien et chimiste Néo-zélando-
britannique. Il est considéré comme le père de la physique nucléaire. Il
bombarde différents échantillons de matière (cuivre, or, argent) avec des
particules, déduit de son expérience qu’il existe une charge positive qui se
trouve dans un tout petit volume qu’il appelle « noyau ».. Rutherford baptise
cette particule positive du nom de proton. Après « un petit calcul » il trouve que
la majorité de la masse de l’atome est concentrée dans un noyau minuscule par
rapport au reste de l’atome. Les dimensions du noyau sont de l’ordre de 10-15m
(100 000 fois moins que les dimensions de l’atome) et que la charge totale du
noyau compense celle des électrons. Rutherford modélise l’atome en pensant au
modèle planétaire. En effet la masse du système solaire est essentiellement
concentrée dans le Soleil tout comme celle de l’atome est concentrée dans le
noyau. Il propose donc comme modèle un tout petit noyau chargé positivement et
comportant l’essentiel de la masse de l’atome, autour duquel les électrons
décrivent des orbites.
• En 1932, James Chadwick, un physicien britannique, découvre une autre
particule dans le noyau : les neutrons. Un neutron est électriquement neutre.
Cette découverte a mené directement à la fission nucléaire et à la bombe
atomique.
Depuis, d’autres modèles plus complexes ont permis d’expliquer de nombreux
autres phénomènes. Le modèle actuel de l’atome est l’aboutissement d’une longue
histoire au cours de laquelle les représentations qu’on s’en fait ont
profondément évolué.
Nous retiendrons pour la classe de troisième un modèle simple, identique au
modèle de Rutherford mais où les électrons n’ont pas de trajectoire particulière
mais avec un noyau complet.
II - COMMENT LE MODÈLE ATOMIQUE A-T-IL EVOLUÉ ?
1) "atomos" : le premier modèle de l'atome.
a) Qui est la première personne à avoir employé le mot " atomos" et à quelle
époque vivait-il ?
_____________________________________________________________
_____________________________________________________________
b) Quelle est la signification du mot "atomos" en grec ?
_____________________________________________________________
_____________________________________________________________
c) Parmi les différents savants qui ont participé à l’élaboration du modèle
atomique, relever ceux qui sont cités dans le texte depuis le début du
XIXème siècle.
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
2) Le modèle de J. J. Thomson.
d) Quel est le constituant de l’atome découvert par J. J. Thomson ?
_____________________________________________________________
_____________________________________________________________
e) Quel est le signe de la charge électrique du constituant découvert par
Thomson ?
_____________________________________________________________

_____________________________________________________________
f) Dans le cadre suivant, dessinez le modèle de l’atome imaginé par Thomson.
3) Le modèle de Rutherford.
g) Que déduit Rutherford de son expérience ?
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
h) Après « un petit calcul », que trouve-t-il à propos :
- de la masse de l’atome comparée à celle du noyau ?
_____________________________________________________________
_____________________________________________________________
- des dimensions de l’atome comparées à celle du noyau ?
_____________________________________________________________
_____________________________________________________________
i) Quelles informations importantes pouvez-vous déduire, du fait que la charge
du noyau compense celle des électrons ?
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
j) A partir des réponses précédentes et d’un peu de réflexion, justifiez
pourquoi on peut dire que la matière est constituée essentiellement de vide.
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
j) Dessinez, ci-dessous, le modèle de l’atome imaginé par Rutherford.
4) Le modèle de l’atome en classe de 3ème :
k) Dessinez dans le cadre le modèle de l’atome retenu en classe de 3ème
CONCLUSIONS :
Question
Bilan
C
ompétence
s
évaluées
D1 Com 2
:
Exploiter un document sous
différente
forme.
D1
-
Com 4 Utiliser la langue française (vocabulaire,
syntaxe, phrase complète)
D2-Meth 9 : Savoir faire un dessin
f,j, k
D4
-
Ana 4
:
Interpréter des résultats et les
communiquer en argumentant
j
•
Dans le modèle retenue en classe de 3
ème
l’atome est constitué de
:
- _____________________________
- _____________________________
- _____________________________
- la charge totale de l’atome est _____________________________ car
__________________________________________________________
__________________________________________________________
1
/
2
100%