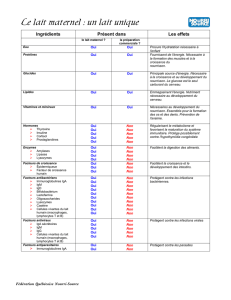
Immunité maternelle colostrale et lactée

!"
A L I M E N T A T I O N
A G R I C U L T U R E
E N V I R O N N E M E N T
Académie Vétérinaire
Paris
26 Mai 2011
#$"%&'()*"
+,"-./0123454630"&.37850"02"%8.29":;<53=;0>""
:[email protected]"A;"
B0.2?0"-*,&"A0"C4;?@"
-77;.329"7820?.0550"1454@2?850"02"581290DE"
/8120;?@"F;74?8;G"02"1055;583?0@"AH3.A;1234."
02"A0"2?8.@73@@34."8;".4;I08;J.9"
K;@=;H8;"@0I?860"chez le porc et les ruminants
Plan de l’exposé
• Introduction : compartiments SI/colostrum et lait
• Bases expérimentales de l’immunité lactée
• Origine des Immunoglobulines
– Du colostrum
– Du lait
• Les mécanismes cellulaires et humoraux de domiciliation
des plasmocytes dans la mamelle et leur origine
• Transfert de cellules par lait/colostrum
• Accroître l’immunité colostrale et lactée
• Conclusion

L"
Compartiments humoraux du système immunitaire""
%91?9234.@"7;=;0;@0@"
%M-6&NL"O-6PO-6("
!"#$%&'#$()&**!%&'#$()&*
%Q@2973=;0"
-6PR-6P!
+
O-6&O-6("
%,*
-./*
-6P!
+
O-6&O-6("
0*
0*
• Entérite de la mère maternelle
• Lait (≠sérum) protège
• Support = sIgA spécifiques du lait
• Infection pulmonaire inapparente
• sIgA du lait anti-PRCV
• lait :protection croisée partielle TGEV
,0@S3?824?Q"2?812"
1)&22&*&%#*2345$.$"&*6&%*%-.!*6)*27$#8*
94::&"#*2&%*$"6)$5&8*
PRCV: réplication virale dans le
tractus respiratoire
TGEV: réplication virale dans le
tractus digestif
Immunite lactée
-*TUBC-)*"),&'U" -*TUBC-)*"*&%&'U"

V"
A L I M E N T A T I O N
A G R I C U L T U R E
E N V I R O N N E M E N T
-77;.329"7820?.0550"1454@2?850"02"581290"
:?4201234."7820?.0550E""9I45;234."A0"@8"
2?8.@73@@34."" pré et post-natale""
" " "
" " "
&18A9730"W929?3.83?0"
:8?3@""
LX"(83""LY!!"
:?42F0?38.E""-6P!"3."066"I32055;@"
(0282F0?38."E-6P!"3.""?;A370.28?Q"S5810.28"M.4"I32055;@N"
U;2F0?38.E"%U'UBC-WU"-P"C,&*%TU,"Z[""
" " :'&BU*C&""
+*P+'&CU%E"*)":,U*&C&'"-6""C,&*%TU,"
C)"T)UC+%"
;<!=>?@<*A<@B=!;!C* ;<!=>?@<*AD>;B=!;!C*'75*/E*
Evolution du transfer de la
protection systémique et muqueuse
*
LAIT IgA
(Monogastrique)
LAIT IgG1
(Ruminants)
:?4201234."7;14@850"E-6&"""""""""""""""""""""""""
F**
:?4201234."@Q@2973=;0""E"-6PR
P!"
B)')%C,+("

\"
A L I M E N T A T I O N
A G R I C U L T U R E
E N V I R O N N E M E N T
!]?0"S8?230"
Sang
Glande Mammaire
Sang et Glande Mammaire
^0"=;05@"4?68.0@"S?4I30..0.2"
50@"-6_"
&18A9730"W929?3.83?0"
:8?3@""
LX"(83""LY!!"
G/H*
L&`>
*IIE** I*/H*
Y$V
*
&``>
*GG*EGH*J*EI**
**KL***ML****GLL
""a"
*JM***NL**GLLO
a"
*N*/H*
!X&>
*KNE*
GM***KL*B*L*
"
Ig du colostrum : filtration vs synthèse locale""
6$:&5$,*P-.!QIH*R*SMLOH*RR*S*GLLO*
>7".*-.*T:.U:2V*
Ig colostrales
**
T:.U:2V*
W/H
V&>
IEIH*JJEG*
b"/352?8234."
b"%Q.2F]@0"
NL***ML*****L****
"

c"
G/H*
L&`>
*IIE** I*/H*
Y$V
*
&``>
*GG*EGH*J*EI**
b"/352?8234."
b"%Q.2F]@0"
a"!YY"!YY"!YY"!Y""""!Y""""VY"
V&>
*
!Pd!("
eY""eYb""fY" Y"""Y""""Y"
Ig du lait : filtration sérique vs synthèse locale""
6$:&5$,*P-.!QIH*R*SMLOH*RR*S*GLLO*
>7".*-.*T:.U:2V*
-6"A;"'&-C"g76R75h" 0.4G1
H*
Y$YX"PL>
*
Y$Yc"&"d"Y$Yc"(""
Les récépteurs du transfer des IgG et sIgA maternelles""
IgG ,
Sang Maternel
Colostrum, Lait
IgG, Sang du N-Né
Placenta ou
gut/MG
epithelium
Sang maternel (IgA)2
Perméabilité non spécifique 48h p.n.-> IgG/
IgG1 ds sg N-Né et s(IgA)2 puis FcRn
intestinal
pH 6.0
pH 7.5
SC
Mb pIgR
IgG, IgG1
(FcRn )
sang
Maternel
M
G
E
p
i
t
h
Plasmocytes distants de la MG Local s(IgA)2
via pIgR
:
FcRn
pIgR
T1,."
%M-6&NL"
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%