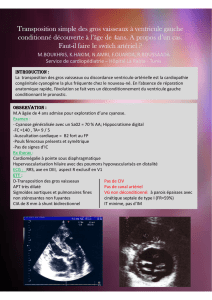
Persistance du canal artériel chez le chat

dierenartsenwereld | #157| februari 2016 18u
Dierenartsenwereld
Le canal artériel est un vaisseau fœtal qui connecte l’aorte descendante à
l’artère pulmonaire. Il permet de dévier le sang destiné aux poumons alors
inutilisés chez le fœtus. Ce canal se ferme normalement très vite après la
naissance (dans les 4 à 5 jours post partum). Habituellement, la persistance
de canal artériel (patent ductus arteriosus ou PDA) se retrouve chez le chiot
mais quelques rares cas sont décrits chez le chaton. La conséquence de cette
persistance est une hypertrophie du coeur gauche associée à une surcharge
en volume. Une régurgitation s’ensuit car la valve mitrale devient peu à peu
défaillante. Dans les cas les plus avancés, un œdème pulmonaire se développe
des suites du déficit cardiaque gauche. Le traitement de cette anomalie est la
fermeture du canal (de manière invasive ou non invasive).
Figure 1 : Illustration du retard de croissance du chaton
atteint, à droite sur la photo, à côté d’un chaton de
la même portée.
Cas Clinique
anamnèse
Un chaton femelle de 550 grammes âgé de 4 semaines
est présenté à la Clinique Vétérinaire Universitaire pour une
suspicion de cardiopathie congénitale. Le chaton présente
une forte intolérance à l’effort (phases d’orthopnée), un retard
de croissance et un frémissement cataire. Une radiographie
thoracique a permis de détecter une cardiomégalie très
importante quelques jours avant la présentation du chaton à la
Clinique Vétérinaire Universitaire.
examen Clinique
Le chaton est alerte, il présente une tachypnée modérée
(60 mpm) et une fréquence cardiaque régulière de 240 bpm.
L’auscultation révèle un souffle systolo-diastolique de grade
5/6 et le pouls fémoral est bondissant.
Traitement chirurgical
d’une persistance de canal
artériel chez un chaton
de 4 semaines
Christelle Hage, Anne-Christine Merveille et Stéphanie Claeys

Dierenartsenwereld
dierenartsenwereld | #157| februari 2016 20u
Figure 2: Echocardiographie ; coupe longitudinale 4
cavités par abord droit. Présence d’une quantité
importante d’épanchement péricardique (flèche) et
d’une dilatation atriale et ventriculaire gauche.
Figure 3 : Echocardiographie ; coupe transversale par abord
gauche. Tronc pulmonaire dilaté par rapport à
l’aorte, canal artériel visible sur la droite (flèche).
Figure 4 : Echocardiographie Doppler : flux systolo-
diastolique enregistré dans l’artère pulmonaire
principale.
eChoCardiographie
L’échocardiographie permet de mettre en évidence une
dilatation importante des cavités cardiaques gauches. Le tronc
pulmonaire apparaît dilaté et des turbulences sont visibles.
Un canal artériel de type IIA est visualisé sur la coupe petit
axe parasternal gauche (Figure 3). Un flux continu gauche
droit est visible au niveau de ce canal (Figure 4). Une quantité
importante d’épanchement péricardique (1 cm) associé à un
début de tamponade cardiaque est également présent.
diagnostiC et plan thérapeutique
Une persistance du canal artériel avec décompensation
cardiaque gauche débutante est diagnostiquée. Un traitement
médical à base de pimobendane 0,3 mg/kg (1 gélule de 0,15
mg deux fois par jour) et de furosémide 1mg/kg (1 gélule de
0,5 mg deux fois par jour) est mis en place jusqu’au jour de la
chirurgie.
traitement ChirurgiCal et
anesthésie
Le chaton est placé en décubitus latéral droit et la paroi
thoracique gauche est préparée. Une tonte et une asepsie
chirurgicale sont réalisées.
L’anesthésie utilisée pour l’intervention est la suivante :
induction au midazolam 0,2 mg/kg IV, rémifentanil 0,2 μg /kg/
minute en infusion et alfaxolone 1mg/kg IV et maintenance
au sévoflurane par inhalation. Le chat est donc intubé et
sa respiration est contrôlée. Le monitoring comprend un
capnographe, un pulsoxymètre, un ECG et un appareil
Doppler pour vérifier sa pression artérielle. Un thermomètre
oesophagien permet de contrôler sa température en continu
et un coussin chauffant est mis en place.
Une injection de cefazolin (20 mg/kg IV) est réalisée lors de
l’induction de l’anesthésie.
Une thoracotomie intercostale est réalisée au niveau du
4ème espace intercostal gauche. Une fenêtre péricardique
est réalisée afin d’évacuer l’épanchement péricardique. Le
nerf vague gauche est identifié et rétracté en regard du canal
artériel. Celui-ci est alors identifié et disséqué délicatement
à l’aide d’un forceps à angle droit. Un double fil de soie 3-0
est passé sous le canal et 2 ligatures simples sont mises en
place pour fermer le canal artériel. La thoracotomie est fermée
classiquement après évacuation de l’air de la cavité thoracique:
points simples intercostaux préplacés (polydioxanone 3-0),
surjets musculaire (polyglecaprone 25 3-0), sous-cutané et
intradermique (polyglecaprone 25 4-0).

Dierenartsenwereld
21u
dierenartsenwereld | #157| februari 2016
Figure 6 : Chaton en fin de chirurgie.
Figure 5 : Illustration des étapes chirurgicales après thoracotomie intercostale gauche (images issues de la chirurgie d’un chiot).
A, rétraction du nerf vague (flèche du haut) permettant la mise en évidence du canal artériel (entre les 2 instruments,
flèche du milieu), nerf phrénique visualisé également (flèche du bas). B, mise en place de 2 fils de soie sous le canal
artériel disséqué. C, canal artériel doublement ligaturé.
soins post-opératoires
Le chaton est réveillé et ne présente
pas de complications. Il reçoit de la
méthadone 0,2 mg/kg IV toutes les 4
heures pour son analgésie ainsi que du
pimobendane 0,3 mg/kg per os 2 fois
par jour. Il est gardé en observation
pendant une nuit et est rendu à
ses propriétaires le lendemain. Le
traitement à base de pimobendane est
poursuivi jusqu’au prochain contrôle
mais le furosémide est arrêté. Enfin, 10
jours de repos sont conseillés.
ventricule gauches et réduction de
la fraction de raccourcissement. Ces
deux dernières modifications sont liées
à la réduction de la pré-charge et une
augmentation de la postcharge suite à
la fermeture du canal. Le pimobendane
(0,3 mg/kg deux fois par jour per os) est
poursuivi et à adapter en fonction du
poids du chat. Un nouveau contrôle est
prévu dans 6 mois.
Un contrôle téléphonique réalisé 12
semaines après l’intervention confirme
le bon état général du chaton et
l’absence de signes cliniques. Il a bien
grandi et pèse 1,62 kg.
disCussion
La persistance du canal artériel
chez le chat est rare. Une étude
rétrospective a repris les données
médicales de 57 418 chats et a montré
que parmi ces individus, 0,14 %
présentaient des maladies cardiaques
congénitales. La persistance du canal
artériel ne représentait que 5% de
toutes les pathologies congénitales
cardiaques contre 14 % chez le chien
(Schrope, 2015). Peu de publications
sont d’ailleurs rapportées sur cette
pathologie chez le chat ; la plupart
concernent l’espèce canine.
suivi post-opératoire
Quatre semaines après la chirurgie, le
chaton est présenté pour un contrôle.
Il est en forme et ne présente plus
d’intolérance à l’effort. L’examen
clinique est peu remarquable. Il
a pris du poids (300 grammes).
L’échocardiographie de contrôle révèle
une nette amélioration : l’épanchement
péricardique a disparu, absence de
reflux turbulent visualisé dans l’artère
pulmonaire (flux normal), nette
réduction de la taille de l’atrium et du

Dierenartsenwereld
dierenartsenwereld | #157| februari 2016 22p
Bibliographie
- SCHROPE D.P., Prevalence of congenital heart
disease in 76 301 mixed-bread dogs and 57 025
mixed-breed cats, J. Vet. Card., 2015, 17,192-
202.
- HUTTON J.E., STEFFEY M.A., RUNGE J.J.,
McCLARAN J.K., SILVERMAN S.J., KASS P.H.
Surgical and nonsurgical management of patent
ductus arteriorus in cats : 28 cases (1991-2012).
J. A. Vet. Med. A., 2015, 247 (3), 278-285.
- WELCH FOSSUM T., Small Animal Surgery,
Fourth edition, Elsevier : Missouri, 2013, 1775p.
- SUMMERFIELD N. J., HOLT D.E., Patent Ductus
Arteriosus Ligation and Pulmonary Artery Band-
ing in a Kitten, J. Am. Anim. Hosp. Assoc., 2005,
41, 133-136.
- NOVO-MATOS J., HURTER K., BEKTAS R.,
GREST P., GLAUS T., Patent ductus arteriosus
in an adult cat with pulmonary hypertension and
rught-sided congestive heart failure : hemody-
namic evaluation and clinical outcome following
ductal closure, J. Vet. Card., 2014, 16, 197-203.
- AOKI T., SUGIMOTO K., SUNAHARA H., FUJII
Y., Patent ductus arteriosus ligation in two young
cats with pulmonary hypertension, J. Vet., Med.
Sci., 2013, 75(2), 199-202.
- ADAMOVICH-RIPPE K. S., STEFFEY M.A.,
YBARRA W.L., JOHNSON L.R., Unilateral
laryngeal paralysis subsequent to surgical ligation
of a patent ductus arteriosus in an 8-week-old
domestic shorthair cat, J. Am. Vet. Med. Assoc.,
2013, 242, 1727-1731.
- VAN ISRAEL N., FRENCH A.T., DUKES-MCE-
WAN J., CORCORAN B.M., Review of left-to-
right shunting patent ductus arteriosus and short
term outcome in 98 dogs, J. Small Anim. Pract.,
2002, 43, 395-400.
Cette anomalie entraine une
insuffisance cardiaque congestive
gauche secondaire à une surcharge en
volume du cœur gauche associée ou
non à une hypertension pulmonaire.
Dans les cas les plus avancés, une
décompensation cardiaque se met alors
en place, avec un souffle de grade 4/6
ou plus, audible à l’auscultation lors
de l’examen clinique (Hutton
et al.
,
2015). Dans notre cas, l’insuffisance
cardiaque congestive se manifestait
principalement par une tachypnée
et la présence d’un épanchement
péricardique. L’épanchement
péricardique est un signe classique
de décompensation cardiaque gauche
chez le chat. Selon Hutton (2015), le
souffle est détecté plus précocement
dans l’espèce féline que dans l’espèce
canine. En effet, les 28 chats vus dans
cette étude rétrospective avaient moins
de un an lors de la détection d’un
souffle cardiaque alors que d’autres
études concernant l’espèce canine
décrivent qu’environ un tiers des chiens
sont diagnostiqués après l’âge d’un an.
Afin d’éviter le développement
d’une décompensation cardiaque
et d’une hypertension artérielle
pulmonaire, il est nécessaire de traiter
en fermant le canal. Deux types de
procédures sont décrites chez le
chat : la ligature du canal artériel via
une thoracotomie comme réalisée ici
(méthode extravasculaire invasive) et
l’embolisation d’une spirale via l’artère
fémorale ou l’artère carotide pour
créer une occlusion du canal (méthode
intravasculaire moins invasive) (Fossum,
2013). En cas de non fermeture du
canal, un traitement médical peut
être initié mais la plupart des chats
développeront des symptômes relatifs
à la persistance du canal artériel et
décéderont de cette pathologie (Hutton,
2015). Une étude rétrospective portant
sur 98 chiens souffrant de persistance
de canal artériel rapporte 90 % de
traitement par fermeture réalisés
contre 6% de traitement médical et
4% d’absence de traitement (Van
Israël
et al.
, 2002). Les principales
complications rencontrées sont les
suivantes : rupture du canal (dans 6 à 15
% des cas), reformation du shunt et flux
résiduel (Fossum, 2013), embolisation
pulmonaire des spirales, saignement au
niveau du site de cathétérisme. L’étude
de Van Israël et al. (2002) a permis de
donner un taux de flux résiduel de 43 %
en post-opératoire avec une tendance
plus importante pour les fermetures
par spirale par rapport à la ligature
chirurgicale. Elle a également permis
de montrer qu’il n’y a pas de différence
significative entre les deux types de
procédure en termes de complications
et de taux de survie (95% un mois après
la chirurgie).
Une complication en particulier est
rapportée dans plusieurs articles
(Van Israël
et al.
, 2002 ; Hutton
et al.
,
2015 ; Adamovich-Rippe
et al.
, 2015).
Il s’agit du développement d’une
paralysie laryngée liée à un trauma du
nerf laryngé récurrent gauche (dont
l’origine est le nerf vague gauche) lors
de l’intervention (méthode invasive
par ligature du canal). Il en résulte
une absence de mobilité du cartilage
aryténoïde gauche. Une laryngoscopie
n’a pas été réalisée en post-opératoire
dans notre cas mais aucun signe
clinique de paralysie laryngée n’a été
observé.
Quelques rapports de cas félins ont
décrit une présentation similaire à
notre chaton (retard de croissance,
intolérance à l’effort, souffle cardiaque
à l’auscultation) et le diagnostic s’est
dans tous les cas fait par radiographie
et échocardiographie. Une thoracotomie
pour ligaturer le canal a été réalisée
sur chacun d’eux. La méthode par
embolisation n’était techniquement
pas envisageable vu le faible poids des
sujets (Summerfield
et al.
, 2005 ; Novo-
Matos
et al.
, 2014 ; Aoki
et al.
, 2013 ;
Adamovich-Rippe
et al.
, 2013).
Le pronostic chez le chat après
fermeture du canal artériel est bon.
Cependant, selon Hutton et al. (2015),
le taux de survie chez le chat n’atteint
pas celui du chien. On parle de 94%
de succès après fermeture par ligature
chez le chien (taux de mortalité de
5,6%). Cette étude sur un faible nombre
de chats révélait un taux de mortalité
de 13% en peropératoire. La petite
taille des sujets a été pointée, rendant
l’intervention (ligature ou embolisation)
plus difficile à réaliser. Chez le chien,
un canal artériel non traité résulte en
une insuffisance cardiaque congestive
dans l’année suivant sa détection et est
associé à un taux de mortalité de 64 %
(Hutton et al., 2015).
ConClusion
La persistance de canal artériel est
peu fréquente chez le chat. Le retard
de croissance observé, l’intolérance à
l’effort rapportée et le souffle cardiaque
détecté à l’auscultation peuvent aiguiller
le vétérinaire généraliste vers ce type
d’anomalie congénitale. Le diagnostic
est ensuite posé par échocardiographie.
La fermeture chirurgicale précoce du
canal artériel a été réalisée avec succès
chez ce chaton.
1
/
4
100%