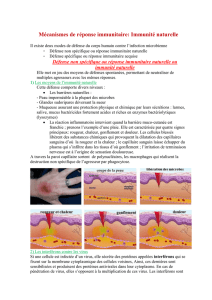
Réponse Immunitaire Anti-infectieuse - Fichier

UE : Immunologie-La réponse immunitaire en action.
Date : 29/11/2011 Plage horaire : 17h-18h
Promo : PCEM2 Enseignant : Isabelle Pellegrin
Ronéistes :
VALVERDE Dune : valverdune@yahoo.fr
TUNON DE LARA Sara : saratunondelara@msn.com
Réponse Immunitaire Anti-infectieuse
I) La réponse immunitaire
1. Les barrières naturelles
2. La réponse immunitaire innée
3. La réponse immunitaire adaptative
II) L’immunité antivirale
1. Défens e antivirale de 1
ère
ligne : réponse innée.
2. Réponse anti-virale de seconde ligne : réponse adaptative.
3. Mécanisme d’échappement du virus à la réponse immunitaire.
I) L’immunité antibactérienne
1. Les bactéries intracellulaires
2. Les bactéries extracellulaires
3. Mécanismes d’échappement du virus à la réponse immunitaire
www.cdbx.org/site/spip.php?page=roneop2 1/12

!"
•#$%"&&
•%'('(
•("%!$)
•
*+ '(
,*+*-* )
./--0.
'+(
1-+-*)
+ +234
2!
,***3- "%5-
+ 2!--+6
"***7785-)
! " #$,**%
" &#$ %+9:*+)
*;
'()
"
•(-
•* + , ,
•- .#*/-+--
)+<+3-+
•/%"+.!
•#(000
2) La réponse immunitaire innée
*+=*0.)
>?@AA
AA"
• ( ,
www.cdbx.org/site/spip.php?page=roneop2 2/12

•(.!*+
-+ >?)AA'AB:1CABA(D
- E)/./-
1 #2 *# (
34
•# # +
+
•# "#$ >@>
•# +
A".!-,F,F*-
>,F-.!-"
•** +!-
',G))H,7(
•+ -/'+
,F,I,G(
•.*-+',F(-
1*J3#$# # ",',5,6
!- -)
*3$# 4(,(#,*7 !#$+
8 '(#$89'
!!-+K!!.
--!3*5*!(
1 8 $# # 2 +
D"
•:;4 +
(
www.cdbx.org/site/spip.php?page=roneop2 3/12

•:;
#
A-/>?)AA)
-.<+1,#<"
•#)L"D--*+-- +
3-!*/--
#)M
•BN+"--*+-
3-!
•#)M"-- + ->,3+O
•#)LP">--BQ5--+L
"#
R!++ +
- - - .
- .+ ++
> + . - /
EB:,G,F+,S.I+
- /
+ BQ,3I)7M+
+C -.
-9
=#
##"4$)# &# &#$
--%
+ %>?0.)E-
-<1
-- + -
www.cdbx.org/site/spip.php?page=roneop2 4/12

>?, #:
@:>60A$#?:',:5,:'B,:
: 5- ! !- -
+ 2! ##"0005 E5!-
"
>'+("
)R-2!#NBT#)LP5--
+L3+'(
)R-#)P#)I2!
!+P
)+LU
5- +LU-N
#)MPLPF2!
))5.-2!0.N
#)P
"+L+P+LU E.)
3+
)"#!+K= E9
&
!0.
3-+=# 5-
--$>1B
%+!-
! +
!-
www.cdbx.org/site/spip.php?page=roneop2 5/12
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%