Réactions chimiques

Réactions chimiques
I. Chemin de fer :
Une réaction chimique entre l’oxyde de fer III et du métal aluminium est utilisée pour souder les rails de chemin de fer. Les
deux composés réduits en poudre sont intimement mélangés et la réaction est déclenchée en portant un point du mélange à
incandescence. On obtient du métal fer, qui se solidifie en refroidissant, et de l’alumine, se dégageant sous forme de fumées
blanche.
1. Donner la formule de l’oxyde de fer III, sachant qu’il s’agit d’un composé ionique constitué des ions Fe3+ et O2-
Fe2O3
2. L’alumine est de l’oxyde d’aluminium. Donner sa formule chimique.
Al2O3
3. Rappeler la définition d’un métal.
Empilement régulier d’un grand nombre d’atomes du même type.
4. Etablir l’équation de la réaction qui a lieu.
Fe2O3 (s) + 2 Al(s) Al2O3 (s) + 2 Fe(s)
II. Equilibrer les réactions suivantes
a. H2O(l) H2(g) + ½ O2(g)
b. 2 (H+(aq)+Cl-(aq) ) + CaCO3 (s) CaCl2 (aq) + H2O(l) + CO2 (g)
c. 2 CuO(s) + C(s) 2 Cu(s) + CO2 (g)
d. CH4(g) + 2 O2(g) CO2(g) + 2 H2O(g)
e. CH4(g) + 3/2 O2(g) CO(g) + 2 H2O(g)
f. C3H8(g) + 5 O2(g) 3 CO2(g) + 4 H2O(g)
g. C4H10(g) + 13/2 O2(g) 4 CO2(g) + 5 H2O(g
III. Making oxygen in the lab
Oxygen gas can be prepared and collected in the laboratory using the apparatus shown in the diagram.
1. Hydrogen peroxide decomposes very slowly to form water and oxygen.
a. Write a word equation for this reaction.
Hydrogen peroxide Water + oxygen

b. The formula of hydrogen peroxide is H2O2. Write the chemical equation for the reaction.
H2O2(aq) H2O(l) + 1/2 O2(g)
c. The reaction is much faster if a small amount of manganese(IV) oxide is added.
What type of substance is manganese(IV) oxide in this reaction?
Il s’agit d’un catalyseur.
2. The diagram shows oxygen gas being collected in a syringe.
The gas can also be collected in a measuring cylinder over water (using a trough)
The diagram shows apparatus for preparing oxygen gas in the laboratory using a colourless solution
G and a black powder H.
Name the substances G and H.
G : peroxide d’hydrogène
H : dioxide de manganèse
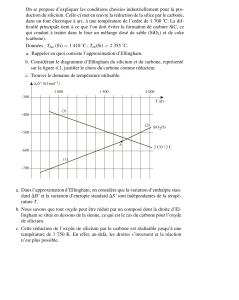
IV. Production du fer :
On produit le fer dans des hauts fourneaux à partir de l’oxyde de fer III qu’on extrait des mines.
Pour transformer le minerai de fer, il faut d'abord
fabriquer les gaz nécessaires à cette transformation.
Ceci se produit dans la partie inférieure du haut
fourneau, par la combustion du carbone contenu
dans le coke, avec le dioxygène de l’air. On obtient
du dioxyde de carbone qui lui-même réagit avec le
carbone pour former du monoxyde de carbone.
A la température élevée qui règne dans le four, la
vapeur d’eau naturellement présente réagit
également avec le carbone et produit du monoxyde
de carbone et du dihydrogène.
Le métal fer est obtenu par 3 réactions possibles :
- L’oxyde de fer III avec le carbone
- L’oxyde de fer III avec le monoxyde de carbone
- L’oxyde de fer III avec le dihydrogène
Dans les deux premiers cas la production de fer s’accompagne de dioxyde de carbone, alors que dans le
3ème cas, de l’eau est formée.

1. Etablir la formule de l’oxyde de fer III constituant le minerai de fer, sachant que c’est un composé
ionique.
Fe2O3
2. Ecrire l’équation de la formation du métal fer à partir du carbone directement.
2 Fe2O3 (s) + 3 C(s) 4 Fe(s) + 3 CO2 (g)
3. Ecrire les équations de l’enchaînement des 3 réactions qui conduisent à la production d’oxyde de fer
à partir de l’oxyde de fer III et du monoxyde de carbone.
C(s) + O2(g) CO2 (g)
CO2 (g) + C(s) 2 CO(g)
Fe2O3 (s) + 3 CO(g) 2 Fe(s) + 3 CO2 (g)
4. Ecrire les équations de l’enchaînement des 3 réactions qui conduisent à la production de fer à partir
du minerai et de l’eau.
C(s) + O2(g) CO2 (g)
CO2 (g) + C(s) 2 CO(g)
H2O(g) + C(g) H2(g) + CO(s)
Fe2O3(s) + 3 H2(g) 2 Fe(s) + 3 H2O(g)
1
/
3
100%