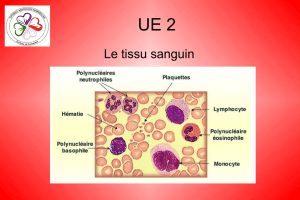
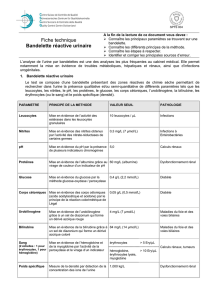
Évaluation de la conservation des échantillons urinaires en vue d

Journal Identification = ABC Article Identification = 0625 Date: September 26, 2011 Time: 2:54 pm
doi:10.1684/abc.2011.0625
588 Pour citer cet article : Fabbro C, Darolles J, Rault JP. Évaluation de la conservation des échantillons urinaires en vue d’une étude sur l’automate d’analyse urinaire UF 1000i
(bioMérieux©). Ann Biol Clin 2011 ; 69(5) : 588-92 doi:10.1684/abc.2011.0625
Biologie au quotidien
Ann Biol Clin 2011 ; 69 (5) : 588-92
Évaluation de la conservation des échantillons
urinaires en vue d’une étude sur l’automate
d’analyse urinaire UF 1000i (bioMérieux©)
Preservation of urine samples for UF 1000i (bioMérieux©) analysis
Christelle Fabbro1
Jacques Darolles2
Jean-Philippe Rault1,2
1CHR Metz-Thionville, hôpital Bel-Air,
laboratoire de microbiologie, Thionville,
France
<chris.fabbro@yahoo.fr>
2Laboratoire de biologie médicale Pax,
Metz, France
Article rec¸u le 7 février 2011,
accept´
e le 2 mai 2011
Résumé. L’implantation de plateaux techniques et l’obligation d’accréditation
posent la problématique de la gestion des conditions de conservation des
échantillons avant analyse. Ce travail a évalué la conservation des échantillons
urinaires, en présence ou absence d’acide borique, en vue d’une analyse sur
l’automate UF 1000i (bioMérieux©). Les résultats montrent qu’il n’y a pas de
modification significative de la concentration en érythrocytes ou en leucocytes
sur 48 heures en présence ou en absence d’acide borique. La qualité de conserva-
tion des érythrocytes est inférieure, mais la présence d’un agent de conservation
est sans effet. Ainsi, pour les éléments figurés, même si une analyse rapide reste
naturellement à privilégier, ces paramètres semblent néanmoins assez stables
pour autoriser une analyse différée à 24 voire 48 h. Les résultats sont totalement
différents pour les bactéries où une croissance bactérienne est démontrée, en
l’absence d’agent de conservation, sur un délai qui varie selon l’importance
de l’inoculum bactérien initial. L’efficacité remarquable de l’acide borique en
tant que conservateur est mise en évidence par l’allure des courbes, qui tend
également à relativiser la valeur de la concentration en acide borique. Enfin,
l’acide borique n’interfère pas avec le dénombrement des érythrocytes, leuco-
cytes et bactéries par l’automate et son utilisation est totalement adaptée pour
la conservation des échantillons urinaires en vue d’une analyse sur l’automate
UF 1000i (bioMérieux©).
Mots clés : conservation des échantillons urinaires, automate d’analyse uri-
naire UF 1000i®, examen cytobactériologique des urines
Abstract. With the general tendency that’s to say the grouping of laboratories
as technical divisions and the accreditation’s obligation, the handling of urinary
sample preservation’s conditions is a major concern. Urinary sample preserva-
tion, with or without boric acid, for UF 1000i urinalysis was the purpose of this
study. No significant modification was found in red blood cells and white blood
cells concentration on a 48 h period with or without boric acid. Preservation’s
quality of the red blood cells is lower, but the presence of preservative is inef-
fectual. Thus, for those elements, even if a fast analyse is obviously preferred,
these parameters seem to be stable enough to allow a 24 to 48 h delayed urina-
lysis. Results are totally different for bacteria, which grow if no preservative is
added, in a period of time based on the size of the initial bacteria’s inoculum.
Efficiency of the boric acid as a preservative is shown by the curves, which
put into perspective the concentration of acid boric. Finally, boric acid doesn’t
interfere with the erythrocyte, leucocyte or bacteria’s count on UF 1000i and
his use is totally suitable for the preservation of urine samples for UF 1000i
analysis.
Key words: preservation of urine samples, UF 1000i®automated urine analy-
ser, urinalysis
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Journal Identification = ABC Article Identification = 0625 Date: September 26, 2011 Time: 2:54 pm
Ann Biol Clin, vol. 69, n◦5, septembre-octobre 2011 589
Conservation des urines pour analyse sur UF 1000i
Le regroupement des outils d’analyse en plateaux tech-
niques et le respect des recommandations émises par la
norme NF EN ISO 15189 imposent de maîtriser la gestion
du transport et des conditions de stabilité des échantillons
avant leur analyse. Pour le traitement des échantillons uri-
naires, l’ensemble des référentiels préconise, à défaut d’une
analyse dans les 2 h après le recueil, une méthode évitant
la pullulation bactérienne telle que la conservation à + 4 ◦C
ou le recours à un milieu de transport avec acide borique
(AB) [1, 2]. La conservation des échantillons à 4 ◦C, pro-
cédure efficace dans certaines études [3, 4], n’en demeure
pas moins délicate à mettre en place en pratique courante
du fait des problèmes logistiques. Le recours à un milieu
de transport contenant de l’AB apparaît donc comme la
solution à privilégier. Néanmoins, le manuel utilisateur de
l’UF 1000i précise que « les données d’analyse peuvent
être incorrectes dans les conditions suivantes parmi les-
quelles les échantillons contenant des conservateurs (...)».
De plus, d’après la norme NF EN ISO 15189, des recom-
mandations, basées sur les principes techniques utilisés par
l’automate, doivent être délivrées concernant le recueil,
le transport et les conditions de stockage pour éviter les
interférences [5]. Ce travail a donc évalué la conserva-
tion des échantillons urinaires, en présence ou absence
d’AB, en vue d’une analyse sur l’automate UF 1000i
(bioMérieux©).
Matériels et méthodes
Population
L’ensemble des prélèvements urinaires, d’origine commu-
nautaire, adressé pour examen cytobactériologique, à
l’exception des spécimens présentant un délai d’ache-
minement supérieur à 4 h, de patients âgés de moins de
15 ans ou de femmes enceintes, a été analysé sur l’automate,
dès réception au laboratoire.
À l’issue de la première sélection, les échantillons pré-
sentant une quelconque alarme, une conductivité mesurée
inférieure à 8 mS/cm, une concentration significative de
spermatozoïdes, de levures, de cristaux, de cylindres patho-
logiques, de cellules arrondies de petite taille ou de cellules
épithéliales, ont été exclus de l’étude. Au total, 32 échan-
tillons patients ont été retenus.
Constitution des pools
Trois pools urinaires (A, B et C) ont été constitués, afin
d’obtenir des concentrations en érythrocytes, leucocytes
et bactéries proches des seuils décisionnels pour ces para-
mètres, soit respectivement 104globules rouges (GR)/mL,
104globules blancs (GB)/mL et 103à10
5unités arbitraires
(UA)/mL pour les bactéries.
Les pools (A et B) ont été répartis chacun dans deux réci-
pients stériles, l’un sans conservateur (flacon stérile en
polystyrène 40 mL, Gosselin®) et l’autre contenant de l’AB
(agent de conservation). Le remplissage du flacon a été réa-
lisé suivant les recommandations du fabricant (flacon stérile
en polystyrène avec AB, Gosselin®), avec 40 mL d’urine
pour une concentration finale d’AB de 13 g/L.
Le pool C est réparti dans quatre récipients stériles, le pre-
mier récipient exempt de conservateur et les trois suivants
contenant chacun 520 mg d’AB.
Pour étudier l’influence d’un remplissage insuffisant du fla-
con par le patient, donc d’une concentration plus importante
de conservateur que celle préconisée par le fabricant, le
pool urinaire est réparti de la manière suivante dans les
récipients avec conservateur : le premier selon les recom-
mandations du fabricant (40 mL), le deuxième avec 20 mL
pour une concentration finale en AB à 26 g/L et le dernier
avec 13,3 mL, soit 39 g/L d’AB (remplissage égal au tiers
du volume recommandé par le fabricant).
Analyse sur UF 1000i
Les deux premiers pools ont été analysés six fois aux temps
T+0h,T+2h,T+4h,T+8h,T+24hetT+48henmode
automatique sur l’UF 1000i, à la différence du troisième
pool qui n’est analysé que trois fois aux mêmes temps. Les
pools ont été conservés à température ambiante durant tout
le temps de l’étude.
Résultats
Pour chaque pool d’urines, les valeurs obtenues aux diffé-
rents temps, ainsi que les moyennes (m), écarts-types (s),
coefficients de variation (CV) et intervalles de confiance
(IC) en découlant sont déterminés pour chaque mode de
conservation. Les graphiques, inhérents à ces résultats, per-
mettent de suivre l’évolution des GR, GB et bactéries au
cours du temps, selon le mode de conservation. Le chevau-
chement des intervalles de confiance indique une différence
non significative entre les moyennes.
Érythrocytes
Nous notons l’absence de modification significative de la
concentration en érythrocytes au sein de l’échantillon pen-
dant un délai de 48 h avec ou sans agent de conservation.
Une légère diminution de l’ordre de 20 % est observable
dans les premières heures, mais n’est pas significative. Des
concentrations plus élevées en AB jusqu’à 39 g/L n’ont pas
d’influence sur l’évolution des hématies au cours du temps.
Cela est vérifié pour des valeurs de concentration en éry-
throcytes d’environ 104éléments/mL. Les résultats à T+0h
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Journal Identification = ABC Article Identification = 0625 Date: September 26, 2011 Time: 2:54 pm
590 Ann Biol Clin, vol. 69, n◦5, septembre-octobre 2011
Biologie au quotidien
mettent en évidence l’absence d’interférence de l’AB sur
le comptage des érythrocytes par l’automate. La figure 1
permet de visualiser ces résultats.
Leucocytes
Les trois essais réalisés sont concordants entre eux et
montrent l’absence d’évolution de la concentration en leu-
cocytes des échantillons urinaires en présence ou en absence
d’AB, quelle que soit la concentration du conservateur
(étude de 13 à 39 g/L) (figure 2).
Cela est vérifié sur une période de 48 h et pour des
concentrations en leucocytes s’étendant de 7 ×103à
4,3 ×106/mL. Les résultats à T+0hmettent en évidence
l’absence d’interférence de l’AB sur le comptage des leu-
cocytes par l’automate.
Bactéries
Tous les essais montrent une augmentation significative de
la concentration bactérienne au cours du temps en l’absence
d’agent de conservation.
Le délai, au-delà duquel l’inoculum bactérien est significa-
tivement différent, varie selon la concentration bactérienne
initiale dans l’échantillon. Ainsi, pour une concentration
bactérienne initiale égale à 80 000 UA/mL, les valeurs
sont similaires jusqu’à 8 h après la première mesure, mais
diffèrent significativement au bout de 24 h. Lorsque la
concentration bactérienne initiale est 100 fois plus impor-
tante, il existe une différence significative dès la troisième
heure après la première mesure. Ce même délai est retrouvé
avec une concentration initiale égale à 200 000 UA/mL
(pool C).
Nous constatons également que les concentrations bac-
tériennes ne sont pas modifiées au cours du temps en
présence de concentration plus élevée d’AB, jusqu’à 39 g/L.
Les résultats à T+0h mettent en évidence l’absence
d’interférence de l’AB sur le comptage des bactéries par
l’automate. Les figures3à5permettent de visualiser ces
différents résultats.
Discussion
Érythrocytes et leucocytes
Les résultats précédents montrent qu’il n’y a pas de modi-
fication significative de la concentration en érythrocytes ou
en leucocytes sur une durée de 48 h en présence ou absence
d’AB. Une étude de Kouri et al. [6] met également en évi-
dence une bonne conservation des leucocytes sur une durée
de 24 h sans conservateur. La qualité de conservation des
érythrocytes est inférieure, mais la présence d’un agent de
conservation est sans effet. Ainsi, pour les éléments figurés,
même si une analyse rapide reste naturellement à privilé-
gier, ces paramètres semblent néanmoins assez stables pour
autoriser une analyse différée à 24 voire 48 h.
Bactéries
Une augmentation de la concentration bactérienne est
démontrée, en l’absence d’agent de conservation, sur un
délai qui varie selon l’importance de l’inoculum bactérien
initial. L’efficacité remarquable de l’AB en tant que conser-
vateur est mise en évidence par l’allure des courbes, qui tend
également à relativiser la valeur de la concentration en AB.
Cette même efficacité est retrouvée dans de nombreuses
études [4, 6, 7].
À noter que pour Lum et Meers [8], l’effet de l’AB semble
être indépendant de l’action de tout autre antibiotique éven-
tuellement présent dans le milieu.
Une étude révèle l’importance de l’espèce bactérienne
impliquée [9]. Si la croissance est exponentielle pour
l’ensemble des bactéries, la phase de latence est variable
selon l’espèce. Au contraire d’Escherichia coli ou des
entérocoques, les staphylocoques présentent une phase
de latence plus importante. Ainsi, selon ces auteurs, le
délai de prise en charge de l’urine peut être admis-
sible jusqu’à 4 h après l’émission. Néanmoins, l’ensemble
des référentiels préconise, à défaut d’une analyse dans
les 2 h après le recueil, une méthode évitant la pul-
lulation bactérienne telle que la conservation à + 4 ◦C
0
5000
10000
15000
20000
50403020100
Délai (en h )
Erythrocytes (/mL)
[AB] = 0 g/L
[AB] = 13g/L
[AB] = 26g/L
[AB] = 39g/L
Figure 1. Conservation des érythrocytes dans le temps en fonction du mode de conservation (pool C).
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Journal Identification = ABC Article Identification = 0625 Date: September 26, 2011 Time: 2:54 pm
Ann Biol Clin, vol. 69, n◦5, septembre-octobre 2011 591
Conservation des urines pour analyse sur UF 1000i
ou le recours à un milieu de transport contenant de
l’AB.
Bien que le manuel utilisateur de l’automate UF 1000i
(bioMérieux©) émette des réserves quant aux données
de l’analyse lorsque des conservateurs sont présents dans
les échantillons urinaires testés, les résultats précédents
mettent en évidence l’absence d’interférence de l’AB pour
le dénombrement par l’automate des érythrocytes, leuco-
cytes et bactéries. L’utilisation de récipients contenant de
l’AB pour le recueil, le transport et le stockage des échan-
tillons urinaires est donc compatible avec une analyse par
fluoro-cytométrie en flux sur l’automate d’analyse urinaire
UF 1000i (bioMérieux©).
Conclusion
Dans le cadre de l’accréditation des laboratoires de bio-
logie médicale, la validation des méthodes et procédures
est une des nombreuses exigences de la norme NF EN
ISO 15189. La phase pré-analytique représente la pre-
mière étape de la prise en charge des échantillons et ce
travail a évalué la conservation des échantillons urinaires
en vue d’une analyse sur l’automate d’analyse urinaire
UF 1000i (bioMérieux©). L’ajout d’AB, en tant qu’agent
de conservation, s’avère très efficace pour prévenir la crois-
sance bactérienne. En revanche, son utilité apparaît moindre
pour la conservation des érythrocytes et leucocytes dans les
0
2000
4000
6000
8000
10000
12000
14000
50403020100
Délai (en h)
Leucocytes (/mL)
[AB] = 0g/L
[AB] = 13g/L
[AB] = 26g/L
[AB] = 39g/L
Figure 2. Évolution du nombre de leucocytes en fonction du délai et du mode de conservation (pool C).
0
50 000
100 000
150 000
200 000
250 000
50454035302520151050
Délai (en h)
Bactéries (/mL)
[AB] = 0g/L
[AB] = 13g/L
Figure 3. Évolution de l’inoculum bactérien au cours du temps en fonction du mode de conservation (pool A).
0
20 000 000
40 000 000
60 000 000
80 000 000
100 000 000
50454035302520151050
Délai (en h)
Bactéries (/mL)
[AB] = 0g/L
[AB] = 13g/L
Figure 4. Évolution de l’inoculum bactérien au cours du temps en fonction du mode de conservation (pool B).
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Journal Identification = ABC Article Identification = 0625 Date: September 26, 2011 Time: 2:54 pm
592 Ann Biol Clin, vol. 69, n◦5, septembre-octobre 2011
Biologie au quotidien
0
200000
400000
600000
800000
1000000
1200000
1400000
1600000
1800000
50403020100
Délai (en h)
Bactéries (/mL)
[AB] = 0g/L
[AB] = 13g/L
[AB] = 26g/L
: [AB] = 39g/L
Figure 5. Évolution de l’inoculum bactérien au cours du temps en fonction du mode de conservation (pool C).
échantillons urinaires sur une durée expérimentale de 48 h.
Une concentration plus importante en AB, simulant un rem-
plissage inadéquat d’un flacon d’urine ne modifie pas les
résultats. Enfin, l’AB n’interfère pas avec le dénombrement
des érythrocytes, leucocytes et bactéries par l’UF 1000i.
Son utilisation est totalement adaptée pour la conserva-
tion des échantillons urinaires en vue d’une analyse sur
l’automate UF 1000i (bioMérieux©).
Conflits d’intérêts : aucun.
Références
1. SFM, ed. Examen cytobactériologique des urines.3
eédition ed.
REMIC. Référentiel en Microbiologie Médicale, 2007 ; 2M2.
2. Afssaps. Diagnostic et antibiothérapie des infections urinaires bacté-
riennes communautaires chez l’adulte. 2008.
3. Watson PG, Duerden BI. Laboratory assessment of physical and chemi-
cal methods of preserving urine specimens. J Clin Pathol 1977 ; 30 : 532-6.
4. Lauer BA, Reller LB, Mirrett S. Evaluation of preservative fluid for
urine collected for culture. J Clin Microbiol 1979 ; 10 : 42-5.
5. Afnor. NF EN ISO 15189. Laboratoires d’analyses de biologie médi-
cale. Exigences particulières concernant la qualité et la compétence.
2007 ; 1-40.
6. Kouri T, Vuotari L, Pohjavaara S, Laippala P. Preservation of urine
for flow cytometric and visual microscopic testing. Clin Chem 2002;48:
900-5.
7. Gillespie T, Fewster J, Masterton RG. The effect of specimen pro-
cessing delay on borate urine preservation. J Clin Pathol 1999;52:
95-8.
8. Lum KT, Meers PD. Boric acid converts urine into an effective bacte-
riostatic transport medium. J Infect 1989 ; 18 : 51-8.
9. Wheldon DB, Slack M. Multiplication of contaminant bacteria in urine
and interpretation of delayed culture. J Clin Pathol 1977 ; 30 : 615-9.
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.
1
/
5
100%