P2 UE 8 JJH Morphologies et structures bactériennes 130217 (word)

UE 8 - De l’agent infectieux à l’hôte
Jean Jacques Hoareau
Date : 13/02/17 Plage horaire : 14h-16h
Promo : P2 2016 -2017
Ronéistes : GOULED Talïé,
DCP Antoine,
METZGER Valentin
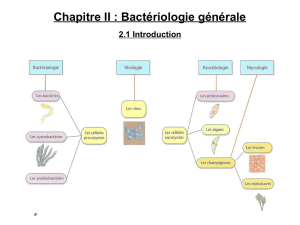
La cellule bactérienne:
Morphologie et Structure bactériennes.

Sommaire :
I. Généralités
1. Qu’est-ce qu’une bactérie ?
2. La place des bactéries dans le règne vivant
3. Organisation des cellules eucaryotes et procaryotes
4. Morphologies bactériennes
A. Les formes
B. L’arrangement caractéristique
II. Structures cellulaires
1. Les composants obligatoires
A. La membrane cytoplasmique
B. Le cytoplasme (cytosquelette, nucléoïde, corps d’inclusions…)
C. La paroi (structure, caractéristiques)
2. Les structures facultatives
A. La capsule, couche mucoïde, couche S
B.Pili et Fimbriae
C.Les flagelles et la chimiotaxie
D.Les spores
E. Les plasmides
a) Conjugatifs
b) De résistance
c) Bactéricides
d) De virulence
e) Métaboliques
III.Taxonomie
1. Taxonomie moléculaire
2. Classification médicale!

I. Généralités
1. Qu’est-ce qu’une bactérie ?
Les bactéries ont été découvertes pour la première fois à la fin du XVIIème siècle par A. Van
Leeuwenhoek qui a appelé les bactéries animalcules (animaux minuscules).
Ce n’est qu’au XIXème siècle que l’on découvre leur rôle dans la fermentation (L. Pasteur) et la
transmission de pathologies (Robert Koch (prix Nobel en 1905)), qui a donné son nom aux ba-
cilles de Koch, (agents de la tuberculose).
2. La place des bactéries dans le règne vivant
De façon globale, quand on s'intéresse aux agents infectieux étant pathogènes pour l’homme on en
compte aujourd’hui 1600, dont une grosse moitié (entre 700 et 800) étant des bactéries, donc le
mieux, c'est de les connaitre.
On distingue les eucaryotes (vrai noyau) avec les procaryotes (cellules qui n’ont pas de noyau).
Parmi les procaryotes dont on verra différentes familles et différents genres ayant leurs particulari-
tés, on devra bien distinguer les archées des bactéries.
Bien heureusement les seuls procaryotes ayant un pouvoir pathogène pour l’homme sont les bac-
téries, les archées en sont dépourvues.

On peut comparer les ordres de grandeur des différents êtres
vivants. Certains parasites (vers intestinaux) peuvent être plus
grand que l’homme.
En terme d’échelle, les bactéries sont majoritairement des
êtres unicellulaires dont la taille est de l’ordre du micromètre
(allant de 0 et 200 micromètres). C’est à peu près la taille
d’une mitochondrie c’est à dire qu’il y a des bactéries plus
grandes que les mitochondries voire plus grande que certaines
cellules humaines.
De 10 à 100 fois plus petits que les bactéries on retrouvera les
virus.
Les bactéries étant de l’ordre du micromètre sont visibles au
microscope photonique classique. Vous verrez que malgré tout
en TP, avec un grossissement minimum de x1000 les bactéries
apparaissent encore assez petites. Par contre, les virus qui
n’appartiennent pas au monde du vivant ne sont pas visibles
au microscope photonique et il faudra passer au microscope
électronique.
En ce que concerne les agents infectieux qui sont encore
considérés comme non vivants (les prions), ils appartiennent
aux agents transmissibles non conventionnels (ce sont des pro-
téines de l’ordre de 100 à 1000 fois plus petits que les virus).

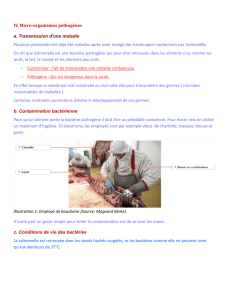
Les bactéries sont en contact permanent avec l’homme, dans 90% des cas, lorsque l’on va dévelop-
per une pathologie suite à une infection par une bactérie, c’est souvent une auto-contamination.
Ce sont des bactéries, pas forcément pathogènes (opportunistes), qui ont eu l’occasion de rentrer
(par l’intermédiaire d’une blessure…) et vont pouvoir se multiplier et se développer. Donc, cer-
taines bactéries sont capables d’envahir le corps humain et de le coloniser, mais si l’on regarde le
monde bactérien ça ne représente qu’une toute petite fraction : ce qui veut dire que la majorité
des bactéries, au contraire, sont bénéfiques. Il ne faut donc pas voir les bactéries comme quelque
chose de forcément mauvais, il y en a qui sont en contact permanent avec nous, nos tissus, vivent en
équilibre avec nous et au contraire empêchent les bactéries pathogènes de se développer. Il faut
donc protéger cette flore bactérienne notamment celle du tube digestif qui permet de dégrader les
matières végétales, certaines produisent même des vitamines, et si nous respirons c’est grâce aux
bactéries notamment qui sont capables de participer à la synthèse d’oxygène.
Voici l’arbre du vivant (avec
ses branches mortes) global
avec les espèces actuelles et
éteintes. On retrouve le
groupe des eucaryotes (au-
quel on appartient) ainsi
que le groupe des bactéries
qui occupent plus du tiers
de l’arbre du vivant : donc
elles sont très nombreuses
et diversifiées au sein du
monde vivant.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
1
/
30
100%