10.11. - 08.01.10

1 / 7
Analyse des évènements indésirables suspectés à la suite d’une
vaccination contre la grippe pandémique (H1N1) 2009 en Suisse
Annonces issues de la banque de données PaniFlow du 10 novembre au 8 janvier
2010
Ce document analyse les annonces d’événements indésirables suspectés à la suite d’une
vaccination contre la grippe pandémique (H1N1) 2009 en Suisse après 2 mois d’utilisation
des vaccins.
Dans ce cadre, Swissmedic, en collaboration avec le Monitoring Centre d’Uppsala et l’OMS,
a développé un système d’annonce spontanée en ligne sous le nom de PaniFlow qui
enregistre les annonces faites par les professionnels de la santé. Pour des informations
complémentaires concernant PaniFlow, se référer au Portail Pandémie de Swissmedic
(www.swissmedic.ch/pandemieportal.asp)
Le premier cas a été déclaré le 10 novembre 2009. Depuis lors et jusqu’au 8 janvier 2010
inclus, on compte un total de 489 annonces qui ont pu être analysées. Il est à noter que le
tableau ci-dessous et l’analyse des évènements indésirables suspectés n’auraient pu être
réalisés sans l’aide et l’engagement des professionnels de la santé pour déclarer les cas
dans le système en ligne PaniFlow.
Figure 1 :
Vue d’ensemble des annonces dans la base de données PaniFlow
En date du 8 janvier 2010
0
100
200
300
400
500
600
1 2 3 4 5 6 7 8 9
Nombre
cumulatif
d’annonces
Nombre
d’annonces
par semaine
Nombre d’annonces
Semaine

2 / 7
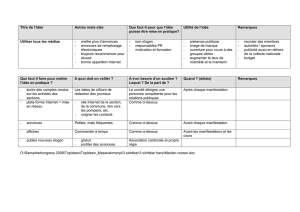
Généralités
Les annonces d’effets indésirables suspectés enregistrées ci-dessus doivent remplir certains
critères. Une déclaration peut comporter un ou plusieurs évènements indésirables
(réactions) suspectés. Le nombre de réactions peut donc être plus élevé que le nombre de
déclarations. Dans la mesure où seule une partie des évènements indésirables survenus
sont effectivement annoncés, il n’est pas possible d’effectuer un calcul de la
fréquence des évènements. Toute comparaison entre les différents vaccins sur la base de
ces données est également impossible. Le pourcentage de la population vaccinée en Suisse
est actuellement en cours d’analyse à l’OFSP. Les annonces d’effets indésirables qualifiés
de non graves ne sont pas traitées séparément mais sont inclues dans le total général.
Dans le cadre de la pharmacovigilance, les évènements sont à qualifier de graves lorsqu'ils
sont classés comme médicalement importants ou conduisent à (ou prolongent) une
hospitalisation, occasionnent un handicap permanent, une malformation chez un nouveau-
né, sont susceptibles d'entraîner la mort respectivement sont mortels. Est à qualifier
d'attendu un évènement mentionné comme effet indésirable dans l'information
professionnelle du produit concerné.
Important
Les annonces-type décrivent des évènements indésirables suspectés survenant dans un
délai donné après une vaccination. Une relation de causalité ne peut généralement pas être
déterminée d’emblée sur la base de la seule déclaration. Les évènements peuvent être
secondaires à l’administration du vaccin mais également survenir par hasard à la suite d’une
vaccination. Déterminer l’imputabilité d’évènements indésirables suspectés implique une
analyse complémentaire soigneuse. Une relation de causalité ne peut être confirmée que si
le diagnostic correspondant est assuré et les étiologies alternatives possibles exclues.
Tableau récapitulatif des annonces d’effets indésirables suspectés après vaccination avec des
vaccins pandémiques antigrippaux.
Nombre total d’annonces 489
Nombre d’annonces comportant une réaction grave et attendue 101
Nombre d’annonces comportant une réaction grave et inattendue 82
Nombre d’annonces chez des femmes enceintes 16
Nombre d’enquêtes en cours 26
Le : 8.01.2010
Conclusion
En date du 8 janvier 2010, 2’968’880 doses de vaccins ont été délivrées aux cantons
(286'250 doses de Focetria®, 985'330 doses de Celtura® 1'697’300 doses de Pandemrix®).
Jusqu’au 8 janvier 2010 inclus, 489 annonces ont été reçues, décrivant 1365 évènements
indésirables suspectés. Dans la majorité des cas, il s’agit de réactions limitées et bénignes
localisées au site d’injection ou de réactions généralisées de type céphalées, fièvre,
nausées, douleurs musculaires et articulaires.
82 annonces ont été classées comme graves et inattendues. 36 annonces sur 82 sont des
réactions médicalement importantes pour lesquelles l’imputabilité vaccinale a été exclue en
raison de causes médicales plus vraisemblables et/ou d’une évolution chronologique non
plausible.

3 / 7
Swissmedic échange confidentiellement chaque semaine les données concernant la sécurité
des vaccins pandémiques avec les Autorités d’autres pays. L’Institut va continuer à surveiller
étroitement le profil sécuritaire des 3 vaccins utilisés, et en particulier les réactions
allergiques, les problèmes musculaires, articulaires et neurologiques ainsi que certaines
populations spécifiques à savoir les femmes enceintes et les enfants. A ce jour, les
évènements indésirables déclarés correspondent à ceux décrits dans les études cliniques et
au profil sécuritaire issu de l’expérience post-marketing acquise avec les vaccins contre la
grippe saisonnière. Les évènements indésirables rapportés en relation avec les vaccins
pandémiques correspondent également à ceux observés dans les autres pays utilisant les
mêmes vaccins.
En moyenne, 167 personnes décèdent quotidiennement en Suisse selon les statistiques
officielles de décès. En Europe de l’ouest, le nombre de morts néo-natales est d’environ
4/1000. L’incidence moyenne annuelle de la paralysie faciale est de plus de 10/100.000 et
celle du syndrome de Guillain-barré (SGB) de plus de 1/100.000 dans des conditions
normales et sachant que leur fréquence augmente avec l’âge. Une relation chronologique
entre un évènement indésirable grave et une vaccination peut donc être purement fortuite.
Ainsi, lors de campagnes de vaccination contre la grippe saisonnière en Suisse, des cas
isolés de décès sont annoncés. Chacune de ces annonces est évaluée avec soin par
Swissmedic. L'expérience actuelle confirme que, chaque fois, des affections graves sous-
jacentes (ex: du système cardio-vasculaire, des poumons ou des voies respiratoires) étaient
en cause. Une relation avec la vaccination contre la grippe saisonnière ne peut en aucun cas
être documentée de manière concluante.
Une évaluation des annonces d’évènements indésirables suspectés pour chaque vaccin est
fournie ci-dessous. La différence de distribution de ces évènements est à rapporter au
nombre variable de doses vaccinales utilisées et aux différentes recommandations de santé
publique pour chacun des 3 vaccins autorisés en Suisse.
I. Celtura®
En date du 8 janvier 2010 , 28 annonces (22 femmes et 6 hommes) pour un total de 85
évènements indésirables concernant Celtura® ont été reçues.
1 décès est survenu chez un patient âgé de plus de 80 ans présentant une maladie
chronique. L’imputabilité du vaccin a été exclue
5 annonces sur 28 décrivent une réaction allergique (tel un rash urticarien), effet secondaire
potentiel connu du vaccin.
1 annonce concerne un épisode d’arthrite chez un patient présentant une anamnèse
d’arthrite pré-existante.
7 annonces sur 28 décrivent des symptômes neurologiques transitoires tels troubles visuels,
vertiges ou anomalie sensorielle. Les paresthésies (sensation de brûlure, de picotement,
hypoesthésie) sont des réactions secondaires potentielles connues du vaccin. Il n’a pas été
observé de progression vers une maladie grave. 1 annonce sur 7 décrit une fièvre post-
vaccinale accompagnée de troubles sensoriels transitoires (phénomène d’Uthoff) ayant
totalement régressé chez une personne présentant une anamnèse de sclérose en plaques.
1 annonce décrit un avortement spontané durant le premier trimestre de grossesse survenu
plus de 30 jours après une vaccination par Celtura®. Le médecin en charge de la patiente
considère que l’imputabilité du vaccin peut être exclue.

4 / 7
3 annonces sur 28 concernent des enfants de moins de 16 ans ( l’un de moins de 3 ans ) et
décrivent des réactions au point d’injection, un état fébrile et/ou une gêne gastrique
disparaissant spontanément.
Figure 2: Celtura®
Évènements indésirables suspectés (ADRs) classés selon le « system organ class » (SOC)
Note concernant le diagramme : Le SOC décrit comme “Empty” se réfère à une entrée de texte libre ne correspondent pas à un
terme standardise.
II. Focetria®
En date du 8 janvier 2010 , 50 annonces (32 femmes et 18 hommes) pour un total de 126
évènements indésirables concernant Focetria® ont été reçues.
9 annonces sur 50 décrivent des réactions allergiques (rash urticarien, oedème des lèvres et
de la langue, gène respiratoire), les cas les plus sévères nécessitant une prise en charge
médicale immédiate. Les réactions allergiques sont décrites dans l’information
professionnelle du vaccin.
1 annonce sur 50 décrit une thrombocytopénie (nombre de plaquettes abaissé) modérée et
transitoire. Elle a été mise en évidence sur la numération formule sanguine du patient en
l’absence de symptômes cliniques et a disparu spontanément. La thrombocytopénie est
décrite dans l’information professionnelle du vaccin.
1 annonce sur 50 comporte une perte de connaissance transitoire après vaccination, à
imputer à la procédure d'injection elle-même et non pas au vaccin. 5 annonces sur 50
décrivent des symptômes neurologiques transitoires tels troubles visuels, vertiges ou
paresthésies (sensation de brûlure, de picotement, d’hypoesthésie). 3 annonces sur les 50
décrivent le cas d’une femme enceinte ayant présenté une paralysie faciale. La survenue
d’une névrite, comme une paralysie faciale, est décrite dans l’information professionnelle du
vaccin mais d’autres causes potentielles, y compris infectieuses, doivent être prises en
compte.
En date du 8 janvier 2010

5 / 7
2 annonces sur 50 décrivent la survenue d’un zona. Dans 1 cas, il s’agit d’un garçon de 15
ans. Le zona n’est pas un évènement indésirable attendu décrit avec Focetria®
L’imputabilité du vaccin n’a pas été établie mais ce type d’annonce est étroitement surveillé.
6 annonces sur 50 décrivent des douleurs articulaires, 1 cas sur 6 décrivant la survenue
d’une arthrite chez un patient avec arthrite inflammatoire préexistante.
13 annonces sur 50 concernent des femmes enceintes. 1 cas sur 13 décrit un
déclenchement du travail prématuré, traité médicalement avec succès chez une patiente
dont l’anamnèse comporte un évènement similaire lors d’une grossesse antérieure. 6 cas
sur 13 décrivent une mort foetale in utéro. Swissmedic a terminé l’analyse de 3 cas sur les 6.
Dans ces 3 cas, d’autres facteurs plausibles peuvent avoir conduit à cette issue
malheureuse. L’imputabilité vaccinale a été estimée improbable. Les autres cas sont encore
en cours d’investigation.
22 annonces sur 50 concernent des enfants de moins de 16 ans. 1 cas sur 22 décrit un
épisode convulsif en l’absence de fièvre chez un enfant présentant une maladie
neurologique connue. L’imputabilité du vaccin n’a pas été établie. Dans 1 cas sur 22 , il s’agit
d’une infection virale par le H1N1 confirmée ayant guéri spontanément chez un enfant de
moins de 3 ans vacciné par Focetria® plus de 10 jours avant la survenue de la maladie. 14
annonces sur 22 concernent des enfants de moins de 3 ans ayant présenté une fièvre
transitoire, des vomissements, une anxiété, et des réactions allergiques.
Figure 3: Focetria®
Évènements indésirables suspectés (ADRs) classés selon le « system organ class » (SOC)
Note concernant le diagramme: Le SOC décrit comme “Empty” se réfère à une entrée de texte libre ne correspondent pas à un
terme standardise. Par convention, le système de pharmacovigilance utilise par Swissmedic code toute exposition à un
medicament au cours de la grossesse sous SOC 1500 “Foetal disorders”. SOC 1500 n’est pas nécessairement un évènement
indésirable foetal.
En date du 8 janvier 2010
 6
6
 7
7
1
/
7
100%