Régulation du trafic de surface des recepteurs au

Université de Bordeaux Segalen
Année 2013 Thèse n°2120
THESE
pour le
DOCTORAT DE L’UNIVERSITE DE BORDEAUX 2
ECOLE DOCTORALE SCIENCES DE LA VIE ET DE LA SANTE
Mention : Sciences, Technologie, Santé
Option : Neurosciences
Présentée et soutenue publiquement
Le 10 décembre 2013
Par Anne-Sophie Hafner
Née le 3 mai 1986 à Suresnes
Régulation du trafic de surface des
recepteurs au glutamate de type AMPA via l'intéraction de leurs
protéines auxiliaires avec la proteine d'échafaudage PSD-95.
Membres du jury
Stuart Cull-Candy
Professeur University College London
Président
Julie Perroy
Chargé de Recherche CNRS
Rapporteur
Susumu Tomita
Professeur Associé Yale School of Medicine
Rapporteur
Nathalie Sans
Chargé de Recherche INSERM
Examinateur
Bernd Fakler
Professeur University of Freiburg
Examinateur
Patricio Opazo
Post-Doctorant Max Planck Institute
Membre invité
Daniel Choquet
Directeur de Recherche CNRS
Directeur de thèse

University of Bordeaux Segalen
Year 2013 Thesis n°2120
A THESIS
submitted to the
UNIVERSITY OF BORDEAUX 2
for the
DEGREE OF DOCTOR OF PHILOSOPHY
ECOLE DOCTORALE SCIENCES DE LA VIE ET DE LA SANTE
Mention: Sciences, Technologie, Santé
Option: Neurosciences
Presented publicly
on december 10th 2013
by Anne-Sophie Hafner
born on may 3rd 1986 in Suresnes
Regulation of AMPA receptor surface trafficking
through auxiliary protein interaction with PSD-95
Members of the jury
Stuart Cull-Candy
Professor University College London
President
Julie Perroy
Research associate at CNRS
Reporter
Susumu Tomita
Associate professor at Yale School of Medicine
Reporter
Nathalie Sans
Research associate at INSERM
Examiner
Bernd Fakler
Professor at University of Freiburg
Examiner
Patricio Opazo
Post-Doctoral fellow at the Max Planck Institute
Invited member
Daniel Choquet
Principal investigator at CNRS
Supervisor

L’essentiel à savoir en langue française
Le cerveau adulte contient plus de cent million de neurones, chaque neurone
étant connecté à des milliers d’autres (Garner et al. 2002). Comprendre comment
ces cellules interagissent pour donner forme à des comportements complexes et
permettre la mise en place de nombreuses formes de mémoire est un défit
ambitieux de premier ordre. Après plus d’un siècle de recherche en neurosciences,
nous savons que le stockage de la mémoire dans le cerveau implique la modification
par l’expérience de la force des connections neuronales appelées synapses. Les
neurones sont l’unité fonctionnelle du système nerveux central (SNC) bien qu’ils
soient dix fois moins nombreux que les cellules gliales dans le système nerveux des
vertébrés. En effet, ils sont les seuls à pouvoir efficacement recevoir, organiser et
transmettre l’information. Les neurones sont des cellules différentiées avec une
organisation spatiale très spécialisée. A partir du corps cellulaire (ou soma) émerge
deux types de neurites: les dendrites et l’axone. Les dendrites reçoivent
l’information qui est transmise au soma puis à l’axone.
Les dendrites sont le continuum du corps cellulaire. Les branches dendritiques
comportent la plupart des organelles cellulaires (réticulum endoplasmique,
appareil de Golgi, endosomes, lysosomes, mitochondria). De multiples branches
dendritiques émergent du soma, leur diamètre diminuant avec la distance au corps
cellulaire. Elles sont organisées en une arborisation dendritique et parsemées de
milliers de synapses chimiques et électriques qui reçoivent des influx nerveux de
neurones situés de quelques micromètres à plusieurs centimètres de distance. A la
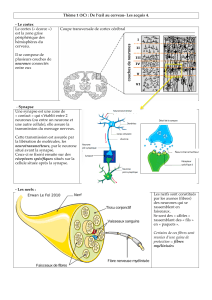
synapse chimique – le sujet de cette thèse – la membrane du neurone pré-
synaptique (neurone transmettant l’information) est apposée (20-25 nm) à la
membrane du neurone post-synaptique (neurone recevant l’information). L’espace
séparant les deux membranes est appelé la fente synaptique.
L’axone émerge du corps cellulaire ou d’une dendrite proximale et est le plus
souvent unique. C’est le seul signal de sortie du neurone. L’axone peut être
subdivisé en trois segments : le segment initial où sont générés les potentiels
d’action (PA) ; le segment principal où se propage le PA ; et le terminal ou bouton
synaptique où le signal électrique est traduit en signal chimique grâce aux canaux
calciques voltage-dépendants qui permettent la libération dépendante de l’activité
de neurotransmetteur dans la fente synaptique (Dunlap et al. 1995).
Le terme synapse vient du grec synapsis qui signifie « co-jonction » (fait d’être
joint) et fut introduit en 1897 par les physiologistes anglais Michael Foster et
Charles Sherrington (Tansey 1997). Sept années plus tard, Thomas Elliot et John
Langley montrent pour la première fois que la transmission nerveuse est assurée
par des messagers chimiques appelés neurotransmetteurs qui se lient à des
récepteurs spécifiques localisés dans la membrane post-synaptique (Rubin 2007).
1

La grande majorité des communications inter-neuronales dans le SNC est assurée
par les synapses chimiques. L’arrivée d’un PA au bouton pré-synaptique provoque
une augmentation locale de calcium permettant la fusion des vésicules de
neurotransmetteur avec la membrane pré-synaptique. Les molécules de
neurotransmetteur ainsi libérées dans la fente synaptique lient leurs récepteurs
spécifiques au niveau de la membrane post-synaptique. Ces récepteurs vont alors
traduire le message chimique en un signal électrique dans le neurone post-
synaptique.
Dans le SNC, il existe trois types de synapses classées en fonction du
neurotransmetteur qu’elles libèrent : excitatrices, majoritairement
glutamatergiques ; inhibitrices (glycinergiques ou GABAergiques) ; et modulatrices
(majoritairement serotoninergiques, dopaminergiques et peptidergiques). Les
synapses peuvent se former directement sur les branches dendritiques ou au niveau
de petites protrusions de quelques micromètres émergeant des dendrites appelées
épines et qui ont attiré l’attention de nombreuses recherches. Alors que les
synapses inhibitrices sont exclusivement dendritiques, les synapses excitatrices se
situent elles soit au niveau des branches (sur les neurones inhibiteurs ou durant le
développement) soit sur les épines. Dans le cerveau adulte, plus de 90 des
synapses sur les neurones excitateurs sont de type épine.
Les synapses glutamatergiques ont fait l’objet de nombreuses études
notamment du fait qu’elles présentent de multiples formes de plasticité
– modification par l’activité de l’efficacité synaptique. Ces 40 dernières
années, les indications mettant en lien ces modifications des synapses
glutamatergiques et les phénomènes de mémoire n’ont cessé de
s’étayer.
Il existe deux types de récepteurs du glutamate. Les récepteurs métabotropiques
et les récepteurs ionotropiques, récepteurs de type canaux ioniques dont l’ouverture
est assujettie à la fixation d’un ligand ici le glutamate. Les récepteurs ionotropiques
permettent la transmission synaptique en convertissant le message chimique qu’est
la libération de glutamate par le neurone pré-synaptique en un signal électrique que
représente le flux d’ion dans le neurone post-synaptique. Ils sont divisés en trois
groupes qui sont activés par différents agonistes : récepteurs NMDA (rNMDA),
récepteurs AMPA (rAMPA), récepteurs kainate.
Les rNMDA sont des détecteurs de coïncidence à savoir que le canal
s’ouvre uniquement lorsque deux évènements arrivent simultanément.
Ils ont deux caractéristiques majeures : a) Le canal est obstrué de
manière voltage-dépendante par un ion Mg2+. Au potentiel de repos le
canal est bloqué et celui-ci ne s’ouvre que quand le neurone est déjà
dépolarisé, par exemple lors de l’activité synaptique. b) Lorsque le
canal est ouvert il est hautement perméable au Ca2+, qui active de
nombreuses cascades intracellulaires. Ainsi, ces récepteurs sont impliqués
2

dans l’induction de la plasticité à long-terme qui peut durer de quelques heures à
plusieurs jours.
Les rAMPA sont majoritairement responsables des courants
excitateurs rapides et leur nombre détermine pour bonne partie
l’intensité de la transmission synaptique. Etant donné que le modèle
actuel pour le stockage de l’information dans le cerveau implique la
modulation de l’efficacité synaptique, il est fort probable que
comprendre les mécanismes de régulation du trafic des rAMPA nous
informe sur les bases de la mémoire au niveau moléculaire.
Les variations dans le nombre de rAMPA à la synapse sont suspectées d’être à la
base de nombreux phénomènes de plasticité en particulier dans l’hippocampe.
Toutefois, on connait encore très peu de choses sur les mécanismes de stabilisation
des rAMPA à la synapse. Cette ignorance résulte au moins en partie de la toute
récente identification de la nature des différents composants associés aux
complexes macromoléculaires des rAMPA. En effet, les rAMPA ont longtemps été
considérés comme des récepteurs solitaires à la surface des cellules. Mais en 2000,
la découverte de la première protéine auxiliaire des rAMPA, la protéine stargazin
(ou TARP -2), par le groupe de Roger Nicoll a révolutionné notre compréhension
des rAMPA (Chen et al. 2000). Depuis, le nombre de protéines auxiliaires des
rAMPA n'a cessé de croître. Contrairement à ce qu'était la pensée commune
pendant longtemps, la grande variété de rAMPA n’est pas uniquement dictée par
leur composition en terme de sous-unités mais également par les différentes
auxiliaires qui le décorent. Comment la composition du complexe
macromoléculaire des rAMPA peut influencer leur stabilisation à la synapse ? Est-
ce que les différentes protéines auxiliaires peuvent être responsables de différents
types de plasticité dans le cerveau ? Toutes ces questions sont désormais ouvertes
pour de nouvelles recherches.
La densité post-synaptique est une région dense aux électrons en microscopie
électronique, située généralement à la tête de l’épine dendritique. Le nombre de
densités dans une épine est étroitement corrélé avec l’intensité de la transmission
synaptique. La fonction d’une densité post-synaptique est essentiellement de
concentrer un grand nombre de protéines diverses en face des sites de libération de
neurotransmetteur.
PSD-95 est la protéine d’échafaudage la plus abondante de la
densité post-synaptique et elle joue un rôle majeur dans l’organisation
protéique de cette densité. A la synapse excitatrice mature, PSD-95 est localisée
très proche de la membrane plasmique en comparaison avec d’autres protéines
d’échafaudage. Longtemps PSD-95 a été représentée dans les schémas d’articles ou
de revues comme une protéine allongée orientée horizontalement par rapport à la
membrane plasmique. Cette vision a été entièrement remise en cause par la
publication par le groupe de Thomas Reese de reconstructions à partir d’images de
3
 6
6
 7
7
 8
8
 9
9
1
/
9
100%