Distillation : Toluène, Cyclohexane, Morpholine - Chimie Organique

Travaux Pratique
Chimie Organique IA
Semestre d’été 2009
29 avril 2009 - 1 - Coralie Fournier
Distillation simple, fractionnée et sous pression réduite de composé connu et
inconnu

Travaux Pratique
Chimie Organique IA
Semestre d’été 2009
29 avril 2009 - 2 - Coralie Fournier
1. But de l’expérience
Le but de cette expérience est de se familiariser avec une autre méthode de séparation
et purification d’un produit, la distillation.
Tout d’abord, purifier le toluène par une distillation simple. Séparer les deux produit
d’un mélange inconnu, par distillation fractionnée. Puis déterminer la pureté de chaque fraction récoltée.
Préparation et purification, par distillation sous pression réduite, d’un ester d’un acide
carboxylique.
2. Principe de la méthode
La distillation est une méthode courante pour purifier les liquides. Elle consiste à
vaporiser un liquide, puis à condenser la vapeur en recueillant le distillat. Si les impuretés ne sont pas
volatile, alors une distillation simple suffira car les impuretés resteront dans le résidu. Sinon une
distillation fractionnée sera nécessaire.
Le point d’ébullition d’un produit dépend de la pression, c’est pourquoi la distillation à
pression réduite est nécessaire lorsque le point d’ébullition est trop haut. Il est alors abaissé en
réduisant la pression.
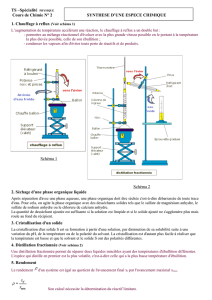
3. Distillation simple : le toluène
Volume fraction 1 : V = 6.7 mL Volume fraction 2 : V = 36.5 mL Volume résidu: V =4.9 mL
3.1 Partie expérimentale
Mettre 50 mL de toluène dans un ballon rond à 2 cols, puis faire le montage d’une
distillation simple. Le toluène est chauffé jusqu’à ébullition, les premières gouttes de distillats sont alors
récupérées dans un premier ballon. Après changement du ballon, le reste de distillats est récupéré, il
s’agit du toluène pur.
3.2 Résultats
Tableau N°1 : Volume des deux récoltes et du résidu
Distillat
Masse [g]
Volume [mL]
Masse molaire
du toluène
[g/cm3]
1
5.80
6.73
0.86
2
31.5
36.5
0.86
Résidu
4.20
4.87
0.86
Somme des
volumes
48.14

Travaux Pratique
Chimie Organique IA
Semestre d’été 2009
29 avril 2009 - 3 - Coralie Fournier
3.3 Discussion
Le premier distillat récolté est trouble, ceci est dû aux impuretés contenues dans le
toluène. Elles sont plus volatiles que le toluène étant donné qu’elles se trouve dans la première fraction
récoltée. Les premières gouttes, qui sont donc principalement des impuretés, sont récoltées lorsque la
température des vapeurs atteignent 30°C. Lors du début du deuxième distillat la température atteint
105°C.
4. Distillation fractionnée : mélange inconnu (ECHANTILLON N°6)
Produit 1 = cyclohexane Produit 2 = morpholine
4.1 Partie expérimentale
Placer 50mL d’un mélange fractionné de deux liquides dans un ballon à 2 cols et faire
le montage d’une distillation fractionnée. Procéder à la distillation en notant, à intervalle régulier, la
température de vapeur. Lorsque la fraction à bas point d’ébullition est passée (récolte du premier
produit) la distillation cesse et le ballon est changé afin de procéder à la récupération du deuxième
produit (à plus haut point d’ébullition). Entre les deux récoltes de produit, une troisième récolte est
effectuée, il s’agit de la transition, là ou il y a encore le mélange des deux produits.
4.2 Résultats
Tableau N° 2 : Données des deux produit récoltés (en rouge sont indiquées les valeurs théoriques)
Distillat
Masse [g]
Volume [mL]
Indice de
réfraction
Point
d'ébullition
[°C]
Produit
Masse
volumique
[g/cm3]
1
24.40
31.52
1.428 (1.426)
75.00 (80-81)
cyclohexane
0.774
2
11.50
11.50
1.455 (1.455)
124.0 (124-128)
morpholine
1.000
Somme des
volumes
43.02
Voir en annexe le tableau N°3.

Travaux Pratique
Chimie Organique IA
Semestre d’été 2009
29 avril 2009 - 4 - Coralie Fournier
Graphique N°1 : Courbe de la température en fonction du volume
Courbe de la température de distillation en fonction du volume
0
20
40
60
80
100
120
140
0 5 10 15 20 25 30 35
Mesure_Volume
Température
4.3 Discussion
Les deux produits récoltés sont le cyclohexane et la morpholine. Les indices de
réfraction obtenus sont très proche de ceux théoriques, ce qui rend l’identification des produits aisée.
De plus les points d’ébullitions sont aussi très proche, voir quasi exacte pour la morpholine, ce qui
élimine tous doutes possible sur la nature des produits.
5 Distillation sous pression réduite
Température où à lieu la distillation : T = 104 °C Rendement : η = 45.83 %
5.1 Schéma et mécanisme de la réaction
€
C6H5COOH +CH3CH2CH2OH H+
← → $ $ C6H5COOCH2CH2CH3+H2O

Travaux Pratique
Chimie Organique IA
Semestre d’été 2009
29 avril 2009 - 5 - Coralie Fournier
5.2 Partie expérimentale
Mettre dans un ballon 31 mL de 1-propanol, 2 mL d’acide sulfurique et 10 g d’acide
benzoique. Tout ceci est chauffé à reflux pendant 3 heures. Enlever l’excès de propanol sur
l’évaporateur rotatif. Verser le liquide résiduel avec un mélange eau-glace dans une ampoule à
extraction, puis séparer notre phase organique et aqueuse trois fois avec à chaque fois des ajouts de
20 mL d’éther. Les phases organiques sont lavées avec successivement des portions de 20 mL de
bicarbonate, d’eau et de chlorure de sodium. La phase organique est ensuite séchée, filtrée, puis
passée au rotavap pour éliminer l’excès d’éther. Le produit est alors distillé sous vide. La différence de
pression indiquée par le manomètre et de 10, par conséquent la température à atteindre est de 100 °C
pour que la distillation ait lieu ( au lieu de 230°C à 760 mmHg). La distillation commence à une
température de 104 °C.
5.3 Résultats
Tableau N°4 : Calcul du rendement
Formule
chimique
Quantité de
départ [g]
Masse
Molaire
[g/mol]
Nombre de
mole [mol]
Masse
théorique de
produit
récupéré [g]
Masse de
produit
récupéré [g]
Rendement
[%]
Acide benzoïque
C7H6O2
9.90
122.1
0.081
-
-
-
1-propanol
C3H8O
25.0
60.10
0.416
-
-
-
Benzoate de propyl
C10H12O2
0.00
164.2
0.081
13.31
6.10
45.83
5.3 Discussion
Lorsque j’ai voulu récupérer mon ballon sur le rotavap après évaporation du propanol,
je l’ai cassé et tout mon produit c’est retrouvé dans la cuve d’eau du rotavap. Il a donc fallu que je
récupère mon produit en effectuant plusieurs extractions. Cela explique que mon rendement soit aussi
faible, j’ai perdu passablement de produit.
 6
6
1
/
6
100%