etude du spectre du soleil

Etude du spectre du Soleil
I
Objectif :
• Déterminer les longueurs d’onde de certaines raies
d’absorption dans une partie du spectre du Soleil.
• Identifier les entités chimiques présentes dans la
chromosphère, enveloppe gazeuse entourant le Soleil.
I/ Etude de documents :
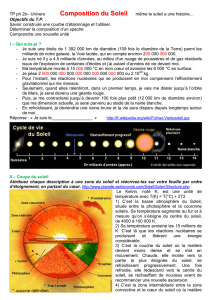
« Dès 1814, le physicien allemand Fraunhofer remarque
la présence de rais boires dans le spectre du Soleil .
Kirchoff mesure la longueur d’onde de plusieurs milliers
de ces raies et montre qu ’elles coïncident avec celles
émises par diverses entités chimiques : hydrogène, calcium,
cuivre, fer, zinc, […]. Il publie, en 1861, le premier atlas
du système solaire. »
Le document de côté présente :
a) Un extrait du spectre visible du Soleil. Les principales
raies d’absorption (repérées par un numéro) sont
représentées par un trait noir.
b) Un extrait du spectre de raies d’émission de l’argon
obtenu avec le même spectroscope. Ces raies (traits
blancs) servent de référence de longueur d’onde.
II/ Exploitation du document :
1) Mesures :
a) Etude du spectre de l’argon :
Mesurer les distances L, en mm, entre la raie
d’émission λ
λλ
λ =
= =
= 390 nm et les autres raies d’émission.
Reporter-les dans le tableau ci-dessous :
λ
λλ
λ
nm
390
L en mm 0

b)Etude du spectre du soleil :
Mesurer les distances en mm, entre la raie d’émission de 390 nm et les différentes raies
d’absorption du spectre du Soleil. Répertorier-les dans un tableau.
2) Questions :
a) Que représente les raies noires dans le spectre de Fraunhofer ?
b) Quel est l’intérêt des travaux de Fraunhofer et de Kirchoff ?
c) Tracer à l’aide du logiciel Regressi , le graphique représentant
λ
λλ
λ
en fonction de L
pour les raies d’émission de l’argon. Le reproduire sur votre copie .
d) Donner la relation mathématique qui lie
λ
λλ
λ
et L
e) En déduire à l’aide de Regressi , les longueurs d’onde des raies d’absorption du
spectre du Soleil.
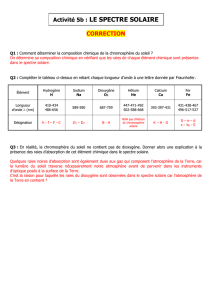
f) A partir des données figurant dans le tableau ci-après, associer à chaque raie
d’absorption l’entité chimique (ion ou atome) présente dans l’atmosphère du
Soleil.
Données : Longueurs d’onde en nm de certaines raies caractéristiques de quelques
entités chimiques
H 656,3 486,1 434
Na 589,0 589,6
Mg 470,3 516,7
Ca 422,7 458,2 526,2 527
Ca
2+
396,8
Fe 438,3 489,1 491,9 495,7 532,8 537,1 539,7
Ti 466,8 469,1 498,2
Mn 403,6
Ni 508,0

III/ Etude documentaire
De quoi sont faites les étoiles ?
« En 1814, l’opticien Joseph Fraunhofer invente un nouvel instrument, le spectroscope,
constitué à partir d’un prisme. En observant la dispersion de la lumière solaire avec son
spectroscope, il découvre 476 raies sombres dans le spectre solaire (voir document ), et il
en mesure soigneusement les positions respectives. En étendant ses recherches aux
spectres des planètes, il constate qu’ils sont identiques à celui du soleil.
En 1860, Bunsen et Kirchhoff s’intéressent à deux raies sombres du spectre solaire. Les
physiciens ont constaté qu’elles coïncident avec les deux raies brillantes du spectre
d’émission de la vapeur de sodium de longueur d’onde : λ=589,0 nm et
λ = 589,6 nm. Pour vérifier cette identité, ils réalisent les expériences décrites au
paragraphe précédent. Ils sont persuadés qu’en plaçant la flamme contenant le sodium
dans la lumière de la lanterne, ils vont observer un renforcement du spectre continu à
l’emplacement des deux raies jaunes du sodium. En réalité, c’est l’inverse qui se produit !
Kirchhoff, d’abord interloqué, propose ensuite une explication : les raies sombres
correspondent à une absence de lumière. Le sodium de la flamme absorbe une partie de la
lumière de la lanterne ; cette partie correspond à la double raie jaune du sodium. Un
élément chimique absorbe la lumière qu’il peut émettre.
Continuant son analyse, il propose que les raies d’absorption dans le spectre du soleil
proviennent des éléments chimiques présents dans l’atmosphère entourant le soleil.
Par comparaison avec les spectres connus d’émissions d’éléments (calcium, hydrogène,
sodium, …), il identifie 463 raies sur 476. les 13 autres raies correspondent à un élément
nouveau, l’hélium qui sera découvert en 1868. »
Structure du soleil :
Le soleil est une boule de gaz. Sa surface, appelée photosphère, est constituée d’une
mince pellicule gazeuse dont la température moyenne est d’environ 5 500°C. C’est
cette partie du soleil qui nous éclaire.
La photosphère est enveloppée par l’atmosphère du soleil (Chromosphère) constituée
de gaz sous faible pression.
1) Décrire le spectre du soleil
2) Pourquoi est-il logique que le spectre provenant de la lumière des planètes soit
identique à celui du soleil ?
3) Pourquoi avoir choisi le terme « absorption » pour décrire les raies sombres
présentes sur le spectre ?
4) Expliquer l’origine des raies sombres présentes dans le spectre d’absorption
5) Relever la longueurs d’onde des raies d’émission du sodium . Par quelle lettre, les
raies d’absorption du sodium sont-elles identifiées sur le spectre du soleil ? Les
valeurs des longueurs d’onde des raies d’absorption sont-elles identiques ?
6) Quel élément chimique a été découvert dans le soleil avant d’être identifié sur
Terre ? Rechercher l’origine de son nom .
7) Représenter sur un schéma le soleil et ses différentes couches. D’où vient le
spectre continu du soleil ? D’où viennent les raies d’absorption .

IV/ La température d’une étoile.
1) Etude qualitative.
Connaissant leurs températures, justifier la couleur des étoiles ci-dessous :
Remarque : le Kelvin K est l’unité des températures absolues, introduite par le
britannique Kelvin au XIX
ème
siècle. On a T(K) = t(°C) + 273,15.
2) Etude quantitative.
Toutes les radiations émises par une étoile ne le sont pas avec la même puissance P. Pour
le Soleil, par exemple :
a) Avec Regressi, tracer le graphe P = f(
λ
λλ
λ
) . Le reproduire sur votre copie .
b) Evaluer la longueur d’onde
λ
λλ
λ
max
pour laquelle la puissance rayonnée par le soleil
est maximale
c) En déduire une valeur de la température de surface du Soleil avec la loi de Wien :
Km109,2T
3
max
⋅⋅=×λ
−
d) Cette valeur est-elle en accord avec celle indiquée dans le tableau 1) ?
e) Convertir cette température en °C
1
/
4
100%