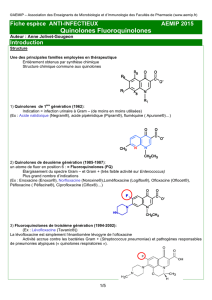
Mécanismes de résistance aux fluoroquinolones : données récentes

B
AC T É R I O L O G I E
La Lettre de l’Infectiologue - Tome XIII - n° 5 - mai 1998
195
es fl u o ro q u i n o l o n e s , antibiotiques à large spectre
actifs notamment sur les bacilles à Gram négatif de
type entéro b a c t é ri e s , le bacille pyo cyanique et les sta-
phylocoques, ont été introduites en thérapeutique humaine en
1984 et sont maintenant utilisées massivement à l’échelle mon-
diale. Le corollaire de ce succès a été l’apparition, puis l’aug-
mentation des souches présentant une résistance acquise dans
la plupart des espèces bactériennes initialement sensibles. Afin
de limiter ce phénomène, il est notamment important de com-
prendre en détail comment les quinolones agissent et comment
les bactéries deviennent cap a bles de leur résister. Cet art i cl e
fait le point sur les connaissances actuelles acquises dans ces
domaines.
MÉCANISME D’ACTION DES QUINOLONES
Inhibition des ADN topo-isomérases de type II
Les quinolones exercent une inhibition sélective de la synthèse
de l’ADN bactérien, et on sait depuis longtemps qu’une topo-
i s o m é rase dénommée ADN gy rase constitue une cible intra-
cellulaire des quinolones.
Les topo-isomérases sont des enzymes capables de modifier la
t o p o l o gie de l’ADN, c ’ e s t - à - d i re le degré de torsion de la doubl e
hélice : celle-ci peut en effet se trouver dans un état relâché ou
bien surenroulé positivement ou négativement (c’est-à-dire, en
fait, sous-enroulé) et la gyrase est la seule topo-isomérase bac-
t é rie nne cap a ble de sure n rouler négat ivement l’ADN. Elle pos-
sède une stru c t u re tétra m é ri q u e , avec deux sous-unités A
(GyrA) et deux sous-unités B (GyrB), codées respectivement
par les gènes gyrA et gyrB. L’activité enzymatique de la gyrase
est ATP-dépendante et peut être décomposée en trois étapes :
coupure double-brin de l’ADN ; passage d’un autre segment
d’ADN par la coupure ; refermeture de la coupure. Au moment
de la fo r m ati on de celle-ci, l’ADN et la gy r ase sont liés de
manière covalente au niveau d’une tyrosine en position 122 de
GyrA (séquence de E. coli p rise comme référence) (1). Les qui-
nolones sont cap ables de se fi xer sur ce complexe cova l e n t
A D N - e n z y m e, le rendant irr é ve rs i bl e. La nat u re précise des
interactions moléculaires existant au sein du complexe ternaire
A D N - gy rase-quinolone n’est cependant pas bien connu e . Le
blocage de l’enzyme sur l’ADN empêcherait la progression de
l’ADN polymérase bactérienne au cours de la réplication, d’où
l’inhibition des synthèses d’ADN et donc de la croissance bac-
t é ri e n n e . Mais les quinolones sont des antibiotiques bactéri-
cides, pas seulement bactériostatiques, et d’autres mécanismes
d o ivent entrer en jeu. On pense que les coupures d’ADN
d o u b l e - b rin stabilisées par les quinolones constituent des
lésions non réparables de l’ADN,capables de déclencher l’ac-
tivation de certaines synthèses protéiques, responsables de la
bactéricidie (2).
On s’est rendu compte récemment qu’une autre topo-isomé-
rase bactéri e n n e, l’ADN topo-isomérase IV, est une seconde
cible intracellulaire des quinolones. Cette enzyme a été décou-
Mécanismes de résistance aux fluoroquinolones :
données récentes
J. Tankovic*, C.J. Soussy*
RÉSUMÉ.
La résistance aux quinolones survient uniquement par mutation chromosomique et deux types de mutations sont classiques : celles
survenant dans les gènes de structure (gyrA et gyrB) de l'ADN gyrase,topo-isomérase bactérienne qui est une cible intracellulaire des qui -
nolones, et celles conduisant à un défaut d’accumulation de l'antibiotique. Les mutations gyrA sont plus fréquemment impliquées dans la résis -
tance des souches cliniques que les mutations gyrB. Une donnée récente est que la résistance peut aussi être liée à la survenue de mutations
dans les gènes de structure (parC et parE) codant pour une seconde topo-isomérase bactérienne,l'ADN topo-isomérase IV. Chez les bactéries
à Gram négatif (entérobactéries, Haemophilus influenzae), ce dernier mécanisme semble jouer un rôle secondaire : l'expression d'une muta -
tion dans les gènes par est conditionnée par la présence préalable d’une mutation dans le gène gyrA ; la gyrase est donc la cible primaire,
mais la survenue d’une mutation dans les gènes parC ou parE chez une souche déjà résistante par mutation dans le gène gyrA confère un
niveau de résistance plus élevé. Chez Staphylococcus aureus, au contraire, la cible primaire est cette fois la topo-isomérase IV. Les mutations
dans le gène gyrA ne confèrent une résistance qu’en cas de présence préalable d’une mutation dans le gène parC. Enfin, chez Streptococcus
pneumoniae et Mycoplasma hominis, la cible primaire varie en fonction de la fluoroquinolone considérée.
Mots-clés :
Quinolones - Résistance - ADN gyrase - ADN topo-isomérase IV.
L
* Service de bactériologie, virologie, hygiène, Hôpital Henri-Mondor,
51, avenue du Maréchal-de-Lattre-de-Tassigny, 94010 Créteil Cedex.

verte en 1990 chez E. coli (3) et a été retrouvée par la suite
chez d’autres espèces bactériennes. Elle a, comme la gyrase,
une structure tétramérique C
2
E
2
:deux gènes, parC et parE,
codent re s p e c t ivement pour les sous-unités C (ParC) et E (Pa r E ) .
La topo-isomérase IV semble avoir un rôle spécifi q u e,le désen-
ch ev ê t rem ent des ADN fils en fin de réplication. Les quino-
lones sont cap a bles d’inhiber in vitro et in vivo l’activité de
cette enzyme.
Pénétration des quinolones dans la bactérie
Pour atteindre leurs cibles intracytoplasmiques, les quinolones
doivent bien sûr traverser les enveloppes bactériennes, et il est
admis que ce passage s’effectue par diffusion passive unique-
ment. On sait également que la membrane externe des bacté-
ries à Gram négatif constitue un obstacle à la pénétration des
quinolones ; les plus hydrophiles (comme la norfloxacine et la
c i p r o f l o xacine) empruntent la voie des porines et les plus hy d ro-
phobes (comme la sparfl oxa cine et la péfl oxacine) sembl e n t
capables, en chélatant les ions magnésium présents à la surface
de la membrane externe, de désorganiser le lipopolysaccharide
puis de diffuser à travers la bicouche lipidique (1).
Une notion récente concernant les quinolones est qu’il existe
des systèmes cap ables d’excréter activement une fraction de
l’antibiotique ayant pénétré, ceci aussi bien chez les bactéries
à Gram positif comme Staphylococcus aureus (4) que chez les
bactéries à Gram négatif comme E. coli ou Pseudomonas aeru -
ginosa (5). Ces pompes d’efflux ne sont en fait pas spécifiques
des quinolones mais excrètent de nombreux composés de stru c-
ture chimique très différente, dont d’autres antibiotiques. Elles
contribuent à fixer le niveau de sensibilité intrinsèque aux qui-
nolones des bactéries, mais peuvent aussi être impliquées dans
la résistance acquise, comme nous le verrons.
GÉNÉRALITÉS SUR LES MÉCANISMES DE RÉSISTANCE AUX
QUINOLONES
Les bactéries peuvent devenir résistantes à certains antibio-
t i q u e s , par exemple aux bêtalactamines ou aux aminosides,
grâce à l’acquisition de gènes de résistance portés par des élé-
ments génétiques mobiles comme les plasmides ou les trans-
posons. Ceci n’a jamais été observé dans le cas des quinolones
[ 1 ]
.
Il s’agit ici de mutations spontanées dans certains gènes chro-
mosomiques qui réduisent la sensibilité de la bactérie par deux
grands mécanismes :diminution d’affinité des cibles intracel-
l u l a i res que sont les complexes ADN-ADN gy r ase et A D N -
ADN topo-isomérase IV,et diminution d’accumulation intra-
c e l l u l a i r e de l’antibiotique, par défaut de pénétration passif et/ou
excrétion active. Il n’a encore jamais été décrit de résistance
aux quinolones par inactivation de l’antibiotique. Il est à noter
que la résistance est croisée pour la majorité des quinolones.
Cependant, le degré d’augmentation des concentrations mini-
males inhibitrices (CMI) peut va rier de façon importante en
fonction des molécules.
RÉSISTANCE PAR MODIFICATION DE L’ADN GYRASE
Il est classiquement admis que c’est le mécanisme principal de
résistance aux quinolones. La modification, secondaire à une
mu t ation ch ro m o s o m i q u e,peut toucher soit la sous-unité A , c a s
le plus fréquent, soit la sous-unité B.
Modification de la sous-unité A
Le mutant nalA de E. coli, décrit en 1969, a été l’un des pre-
miers mutants résistants aux quinolones étudiés (6). La muta-
tion nalA était récessive et conférait un haut niveau de résis-
tance à l’acide nalidixique. Des travaux ultérieurs ont apporté
la preuve que la mutation nalA était en fait un allèle de gyrA.
Par la suite, de nombreuses autres études ont confi r mé l’im-
portance des mutations gyrA dans la résistance aux quinolones
chez E. coli et ont montré qu’elles se localisaient toujours dans
une région du gène très conservée entre les différentes espèces
et qui a été appelée quinolone re s i s t a n c e - d e t e rmin ing regi o n
ou QRDR (tableau I) (7).
B
AC T É R I O L O G I E
196
La Lettre de l’Infectiologue - Tome XIII - n° 5 - mai 1998
Tableau I. Substitutions de la protéine GyrA associées à la résis-
tance aux quinolones chez E. coli.
Position Substitution Augmentation de CMI (x)
Acide nalidixique Ciprofloxacine
67 AlaSer 8 4
81 GlyCys 16 8
81 GlyAsp 1 8
82 AspGly
a
1 8
83 SerAla 20 10
83 SerLeu 128 32
83 SerT rp 128 32
83 SerT yr – –
84 AlaPro 8 8
87 AspAsn 64 16
87 AspVal – –
87 AspTyr – –
87 AspGly 64 16
106 GlnArg 2,5 10
106 GlnHis 4 4
a
Mutation spontanée détectée chez une souche ayant déjà une mutation en
position 81 (Gly
Asp). Un mutant en position 82 seulement peut toutefois être
obtenu par mutagenèse dirigée.
[1] Le premier cas de résistance plasmidique transférable aux quinolones a été
r a p p o rté très récemment ( M a rt i n e z - M a rtinez L., Pascual A., Jacoby G.A.
Quinolone resistance from a transferable plasmid. Lancet 1998 ; 351 :797-9).
Un plasmide de résistance aux bêtalactamines, provenant d’une souche cli-
nique multirésistante de Klebsiella pneumoniae, confère une résistance de bas
niveau aux fluoroquinolones (CMI de la ciprofloxacine allant de 0,125 à
0,5 mg/l) quand on l’introduit par conjugaison chez des souches sensibles de la
même espèce mais aussi de E. coli, Citrobacter freundii, Salmonella typhimu -
rium et même P. aeruginosa. De plus, l’acquisition de ce plasmide par des
souches présentant une déficience en porines conduit cette fois à des résis-
tances de haut niveau aux fluoroquinolones (CMI de la ciprofloxacine allant
jusqu’à 32 mg/l). Plus inquiétant encore, des mutants plus résistants aux fluo-
roquinolones sont obtenus à partir des souches hébergeant le plasmide avec
une fréquence élevée, au moins cent fois supérieure à celles observées avec
les souches dénuées de plasmide. Le mécanisme biochimique de cette résis-
tance n’est pas encore élucidé. Il est clair que l’existence de tels plasmides
dans la nature fait craindre une extension rapide des résistances acquises aux
fluoroquinolones chez les bacilles à Gram négatif.

Cette région se situe entre les codons 67 et 106 (pour la
séquence de E. coli), près de l’extrémité 5’ du gène,dans une
région très conservée entre les espèces et correspondant au site
actif de l’enzyme.
La présence de mu t ations gy r A chez des souches résistantes
aux quinolones a également été re t rouvée dans toutes les
espèces bactériennes où une telle recherche a été effectuée. Les
mu t ations qui ont été identifiées sont très voisines de celles
décrites chez E. coli, tant au niveau de la position des muta-
tions que des substitutions induites. Il a été montré également
que deux mu t ati ons gy r A p o u vaient être présentes dans une
même souche, ceci s’associant à un niveau de résistance plus
élevé (8).
C e r taines mu t ations gy r A d é c o u v e r tes récemment chez
Salmonella typhimu ri u m constituent une ex c e p t i o n , p u i s -
qu’elles se situent au niveau du codon 119, donc légèrement en
d e h o rs de la QRDR telle qu’on la définit classiquement ( 9 ) .
Modification de la sous-unité B
Chez E. coli, deux mutations dans le gène gyrB conférant la
résistance aux quinolones, les mutations nalC et nalD, ont été
décrites dès 1986 (tableau II) (10). Le phénotype de résistance
conféré par la mutation nalC constitue d’ailleurs un exemple
de résistance non croisée entre les différentes quinolones :il y
a résistance à l’acide nalidixique mais, au contraire, hypersen-
sibilité vis-à-vis des quinolones dont la stru c t u re chimique com-
porte un cycle pipérazinyle, ceci étant le cas des fluoroquino-
lones. Des mutations gyrB ont aussi été détectées dans d’autres
espèces bactéri e n n e s ( t ableau II) ( 7 ) . C ep e n d a n t , elles ne s’ob-
servent que rarement chez les souches d’isolement clinique. La
prédominance in vivo des mu t ations gy r A s ’ e xplique pro b a-
blement par le fait que celles-ci confèrent un plus haut niveau
de résistance et donc un avantage sélectif supérieur.
RÉSISTANCE PAR MODIFICATION DE L’ADN
TOPO-ISOMÉRASE IV
La découverte que des mutations dans les gènes de structure de
l’ADN topo-isomérase IV pouvaient être impliquées dans la
résistance aux quinolones constitue indiscutablement l’ava n -
cée récente majeure en ce qui concerne l’élucidation des méca-
nismes de résistance à cette classe d’antibiotiques.
Mutations dans le gène parC chez S. aureus (tableau III)
Les premiers éléments en faveur du rôle de la topo-isomérase
IV dans la résistance sont ve n us d’études menées chez S. aure u s .
Dans cette espèce,un nouveau locus de résistance, appelé flqA,
fut découve r t en 1991 : ce locus était distinct de gy r A - gy r B a i n s i
que du gène norA (gène impliqué dans la résistance par efflux
actif, comme nous le verrons) (11). De plus, il paraissait très
important dans la résistance,puisque les douze mutants étudiés
dans ce travail, sélectionnés in vitro en une étape par exposi-
tion à la cipro fl o x a c i n e , présentaient une mu t ation fl q A.
D’autres travaux menés en parallèle montrèrent en outre que,
chez S. aure u s , à la diff é rence de ce qui s’observe chez les
bacilles à Gram négat i f , les mu t a tions gy r A ne surv i e n n e n t
jamais à la première étape de sélection mais au cours d’étapes
ultérieures.
Le clonage et le séquençage des gènes parC (encore appelés
grlA) et parE (encore appelés grlB) de S. aureus ont été réali-
sés en 1994 (12). L’analyse par séquençage de huit souches cli-
niques résistantes aux quinolones à bas ou à haut niveau a mon-
tré qu’elles possédaient toutes une mutation dans le gène parC
au niveau du codon 80 conduisant à une substitution SerT yr
ou SerPhe (12). Il existe en effet au sein du gène parC une
région très homologue à la QRDR de gyrA (la Ser80 de ParC
correspondant à la Ser84 de GyrA chez S. aureus) et qui est
impliquée dans la résistance aux quinolones (figure 1). Cette
région peut donc être appelée la QRDR de parC.
Une étude récente a confi rmé que les mu t ations fl q A é t a i e n t
bien des allèles de parC (13). Certaines des mu t ations p a r C
d é c rites dans ce travail se situent au niveau du codon 116 et
sont tout à fait comparables aux mu t ations du codon 119 de
La Lettre de l’Infectiologue - Tome XIII - n° 5 - mai 1998
197
Tableau II. Substitutions de la protéine GyrB associées à la résis-
tance aux quinolones.
Espèce Locus Position Substitution
(position
correspondante
chez E. coli)
Escherichia coli nalD 426 AspAsn
Escherichia coli nalC 447 LysGlu
Salmonella typhimurium –463 (463) SerT yr
Neisseria gonorrhoeae –419 (426) AspAsn
Staphylococcus aureus –437 (426) AspAsn
Staphylococcus aureus –458 (447) ArgGln
Mycobacterium tuberculosis –495 (426) AspHis
Tableau III. Substitutions de la protéine ParC associées à la
résistance aux quinolones chez S. aureus.
Position du codon Substitution
80
a
SerPhe
80 SerT yr
84 GluLys
84 GluLeu
116 AlaPro
116 AlaGlu
a
La position 80 de ParC correspond à la position 84 de GyrA chez S. aureus.
64 80 84 103
ParC AKTVGDVIGQYHPHGDSSVYEAMVRLSQDWKLRHVLIEMH
GyrA ARIVGDVMGKYHPHGDSSIYEAMVRMAQDFSYRYPLVDGQ
68 84 88 107
* **** * ******** ****** ** * *
Figure 1. Alignement des séquences peptidiques partielles de GyrA
et ParC de S. aureus.
*acides aminés conservés ; les acides aminés soulignés sont ceux où des
substitutions associées à la résistance ont été observées.

GyrA observées chez S. typhimurium. Dans cette même étude,
des arguments génétiques directs ont apporté la preuve que la
t o p o - i s o m é rase IV est bien la cible pri m a i r e des quinolones
chez S. aure u s :l ’ i n t ro d u c t i o n , par éch a n ge allélique, d ’ u n e
mu t ation gy r A dans le ch romosome d’une souche sauvage n’en-
traîne aucune modification de sensibilité aux quinolones ; en
revanche, si la mutation gyrA est introduite dans une souche
résistante de bas niveau par mu t ation p a r C , on observe une aug-
mentation de la résistance.
Mutations dans les gènes parC ou parE
chez Streptococcus pneumoniae et Mycoplasma hominis
Les travaux réalisés chez S. pneumoniae ont d’abord donné des
r é s u l t a ts similaires à ceux observés chez S. aure u s :l ’ é m e r -
gence de la résistance,aussi bien in vitro qu’in vivo, est large-
ment liée à la survenue de mutations dans le gène parC ;chez
un mutant parC, l’acquisition d’une seconde mutation dans le
gène gyrA confère un niveau de résistance plus élevé (14). De
plus, une mutation dans le gène parE, tout à fait comparable à
certaines des mutations décrites au niveau du gène gyrB,a été
impliquée dans la résistance chez certains mutants sélection-
nés in vitro(15). D’après ces travaux, il apparaissait donc que
l’ADN topo-isomérase IV était la cible pri m a i re des fl u o r o-
quinolones chez S. pneumoniae comme chez S. aureus. Cepen-
dant, un travail récent a montré que, chez le pneumocoque, la
cible primaire est en fait variable en fonction de l’antibiotique
c o n s i d é r é ( 1 6 ) :les mu t a tions sélectionnées in vitro en utilisant
comme agent sélecteur la ciprofloxacine se situent effective-
ment dans le gène parC ;mais si l’on utilise la sparfloxacine,
les mutations surviennent alors dans le gène gyrA.
Chez M. hominis, bactérie totalement dépourvue de paroi mais
génétiquement ap p a rentée aux bactéries à Gram positif, d e s
r é s u l t ats similaires ont été obtenu s ( 1 7 ) :les mu t ations dans
les gènes gyrA et parC sont impliquées dans la résistance,et la
c i ble pri m a i re va r ie également en fonction de la quinolone
considérée.
Mutations dans les gènes parC ou parE chez les bactéries
à Gram négatif
C h e z E. coli, l’ADN topo-isomérase IV est aussi impliquée
dans la résistance aux quinolones, mais en tant que cible secon-
daire cette fois. L’introduction d’une mutation parC, par rem-
placement allélique, ne modifie pas la sensibilité aux quino-
lones d’une souche sauvage, mais elle augmente le niveau de
résistance d’un mutant gyrA (18). Des mu t ations parC ont aussi
été re t r ouvées dans des souches cliniques hautement résistantes
aux quinolones. Par ailleurs, une mutation dans le gène parE
(substitution Leu445His) impliquée dans la résistance aux
quinolones d’un mutant in vitro, mais dont l’expression est là
encore conditionnée par la présence concomitante d’une muta-
tion gyrA, a aussi été décrite (19).
Des résultats similaires à ceux obtenus chez E. coli ont aussi
été obtenus chez d’autres bactéries à Gram négatif : Neisseria
gonorrhoeae (20), Klebsiella pneumoniae (21) et Haemophi -
lus influenzae (22).
NOTIONS DE CIBLES PRIMAIRE ET SECONDAIRE
Il ap p a r aît donc que la cible pri m a i re des fl u o roq uinolones va ri e
en fonction de l’espèce bactérienne mais aussi, au moins pour
certaines bactéries, en fonction de la quinolone considérée. On
sait que la gy ras e et la topo-isomérase IV sont des enzymes
essentielles, l’inhibition définitive de l’une ou de l’autre étant
létale. La primauté de l’une par rapport à l’autre en tant que
c i ble des quinolones pourrait donc s’expliquer par une plus
grande sensibilité à l’inhibition par ces antibiotiques. Effecti-
vement, des études biochimiques (étude de l’activité de suren-
roulement pour la gyrase,de l’activité de décaténation pour la
topo-isomérase IV,en présence ou en l’absence de quinolones)
effectuées chez E. coli (18) et S. aureus (23) vont dans ce sens :
la gyrase est la plus sensible des deux chez E. coli, la topo-iso-
mérase IV est la plus sensible chez S. aureus.
Sur un plan pratique,il serait très intéressant de développer des
fl u o r oquinolones ayant une activité équivalente sur les deux
cibles. Le développement d’une résistance impliquerait alors
la survenue simultanée de deux mutations indépendantes, évé-
nement génétique très rare. L’inhibition simultanée des deux
enzymes pourrait également se traduire par une augmentation
de l’activité antibactérienne.
RÉSISTANCE PAR DÉFAUT D’ACCUMULATION
Chez les bactéries à Gram négatif
Chez E. coli, de nombreuses mutations spontanées, se caracté-
risant par une diminution d’accumu l ation intra c e l l u l a i re des
q u i n o l o n e s , ont été décrites in vitro. Chez ces mu t a n t s , u n e
diminution de production de la porine OmpF (porine détermi-
nante quant à la traversée de la membrane externe par de nom-
b reux antibiotiques, y compris les quinolones) est observée ( 7 ) .
Ces mu t ations confèrent la résistance également à d’autre s
classes d’antibiotiques : t é t r a cy cl i n e s , ch l o r a m p h é n i c o l , c e r-
taines bêtalactamines. Elles peuvent d’ailleurs être obtenues en
utilisant comme agent sélecteur soit une quinolone,soit l’un de
ces antibiotiques.
Il a été observé que le niveau de résistance de ces mutants était
deux à quatre fois supérieur à celui obtenu en cas d’inactiva-
tion du gène ompF.Ceci s’explique par le fait que d’autres fac-
teurs que la réduction de la porine OmpF contribuent à la résis-
tance aux quinolones par défaut d’accumulation.
Des phénomènes d’efflux actif membra n a i r e interv i e n n e n t
notamment dans la résistance,ceci ayant été montré dans le cas
des mutations nfxB et mar de E. coli (7). En effet, l’addition
d ’ i n h i b i t e u r s des phénomènes actifs membra n a i r e s , p a r
exemple la carbonyl cyanide m-ch l o r o - p h é ny l h y d ra zone ou
C C C P,e n t raîne une augmentation importante de pénétrat i o n
des quinolones chez les mu t a n t s , abolissant les diff é rences d’ac-
c u m u l a tion observées par rap p o rt aux souches sauvage s ( 7 ).
Les deux éléments, d i m i nut ion de la porine OmpF et efflux actif
m e m b r a n a i r e, agi raient donc en synergie pour pro d u i re un
niveau de résistance significatif.
B
AC T É R I O L O G I E
198
La Lettre de l’Infectiologue - Tome XIII - n° 5 - mai 1998
.../...

Des systèmes d’efflux actif ont effe c t ivement été découve rt s
chez les bacilles à Gram négatif. Ceux-ci permettent à la bac-
térie d’excréter certains antibiotiques à travers l’ensemble des
enveloppes bactériennes et sont donc composés de trois pro-
téines :
–une pompe d’efflux située au niveau de la membrane cyto-
plasmique ;
–un canal protéique (équivalent d’une porine) au niveau de la
membrane externe ;
–une protéine périplasmique assurant la liaison entre les deux
membranes.
Il s’agit notamment du système AcrA-AcrB-TolC de E. coli ou
des systèmes Mex A - M exB-OprM et Mex C - M exD-OprJ de
P. aeru ginosa (5). Ces systèmes d’efflux existent éga l e m e n t
chez les souches sensibles, contribuant à fixer le niveau de sen-
sibilité intrinsèque aux fluoroquinolones des souches. Chez les
s o u c hes résistantes par efflux actif, une mu t ation dans les
r é gions régulat rices conduit à une hy p e ra c t ivité d’un de ces
systèmes.
Chez les bactéries à Gram positif
Yoshida et coll. ont été les premiers à montrer,en 1990, que
S. aureus pouvait résister aux fluoroquinolones par un méca-
nisme d’efflux actif, ceci ayant été par la suite confi rmé par
d ’ a u t res équipes ( 2 4 ) . Les travaux initiaux, e f fectués sur un petit
n o m b r e de fl u o ro q u i n o l o n e s , avaient amené à la conclusion que
cette résistance touchait surtout les fl u o r oquinolones hy d r o-
p h i l e s , en particulier la norfl o x a c i n e . Un travail récent sur
40 molécules différentes n’a pas retrouvé de corrélation signi-
ficative entre le degré d’hydrophilie de la molécule et l’aug-
mentation de CMI (25). Le gène impliqué, norA, existe égale-
ment chez les souches sensibles et code pour une pro t é i n e
transmembranaire. Chez les souches résistantes, il existe une
a u g m e n t ation de tra n s c rip tion du gène n o r A , p ro b ablement liée
à la surve nue d’une mu t a tion dans la région régulat r i c e. Les
mécanismes biochimiques impliqués dans l’efflux n’ont pas été
é l u c i d é s , mais on sait cependant que l’efflux des quinolones est
lié au gradient de pH transmembranaire.
Une résistance aux quinolones par efflux actif a également été
d é c rite chez une espèce de my c o b a c t é ri e,M y c o b a c t e riu m smeg -
matis (26), et est suspectée chez le pneumocoque (27).
CONCLUSION :RÔLE DES DIFFÉRENTS MÉCANISMES
DANS LA RÉSISTANCE CLINIQUE
Chez E. coli et les autres entérobactéries
Chez ces bactéries, une seule mutation, quelle qu’elle soit, est
i n s u ffisante pour conférer un niveau de résistance tel que la
CMI des fluoroquinolones vis-à-vis du mutant soit supérieure
à la concentration critique basse,c’est-à-dire au seuil de sensi-
bilité (1 mg/l habituellement pour les fl u o roquinolones). Cep e n-
dant, dans certains cas, le niveau de résistance des mutants est
proche de ce seuil :il est alors facile de sélectionner in vivo une
seconde mutation conférant un niveau de résistance plus élevé.
Ainsi, la substitution la plus fréquemment observée dans GyrA
chez E. coli et qui confère le plus haut niveau de résistance,
Ser83Leu, se caractérise par une multiplication par 32 de la
CMI de la cipro fl oxacine pour aboutir donc à une valeur pro ch e
de 0,5 mg/l. Les autres mu t at i o n s gy r A , la mu t a tion gy r B d e
type nalD et les mutations de perméabilité confèrent un niveau
de résistance moins élevé, avec multiplication des CMI de la
ciprofloxacine par un facteur 4 à 16.
S’il est sûr que les mu t ations gyrA jouent un rôle important dans
l ’ é m e r gence de la résistance en cl i n i q u e,celui joué par les mu t a-
tions de perméabilité est beaucoup moins clair. Pour certains
auteurs, ces mutations pourraient constituer la première étape.
En effet, bien que conférant un bas niveau de résistance, elles
pourraient permettre à la bactérie de résister à l’action bactéri-
cide des fl u o ro q u i n o l o n e s ( 2 8 ) . Les bactéries surv iva n t e s
auraient ainsi l’occasion d’acquérir une seconde mutation au
n i veau du gène gy r A et donc d’at t e i n d re un niveau de résistance
plus élevé. Quant aux hauts niveaux de résistance,ils s’expli-
quent par l’acquisition de plusieurs mutations dans les gènes
gyrA et/ou parC.
Chez S. aureus et P. aeruginosa
Ces espèces étant intrinsèquement moins sensibles aux fluoro-
quinolones que les entérobactéries (CMI modale de la cipro-
floxacine : environ 0,25 mg/l), la survenue d’une seule muta-
tion suffit à conférer une résistance clinique.
Chez S. aureus, comme nous l’avons vu, les mutations dans le
gène p a r C p a raissent jouer un rôle pri m o rdial dans l’émerge n c e
de la résistance, les mu t a tions dans le gène gy r A c o n f é r a n t
ensuite un haut niveau de résistance. L’importance, en termes
de fréquence, du mécanisme médié par NorA dans la résistance
des isolats cliniques de S. aureus reste à préciser.
R
É F É R E N C E S B I B L I O G R A P H I Q U E S
1.
Hooper D.C., Wolfson J.S. Mechanisms of quinolone action and bacterial
killing. In : Hooper D.C., Wolfson J.S. (Eds.). Quinolone antimicrobial agents.
Deuxième édition. Washington D.C. American Society for Microbiology 1993 ;
53-76.
2.
Chen C.R., Malik M., Snyder M., Drlica K. DNA gyrase and topoisomerase IV
on the bacterial chromosome : quinolone-induced DNA cleavage. J Mol Biol
1996 ; 258 : 627-37.
3.
Kato J.I., Nishimura Y., Imamura R., Niki H., Hiraga S., Suzuki H. New topo-
isomerase essential for chromosome segregation in E. coli. Cell 1990 ; 63 : 393-
404.
4.
Kaatz G.W., Seo M., Ruble C.A. Efflux-mediated fluoroquinolone resistance in
Staphylococcus aureus. Antimicrob Agents Chemother 1993 ; 37 : 1086-94.
5.
Nikaido H. Multidrug efflux pumps of gram-negative bacteria. J Bacteriol
1996 ; 178 : 5853-9.
6.
Hane M.W., Wood T.H. Escherichia coli K-12 mutants resistant to nalidixic
acid : genetic mapping and dominance studies. J Bacteriol 1969 ; 99 : 238-41.
7.
Hooper D.C., Wolfson J.S. Mechanisms of bacterial resistance to quinolones.
In : Hooper D.C., Wolfson J.S. (Eds). Quinolone antimicrobial agents. Deuxième
édition. Washington D.C. American Society for Microbiology 1993 ; 97-118.
8.
Heisig P., Tschorny R. Characterization of fluoroquinolone-resistant mutants
of Escherichia coli selected in vitro. Antimicrob Agents Chemother 1994 ; 38 :
1284-91.
9.
Griggs D.J., Gensberg K., Piddock L.J.V. Mutations in gyrA gene of quinolo -
La Lettre de l’Infectiologue - Tome XIII - n° 5 - mai 1998
201
.../...
 6
6
1
/
6
100%