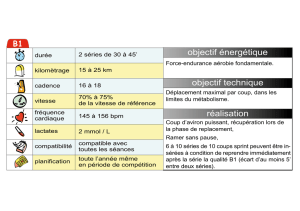
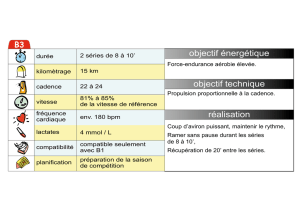
Défauts quantiques dans les séries moléculaires de Rydberg

D´efauts quantiques dans les s´eries mol´eculaires de
Rydberg
A.D. Walsh
To cite this version:
A.D. Walsh. D´efauts quantiques dans les s´eries mol´eculaires de Rydberg. J. Phys. Radium,
1954, 15 (6), pp.501-502. <10.1051/jphysrad:01954001506050100>.<jpa-00234974>
HAL Id: jpa-00234974
https://hal.archives-ouvertes.fr/jpa-00234974
Submitted on 1 Jan 1954
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-
entific research documents, whether they are pub-
lished or not. The documents may come from
teaching and research institutions in France or
abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est
destin´ee au d´epˆot et `a la diffusion de documents
scientifiques de niveau recherche, publi´es ou non,
´emanant des ´etablissements d’enseignement et de
recherche fran¸cais ou ´etrangers, des laboratoires
publics ou priv´es.

501
DÉFAUTS
QUANTIQUES
DANS
LES
SÉRIES
MOLÉCULAIRES
DE
RYDBERG
Par
A. D.
WALSH,
Université
de
Leeds
(Grande-Bretagne).
LE
JOURNAL
DE
PHYSIQUE
ET
LE
RADIUM.
TOME
15,
JUIN
1954,
La
formule
caractérisant
une
série
de
Rydberg
est
bien
connue :
v
=
potentiels
d’ionisation
-
constante.
(n
-
D)-2,
L’observation,
par
Priée
et
son
école
notamment,
de
séries
de
Rydberg
dans
les
spectres
des
molécules,
a
conduit
à
un
nombre
considérable
de
données
sur
les
potentiels
d’ionisation
moléculaire.
Cependant,
l’attention
a
été
tellement
concentrée
sur
l’extra-
polation
des
séries
de
Rydberg
(afin
d’obtenir
les
potentiels
d’ionisation),
qu’on
a
eu
tendance
à
oublier
que
toute
formule
de
série
de
Rydberg
apporte
un
second
renseignement
important,
à
savoir
le
défaut
quantique.
On
s’est
très
peu
occupé
de
l’étude
des
valeurs
du
défaut
quantique;
quand
la
bibliographie
y
fait
allusion,
c’est
de
façon
très
sommaire.
Le
plus
souvent
le
dénominateur
de
Rydberg
a
été
exprimé
sous
la
forme
(m
+
81)2
et
non
sous
la
forme
plus
souhaitable
donnée
ci-dessus.
On
a
attaché
très
peu
d’importance
à
n,
numérotage
des
bandes
dans
une
série.
De
ce
fait,
il
y
a
eu
souvent
confusion,
lorsqu’il
s’agissait de
savoir
si
une
bande
donnée
constituait
le
début
d’une
série,
ou
si
un
terme
antérieur
devait
être
envisagé.
Une
importance
moindre
encore
a
été
accordée
aux
renseignements
que
les
défauts
quan-
tiques
peuvent
apporter
sur
la
nature
des
niveaux
supérieurs
d’une
série.
Il
y
a
eu
confusion,
lorsqu’il
s’agissait
de
savoir
si
un
défaut
devait
être
relié
à
une
série,
dans
le
spectre
de
l’«
atome
lié »
ou
à
celle
du
spectre
d’un
atome
simple
de
la
molécule.
Il
semble
qu’on
n’ait
accordé
aucun
intérêt
au nombre
de
séries
de
Rydberg
intenses
que
l’on
peut
observer
dans
une
région
spectrale
donnée,
ou
encore
à
l’aide
que
peut
apporter,
à
l’expérimentateur
qui
recherche
les
séries
moléculaires
de
Rydberg,
un
examen
systé-
matique
des
principes
régissant
les
valeurs
de
défauts
quantiques.
Le
présent
Mémoire
essaye
d’apporter
un
peu
d’ordre
dans
le
chaos
actuel.
En
ce
qui
concerne
les
molécules
HA,
H2A,
et
H3A,
les
principes
régissant
les
valeurs
possibles
de
a
sont
les
suivants.
On
admet
que
l’électron
excité
provient
d’une
orbitale
«
lone
paire »
de A.
1°
Aux
orbitales
supérieures
des
séries
de
Rydberg,
on
peut
attribuer
l’un
des
symboles
généralement
utilisés
pour
caractériser
la
symétrie
d’une
orbitale
atomique,
c’est-à-dire
ns,
np,
nd,
....
2°
Les
symboles
peuvent
être
envisagés
comme
représentant
des
orbitales
soit
de
l’atome
libre
A,
soit
de
«
l’atome
lié
».
Du
point
de
vue
des
défauts
quantiques,
il
importe
peu
de
relier
les
séries
de
Rydberg
aux
séries
présentes,
dans
le
spectre
de
l’atome
libre
A,
ou
aux
séries
du
spectre
de
«
l’atome
lié
»,
car
les.
défauts
ne
changent
pas
beaucoup
de
C
à
Ne
ou
de
Si
à
A
par
exemple.
30
Les
défauts
quantiques
des
orbitales
s,
p
et
d
pour
les
atomes
de
C
à
Ne
dans
le
tableau
périodique
sont
respectivement ~
1,0,
~
o, 6
et ~ o, i.
Pour
les
atomes
de
Si
à
A,
les
valeurs
correspondantes
sont - 2, o, ~ 1, 5
et N o, 4
respectivement,
tandis
que
les
défauts
des
orbitales
f
sont -
o.
A
partir
de
là,
les
valeurs
pour
les
orbitales s,
p
et d
sont,
en
gros,
augmentées
d’une
unité
pour
chaque
augmen-
tation
de
i
du
nombre
quantique
principal
de
la
couche
de
valence.
Le
symbole -
devra
être
considéré
comme
correspondant
à
des
limites
d’environ
+_
o, 2,
pour
les
premiers
éléments,
et
une
limite
légèrement
plus
élevée
pour
les
suivants.
40
Un
symbole
peut
être
écrit
après
les
symboles
s,
p
et
d
pour
les
orbitales
de
Rydberg,
afin
de
caracté-
riser
leur
comportement
vis-à-vis
des
opérations
de
symétrie
qui,
selon
la
théorie
des
groupes,
sont
propres
à
la
molécule.
Il
peut
y
avoir
plus
d’un
symbole
de
symétrie
moléculaire
possible
pour
un
symbole
ato-
mique
particulier.
Ainsi,
pour
une
molécule
non
linéaire
d’hydrure
AH2,
le
symbole s
doit
toujours
être
suivi
de
al;
mais
le
symbole
p
peut
être
suivi
de
bl,
b2
ou
ai,
selon
que,
respectivement,
le
plan
nodal
de
l’orbitale
p
se
trouve
dans
le
plan
de
la
molécule,
ou
perpendiculaire
au
plan
de
la
molécule
et
perpendiculaire
à
la
direction
H-H,
ou,
enfin,
perpendiculaire
au
plan
de
la
molécule
et
parallèle
à
la
direction
H-H.
50
Quel
que
soit
le
symbole
moléculaire
utilisé,
le
défaut
quantique
reste
déterminé
en
premier
lieu
par
le
symbole
atomique;
par
exemple
les
orbi-
tales
pbl,
pb2 et
pal
ont
des
défauts
qui
ne
sont
pas
très
différents.
60
Des
symboles
moléculaires
possibles
indiqués
en
40,
seuls
doivent
être
envisagés,
pour
décrire
les
séries
de
Rydberg
qu’on
peut
espérer
trouver,
ceux
qui
impliquent
des
transitions
moléculaires
permises
par
les
règles
de
sélection.
Illustrons
l’application
de
ces
principes
en
considé-
rant
le
spectre
de
H2S.
Les
séries
permises
qui
doivent
conduire
au
premier
potentiel
d’ionisation
sont :
La
dégénérescence
des
orbitales
p
et
des
orbitales
d
est
complètement
décomposée;
une
série
avec
des
orbitales
supérieures
p
et
une
autre
avec
des
orbitales
supérieures d
sont
interdites.
n
devrait
partir
de
3
’pour
les
séries
(4)
à
(7),
et
de
4
pour
les
séries
(1)
à
(3).
Les
termes
connus
pour
S
(I)
montrent
que
3
d
se
trouve
au-dessus
de 4
p,
qui
se
trouve
au-dessus
de
4
s.
Par
suite,
les
premiers
membres
des
séries
(4)
à
(7)
se
trouvent
probablement
à
des
longueurs
d’onde
Article published online by EDP Sciences and available at http://dx.doi.org/10.1051/jphysrad:01954001506050100

502
plus
courtes
que
les
premiers
membres
des
séries
(2)
et
(3)
qui,
à
leur
tour,
se
trouvent
à
des
longueurs
d’ondes
plus
courtes
que
le
premier
membre
de
(1).
a
devrait
être - 2, o
pour
la
série
(1),
N
1, 5
pour
les
séries
(2)
et
(3)
et N
o, 4
pour
les
séries
(4)
à
(7)
Les
premiers
membres
des
séries
(2)
et
(3),
et
de
(4)
à
(7)
seront
voisins
parce
que
4, o -
1, 5 ~
3,0- 0,4:
Le
spectre
observé
montre
une
répétition
des
bandes
intenses,
désignées
par
A,
B,
C,
D,
E,
qui,
on
le
sait,
représentent
des
transitions
électroniques
distinctes.
Des
bandes
plus
faibles
s’observent
entre
B
et
C.
Les
bandes
D
ont
une
structure
fine,
différente
de
toutes
les
autres;
elles
peuvent
donc
être
iden-
tifiées
comme
série
(4).
Si
H2S
est
considéré
comme
une
toupie
symétrique
approchée,
la
structure
rota-
tionnelle
des
bandes
E
montre
qu’elles
sont
du
type
parallèle,
c’est-à-dire
des
transitions
1 BI
--->
’A,.
Elles
correspondent
à
une
série
dont
le
dénominateur
de
Rydberg
est
(n
-
2,04)2,
ou
n
=
5,
6,
7,
....
La
valeur a
identifie
la
série
comme
(1).
Ceci
implique
qu’un
membre
supplémentaire
se
trouve
à
des
lon-
gueurs
d’ondes
plus
grandes;
ce
qui
est
plausible,
car
l’absorption
pour
la
plus
grande
longueur
d’onde
est
un
fond
continu,
qui
implique
probablement,
à
la
fois
une
couche
d’intravalence
et
une
transition
de
Rydberg
’B,
-
lAI.
Les
bandes
B
ressemblent
aux
bandes
E.
Il
s’ensuit
que
les
bandes
B
repré-
sentent
la
série
(3).
Le
défaut
quantique
est
1,5
(comme
on
s’y
attendait)
avec
n
=
4,
5,
6,
...
c’est-à-dire
qu’il
n’y
a
pas
de
premier
membre
man-
quant.
Les
bandes
A
et
C
se
ressemblent
dans
leur
structure
fine;
mais
elles
ne
ressemblent
à
aucune
des
autres
bandes.
Elles
ont
donc
été
prises
pour
représenter
les
séries
(2)
et
(5).
A
cause
de
la
séquence
des
termes
de
S
(I)
et
des
valeurs
attendues
pour
ô,
on
pense
que
les
bandes
A
correspondent
à
la
série
(2)
(leur
défaut
quantique
étant
alors
1,57
et
n
commen-
çant
à
4)
et
les
bandes
C
la
série
(5)
(leur
défaut
quan-
tique
étant
o,25
et
n
commençant
à
3).
Tout
ceci
conduit
à
identifier
les
.séries
(6)
et
(7)
avec
des
bandes
plus
faibles
comprises
entre
B
et
C.
L’application
des
principes
ci-dessus
donne
ainsi
une
interprétation
tout
à
fait
complète
et
logique
du
spectre
de
H2S;
c’est
certainement
une
interprétation
bien
plus
complète
que
celles
admises
auparavant.
Examinons
maintenant
les
molécules
renfermant
plus
d’un
atome
sans
être
du
type
hydrure,
et
considérons
d’abord
les
molécules
ABC....
Devrons-
nous
relier
les
séries
de
Rydberg
observées
à
celles
de
l’«
atome
lié
»
ou
à
celles
des
atomes
séparés’?
On
peut
raisonner
ainsi :
Si
une
orbitale
s
élevée
est
centrée
sur
un
atome
particulier
A,
elle
devra
recouvrir
en
partie
les
atomes
voisins
B,
C,
....
Par
conséquent,
un
électron
dans l’orbitale
ne
pénétrera
pas
seulement
le
noyau
de
A
mais
aussi
les
noyaux
des
atomes
B,
C,....
Par
conséquent,
la
valeur
de
a
devra
être
considé-
rablement
accrue,
de
sa
valeur
pour
l’atome
isolé
A
jusqu’à
une
valeur
voisine
de
celle
de
«
l’atome
lié
»
formé
à
partir
de
A,
B,
C,
....
Du
fait
de
cet
argu-
ment,
les
rares
chercheurs,
qui
ont
considéré
les
défauts
quantiques
pour
les
molécules
n’appartenant
pas
au
type
hydrure,
ont
essayé
de
les
relier
à
celles
des
séries
dans
le
spectre
de
l’atome
lié.
L’argument
ne
peut
cependant
être
correct,
car
s’il
l’était,
les
valeurs
des
termes
pour
CH3A
seraient
plus
grandes
que
pour
HA;
or
les
valeurs
des
termes
des
tran-
sitions,
qui
rentrent
bien
dans
les
séries
moléculaires
de
Rydberg,
sont
presque
identiques
pour
CH3A
et
HA.
De
tels
couples
de
molécules
montrent
que
les
défauts
doivent
être
reliés
non
pas
à
ceux
de
«
l’atome
lié
»,
mais
à
ceux
de
la
plus
petite
unité
commune
aux
deux
molécules.
Il
apparaît
empiriquement
que
le
défaut
d’une
série
de
Rydberg,
dû
à
l’excitation
d’un
électron
primitivement
localisé
sur
A
dans
une
molécule
ABC ...,
reste
caractéristique
de
l’atome
A.
Considérons
maintenant
les
molécules
contenant
des
groupes
A",
par
exemple :
C2H2
et
C,H,.
On
ne
peut
faire
de
distinction
entre
les
atomes
C
dans
ces
molécules;
et
les
orbitales
moléculaires
sont,
par
conséquent,
considérées
comme
des
combinaisons
des
orbitales
atomiqùes,
une
pour
chaque
atome
C.
Si
l’on
envisage
l’électron
comme
existant
simultanément
dans
toutes
les
orbitales
atomiques
composantes,
on
peut
alors
s’attendre
à
ce
que
le
défaut
de
l’orbitale
moléculaire
soit
considérablement
accru
(proba-
blement
jusqu’à
une
valeur
voisine
de
celle
de
l’atome
lié),
quand
on
passe
de
l’acétylène
au
benzène.
Cepen-
dant
les
faits
sont
contre
cette
hypothèse.
Avec
le
benzène,
comme
avec
l’acétylène,
on
n’observe
que
deux
séries
de
Rydberg
intenses
et
les
valeurs
des
termes
des
membres
sont
à
peu
près
les
mêmes
que
pour
l’acétylène;
cependant
les
atomes
liés
pour
le
benzène
et
pour
l’acétylène
sont
respectivement
Mo
et
Si,
c’est-à-dire
deux
atomes
avec
des
valeurs
de
termes
très
différentes
pour
les
transitions
corres-
pondantes.
Empiriquement,
il
est
clair
que
les
défauts
quantiques
moléculaires
apparaissent
comme
corres-
pondant
non
pas
à
ceux
de
l’atome
lié,
mais
à
ceux
de
l’unité
commune
aux
deux
molécules,
c’est-à-dire
l’atome
C
ou
le
groupe
CH.
Ce
qui
est
frappant
pour
les
défauts
quantiques
des
séries
moléculaires
de
Rydberg,
c’est
leur
constance
pour
les
molécules
qui,
à
première
vue,
semblent
très
différentes.
Il
est
possible
d’interpréter
les
défauts
quantiques
trouvés
pour
les
molécules
contenant
le
groupe
A"
à
l’aide
des
principes
suivants :
On
admet
que
l’électron
excité
provient
primitivement
d’une
orbitale
associée
à
l’atome
A.
1.
Pour
les
orbitales
supérieures
des
séries
de
Rydberg,
on
peut
utiliser
l’un
des
symboles
ns,
np,
nd
pour
caractériser
l’orbitale
atomique
de
A
à
partir
de
laquelle
l’orbitale
moléculaire
est
formée.
2.
Ce
symbole
et
la
nature
de
l’atome
A
fixent,
en
gros,
l’amplitude
du
défaut
quantique
attendu
pour
l’orbitale.
°
3.
Il
y
a
n
orbitales
moléculaires
possibles,
qui
peuvent
être
établies,
en
faisant
des
combinaisons
d’un
type
particulier
d’orbitale
atomique
pour
chacun
des
atomes
A.
A
chacune
de
ces
orbitales
moléculaires
peut
être
attribué
un
symbole
indiquant
son
compor-
tement
vis-à-vis
des
opérations
propres
au
groupe
de
symétrie
auquel
A,,
appartient.
Ce
symbole
moléculaire
est
écrit
avant
le
symbole
atomique
afin
d’indiquer
qu’on
y
est
amené
en
considérant
les
atomes
séparés
plutôt
que
l’atome
lié.
4.
Seules
apparaissent
intenses
les
séries
de
Rydberg
qui
correspondent
aux
transitions
moléculaires
per-
mises.
1
/
3
100%