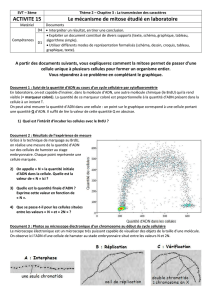
méth étude cycle


Méthode: utilisation de colorants en microscopie optique
l’hématoxyline
un colorant basique et qui a une
affinité pour les molécules acides,
met en évidence la répartition
de l’ADN, de l’ARN et des
protéines acides dans les cellules.

Les événements morphologiques de la mitose.
Observation en microscopie à fluorescence de cellules
PtK1 fixées au glutaraldéhyde à divers stades de la
mitose puis perméabilisées et colorées.
Les microtubules (rouge: la rodamine fixée sur la
tubuline)ont été visualisés par des méthodes
d’immunofluorescence indirecte, et les chromosomes
(vert) mis en évidence par le colorant d’ADN Hoechst
33342. Échelle (I) : 10 μm.
A) Début de prophase
B) Fin de prophase
C) Rupture de l’enveloppe nucléaire et début de la pro-
métaphase
D) Pro-métaphase
E) Fin de pro-métaphase
F) Métaphase
G) Anaphase
H) Télophase
I) Fin de mitose
(Tiré de CL Rieder & A Khodjakov, 1997. Mitosis and
checkpoints that control progression through mitosis in
vertebrate somatic cells. Progress in Cell Cycle Research,
vol. 3, avec la permission de Plenum Press, New York).
Méthode: utilisation de traceurs en microscope à fluorescence

Les cellules endothéliales d’artères
pulmonaires de bovins colorées au DAPI
exposent leur noyau, seul compartiment
subcellulaire qui contient l’ADN.
Le cytosquelette d’actine (le « squelette »
de la cellule) est quant à lui coloré en vert
Par un Ac marqué à la fluorescéine..

La photométrie est une méthode de mesure, par des moyens optiques, de
concentration des substances colorées dans un milieu non opaque. C’est un
aspect de la densitométrie. La connaissance du volume de substance
traversée permet de déterminer les quantités. La cytophotométrie se
pratique au microscope sur des préaparations cytologiques (cellules ou
organites cellulaires). En ce sens la méthode est analytique et permet de
localiser les substances cibles au sein des structures biologiques comme
avec l’autoradiographie.
Méthode: La cytophotométrie
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
1
/
21
100%