Cellules souches : une révolution en marche

18
BIOLOGIE MÉDICALE
LES BIOTECHNOLOGIES
t
TDC NO 1038
C’est en 1868 qu’un biologiste allemand,
Ernst Heckel, fait naître le concept de
« cellule souche » (CS), terme assez
générique qui désigne des entités cellu-
laires ayant en commun la capacité de
se spécialiser en divers types cellulaires
fonctionnels (la différenciation) et celle
de se diviser en cellules filles dont au moins une est
identique à la cellule mère (l’autorenouvellement).
Depuis, de telles cellules ont été identifiées, isolées
et, dans certains cas, utilisées en thérapie cellulaire
à partir de nombreux tissus ou organes humains
(de la moelle osseuse au cerveau, en passant par
l’épiderme ou l’intestin). Ces cel lules, dites multi-
potentes ou adultes, ont le pouvoir de se différen-
cier dans les cellules de l’organe ou du tissu dont
elles sont issues, mais pas au-delà. Leur potentiel
de division est cependant limité.
Des études initiées au milieu du e siècle
sur des tumeurs affectant les gonades (embryo-
carcinomes) ont exploré un autre type de cellules
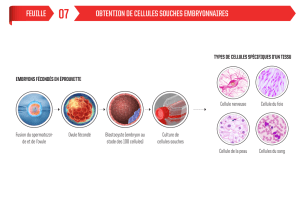
souches : les CS pluripotentes. C’est en 1981 que
la première lignée de CS naturellement pluripo-
tentes est isolée à partir de blastocyste de souris,
étape précoce du développement embryonnaire.
Leur équivalent humain, les CS embryonnaires
(CSE), est isolé pour la première fois en 1998.
Chez l’homme, le stade blastocyste correspond à
une fenêtre biologique de 48 heures, située entre
5,5 et 7,5 jours après fécondation. À ce stade, ces
cellules peuvent choisir de s’orienter vers n’im-
porte quel type cellulaire fonctionnel de l’orga-
nisme ; elles sont naturellement immortelles et
peuvent se multiplier à l’infini. Ce n’est qu’en
2006 que sont artificiellement générées, au
Japon, les CS induites à la pluripotence (iPS).
Similaires aux CSE, leur origine est cependant
totalement artificielle et dissociée de la procréa-
tion. C’est en forçant des cellules différenciées à
exprimer les gènes caractéristiques de l’état
embryonnaire que l’on a réussi à « reprogram-
mer » certaines d’entre elles en iPS. Elles expri-
ment à nouveau la partie de leur génome utilisé
dans le blastocyste, longtemps avant de se spécia-
liser, et abandonnent l’utilisation des gènes spé-
cifiques de leur état différencié, reprenant à son
origine le programme du développement. Ces
cellules ouvrent de nombreuses perspectives,
mais les effets secondaires de l’étape de « dédiffé-
renciation » sont encore mal connus.
Un énorme potentiel d’applications
Si la majorité des citoyens occidentaux consi-
dèrent acceptable l’utilisation par la recherche
médicale d’un embryon surnuméraire précoce,
certains restent opposés à la destruction d’em-
bryons humains, quel que soit son stade de déve-
loppement. Il en résulte une controverse sur les
CSE et une pression pour favoriser le développe-
ment d’applications avec les CS adultes ou les iPS.
Beaucoup d’applications pourront être dévelop-
pées à partir de ces dernières, mais la communauté
scientifique s’accorde à reconnaître aux CSE un
potentiel énorme d’applications médicales.
La thérapie cellulaire est certainement le ter-
rain le plus emblématique des enjeux que repré-
sentent les CS. Cette technique a prouvé son
efficacité grâce aux CS adultes (sang de cordon
ou de moelle osseuse pour les maladies du sang,
autogreffe d’épiderme pour les grands brûlés,
La thérapie
cellulaire,
terrain le plus
emblématique
Cellules souches :
une révolution en marche
L’être humain est placé devant de nouveaux défis
scientifiques et éthiques : les cellules souches, qui ouvrent
de belles perspectives thérapeutiques, en font partie.
> PAR SÉBASTIEN DUPRAT, RESPONSABLE DU PARTENARIAT, ET PIERRE CASANOVA, ASSISTANT MANAGER DE PROJET, DIRECTION
SCIENTIFIQUE DE L’INSTITUT DES CELLULES SOUCHES POUR LE TRAITEMENT ET L’ÉTUDE DES MALADIES MONOGÉNIQUES (I-STEM)

19
TDC NO 1038
t
LES BIOTECHNOLOGIES
CS mésenchymateuses pour la reconstruction des
os, etc.). Nous approchons pourtant des limites de
ce modèle, à cause de la capacité réduite d’auto-
renouvellement des CS adultes et de la difficulté de
standardisation entre type cellulaire et donneur
d’origine. En revanche, les capacités uniques des
CSE offrent la possibilité d’appliquer cette tech-
nique à une échelle industrielle, tout en standardi-
sant la production, ce qui implique un bien meilleur
contrôle des risques sanitaires. Les premiers essais
cliniques ont été lancés aux États-Unis fin 2010 ; en
Europe, les agences réglementaires étudient des
dizaines de demandes d’essais cliniques similaires.
Les applications les plus avancées portent sur les
maladies neurodégénératives, sur celles de la rétine,
du cœur, de l’épiderme ou de la pigmentation, ainsi
que sur la production de tissus de remplacement, tel
que le sang. Pour de nombreuses maladies orphe-
lines, les CSE représentent aussi un grand espoir.
Moins avancées, mais également très promet-
teuses, les iPS – pouvant être obtenues à partir d’un
échantillon de peau ou de sang – permettent
d’envisager ces thérapies sous la forme d’autogreffes
ou à partir d’individus choisis pour leur compatibilité
avec le patient. On peut aussi produire des modèles
cellulaires de maladies à partir d’embryons écartés
lors de diagnostics préimplantatoires et contenant
des CSE porteuses de maladies génétiques. Grâce à
elles, il est possible de reproduire in vitro le type
cellulaire affecté par la pathologie, de l’étudier pour
mieux connaître les mécanismes de la maladie et les
façons de prévenir son apparition, ou simplement
de tester des médicaments potentiels.
Obtenir in vitro de minuscules mais nombreux
échantillons de cellules hépatiques, neurales, mus-
culaires ou cutanées permet de tester la toxicité de
produits entrant dans la consommation courante.
Ce type d’application aussi en est à ses débuts,
mais il ouvre la voie à une réduction drastique des
tests animaux. Nombre de spécialistes partagent
l’espoir que ces applications diminueront considé-
rablement le coût de développement des médica-
ments – et donc les coûts de santé – tout en
réduisant l’occurrence de la découverte tardive
d’effets secondaires graves.
Le frein de la législation française
La révision des lois de bioéthique françaises en
2011 maintient le statu quo juridique décidé en
2004 : interdiction de réaliser des recherches sur
l’embryon ou les cellules embryonnaires, tout en
permettant à l’Agence de la biomédecine de distri-
buer des dérogations encadrées à cette interdic-
tion. Rien ne bloque pourtant l’importation de
thérapies venant de ces technologies interdites…
La réussite du passage à l’étape suivante
– impliquant une production, ainsi qu’une mise en
banque à grande échelle des CS pluripotentes –
dépendra en grande partie des investissements du
secteur pharmaceutique et des établissements
de santé. Mais les contraintes que leur impose la
loi les rendent inenvisageables sur le territoire
français – tandis que la Belgique, l’Espagne, la
Suisse et la Grande-Bretagne (pour ne citer que
des voisins directs) ont des législations favorables
à de tels développements. À l’heure du « made in
France », il serait donc bénéfique pour la recherche
médicale française d’adapter le droit national aux
découvertes scientifiques anticipées. La filière
industrielle de thérapie cellulaire devra être créée
de toute pièce pour représenter, à terme, une part
conséquente de la médecine de demain. La France
a d’énormes atouts dans ce domaine. Cependant,
nous sommes en passe de reproduire l’histoire des
débuts de l’informatique individuelle en mettant
dans les bras de nos concurrents l’industrie de
santé de nouvelle génération, que nous avons for-
tement contribué à faire émerger. ●
❯
Au service
de la recherche
médicale.
À l’horizontale :
les étapes du
développement
humain et les types
de cellules souches
rencontrés.
À la verticale :
les étapes préalables
à l’utilisation
de ces cellules.
●
www.istem.eu
●
www.stempole-idf.com (réseau Île-de-France).
●
www.eurostemcell.org/fr (réseau européen).
●
www.stemcellnetwork.ca (réseau canadien).
●
www.isscr.org (Société internationale de
recherche sur les cellules souches ; en anglais).
SAVOIR
Nourrisson, enfant, adolescent, adulteCellule fécondée Blastocyste Embryon
+ 5,5 jours
Fécondation + 7,5 jours Naissance
iPS CSE
Fœtus
Ampli• cation
Progéniteurs intermédiaires
Ampli• cation
Différenciation
terminale
Cellules différenciées / fonctionnelles
+ 8 semaines
Pluripotente
Multipotente
CS des organes et tissus
fœtaux et adultes
Hématopoïétique
Neurale
Épidermales
Intestinales
Etc.
CS de cordon
ombilical
Hématopoïétique
Reprogrammation
(arti• cielle)
Mise en
banque
des cellules
pluripotentes
Mise en banque
des progéniteurs
intermédiaires
Engagement vers
une lignée spéci• que
© MIODRAG STOJKOVIC/SPL/COSMOS
© TEK IMAGE/SPL/COSMOS
1
/
2
100%