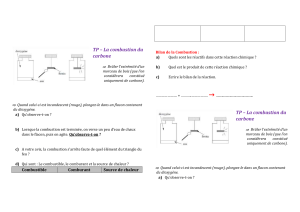
carburants - Terminale STI2D - Sciences Physiques

TRANSPORT

=> Les carburants sont un enjeu
économique et écologique pour les
prochaines années.
=> Les réserves pétrolières diminuent.
=> Nécessité de développer des carburnats
alternatifs.

Pétrole
Biocarburants


Exemple du PETROLE:
-Formation il y a 20 à 350 millions d’années à partir d’algues et
de plancton déposés au fond des océans
-Transformation des boues à des températures de 65°C à
120°C sous forte pression
=> Source d’énergie non renouvelable à notre échelle de
temps
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
1
/
23
100%