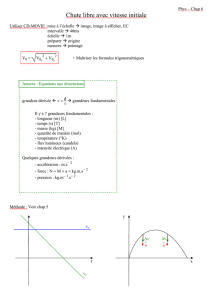
chapitre 3 - WordPress.com

CHAPITRE 3
APPLICATION DU 1er PRINCIPE
AUX GAZ PARFAITS

1- DÉPENDANCE DE LA
TEMPÉRATURE
L'énergie ( U ou H) d'un G. P. ne dépend que de la température
EXPÉRIENCE DE JOULE
* On n'observe, dans la plupart des cas, aucun changement de
température :
* Le second récipient étant vide, la pression extérieure nulle,
le travail effectué est nul.
Un gaz parfait (G P) se détend dans un
récipient vide. P et V changent.
D’après le 1er principe Donc
CONCLUSION

2- LA RELATION ENTRE CPet CV
On sait que : et
et
et
On simplifie par n DT on obtient:

3- DILATATION RÉVERSIBLE
ISOTHERME D'UN GAZ PARFAIT
Comme la température est constante alors DU est nul et la
première loi s'écrit: DU = Q + W = 0.
Comme la transformation est réversible, alors la pression
extérieure Pext appliquée est égale à la pression d'équilibre
du gaz P.

4-DILATATION RÉVERSIBLE ISOBARE
D'UN GAZ PARFAIT
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%